辣椒素诱导人肾癌细胞凋亡及其机制的研究
2015-12-02刘涛陶皇恒王刚方志海杨中华王行环周家杰
刘涛 陶皇恒 王刚 方志海 杨中华 王行环 周家杰
肾细胞癌是肾肿瘤中最常见的病理类型(约占 原发性肾恶性肿瘤的90%),位居泌尿系肿瘤第2位(仅次于膀胱癌),占全身恶性肿瘤的2%~3%[1]。早期肾癌预后较好,保留肾单位肾部分切除术和肾癌根治性切除术往往能取得较好的疗效。遗憾的是,肾癌临床表现多变而隐匿,早期不易发现,实际上约1/3的患者在获得确诊时已经发展为肾癌晚期[1]。而另一方面,肾癌对常规放化疗均不敏感,导致肾癌(尤其是晚期肾癌)的临床治疗方案相对缺乏[2-3]。因此,寻找新的、安全而有效的抗肾癌药物迫在眉睫。
辣椒素是辣椒等辛辣食物的主要有效成分,是一种香草酰胺类衍生物,其化学结构式为8-甲基-N-香草基-6壬烯基酰胺(C18H27NO3)。辣椒素对多种疾病(如疼痛[4]、皮肤病[5]、关节炎[6]等)具有广泛治疗效果,其抗癌效果也日益受到关注。但截至目前为止,尚未有文献报道辣椒素对肾癌细胞的作用效果及机制,因此,本课题组研究辣椒素诱导肾癌786-O细胞凋亡及相关分子机制,以探讨辣椒素作为抗肾癌药物的潜能。
材料与方法
一、细胞培养
人肾癌细胞株786-O(购自 ATCC)用含10%血清,100IU/ml青霉素和100μg/ml链霉素的RPMI 1640培养液常规培养(均购至Gibco公司)。
二、MTT检测
按照试剂盒(Corning Incorporated公司)说明书逐步操作:786-O细胞以5×103的密度种在96孔板中,用不同浓度的辣椒素(使用抑制剂辣椒平时,抑制剂较辣椒素提前2h使用,浓度为2μmol/L)处理,每组设置10个孔。分别孵育12、24和48h后,弃去液体,加入20μl的 MTT (5mg/ml,Sigma公司),37℃下孵育4h。然后小心除去上清,加入150μl DMSO。490nm下测定吸光度。
三、活性氧检测
按照活性氧试剂盒(碧云天生物科技有限公司,南通)说明书:先将786-O细胞种植于96孔板(每孔1×104细胞),用不同浓度的辣椒素(使用抑制剂辣椒平时,抑制剂较辣椒素提前2h使用,浓度为2μmol/L)处理24h,然后更换培养液为含有终浓度为10μmol/L DCFH-DA的无血清培养液,避光孵育20min。再用无血清培养液清洗3遍,荧光酶标板读数。
四、细胞凋亡检测
常规培养细胞至50%~70%融合度,加入含不同浓度辣椒素(使用抑制剂辣椒平时,抑制剂较辣椒素提前2h使用,浓度为2μmol/L)的完全培养液。辣椒素孵育达指定时间后,胰酶消化,收集细胞,用含FITC-Annexin V(PharMingen,San Diego,CA)以及PI的缓冲液室温避光孵育5min,然后用流式细胞仪检测细胞凋亡率。此外,Hochest染色用于显示凋亡形态学变化。前期处理同流式细胞实验,辣椒素处理后,更换培养液为含有10μmol/L Hochest 33258染料的PBS,避光孵育30min,充分洗涤后再倒置荧光显微镜下观察。
五、RT-PCR
786-O细胞总RNA用TRIzol(Invitrogen公司)提取,按反转录试剂盒(Thermo scientific公司)的说明进行反转录。转录条件:预变性94℃/2min;变性94℃/30s,退火60℃/30s,延伸72 ℃/60s,35 个 循 环;延 伸 72 ℃/10min。TRPV1上游引物:5′-TTCCGA GGG ATT CAG TAT TT-3′;下游引物:5′-TGA GCA GGA GGA TGT AGG TG-3′;内参β-actin上游引物:5′-AGA AGG ATT CCT ATG TGG GCG-3′,下游引物:5′-CAT GTC GTC CCA GTT GGT GAC-3′。
六、Western blot
细胞用PBS洗涤2次,1%Triton裂解缓冲液冰上裂解。BCA法测定蛋白浓度。95℃变性10min后,蛋白样品在7.5%、10%、12.5%或15%的聚丙烯酰胺凝胶上电泳,将分离的蛋白电转至PVDF膜。将载有蛋白的PVDF膜用TBST溶液漂洗3次10min,然后与指定抗体共孵育4℃过夜。再次用TBST溶液漂洗3次10min后,与二抗室温下作用2h。漂洗后用ECL显色试剂盒显色,并于暗室内用胶片曝光、显影及定影。所用抗体如下:抗TRPV1抗体(1∶200,#ACC-030)购至 Alomone Labs公司(Jerusalem,Israel);抗 GAPDH 抗体(1∶1 000,sc-166574)购至Santa Cruz Biotechnology公司(USA);抗FADD抗体(1∶1 000,#2782),抗caspase-3抗体(1∶500,#9665),抗caspase-8抗体(1∶1 000,#9496),抗caspase-9抗体 (1∶1 000,#9502),均购自 Cell Signaling Technologies公司(Danvers,MA);抗 Bcl2 (1∶1 000,#12789-1-AP),抗Bax(1∶1 000,#50599-2-Ig)购自ProteinTech Group公司(Chicago,USA);抗c-myc(1∶1 000,#ab32072)购自 Abcam 公司 (Cambridge,UK)。
七、统计学方法
采用SPSS 13.0软件进行统计处理,所有数据以均数±标准差表示。采用方差分析,以P<0.05为差异有统计学意义。
结 果
一、辣椒素抑制细胞增殖
用不同浓度的辣椒素(0、50、100、200、300、400μmol/L)处理786-O细胞,分别检测药物作用12、24和48h的细胞存活率。细胞生存率曲线表明,辣椒素以剂量依赖关系和时间依赖关系抑制786-O细胞存活率。如图1所示,在48h组,与对照组相比,50、100、200、300、400μmol/L辣椒素使786-O细胞生存率分别下降了17.24%、35.10%、58.09%、64.80%。时间依赖性数据显示,当使用200μmol/L辣椒素处理时,12、24和48h药物孵育分别降低4.21%、20.72%、58.09%的细胞生存率。
二、辣椒素受体TRPV1在786-O细胞中的表达
通过RT-PCR和Western blot检测TRPV1在786-O细胞的表达情况。如图2所示,无论在信使RNA水平还是在蛋白水平,786-O细胞中都检测到TRPV1表达。阳性对照为2株膀胱癌细胞T24和5637,本课题组前期研究已经证实这2株细胞中TRPV1的表达[7-8]。此外,通过使用TRPV1特异性拮抗剂辣椒平,我们发现当使用辣椒平预处理786-O细胞时,辣椒素对786-O细胞的增殖抑制效应被显著削弱,即辣椒平预处理后,400μmol/L辣椒素仅能引起18.39%的增殖抑制率,这甚至低于单独使用200μmol/L辣椒素的效应(图1B)。这表明,TRPV1的确参与了辣椒素对786-O细胞的增殖抑制效应。
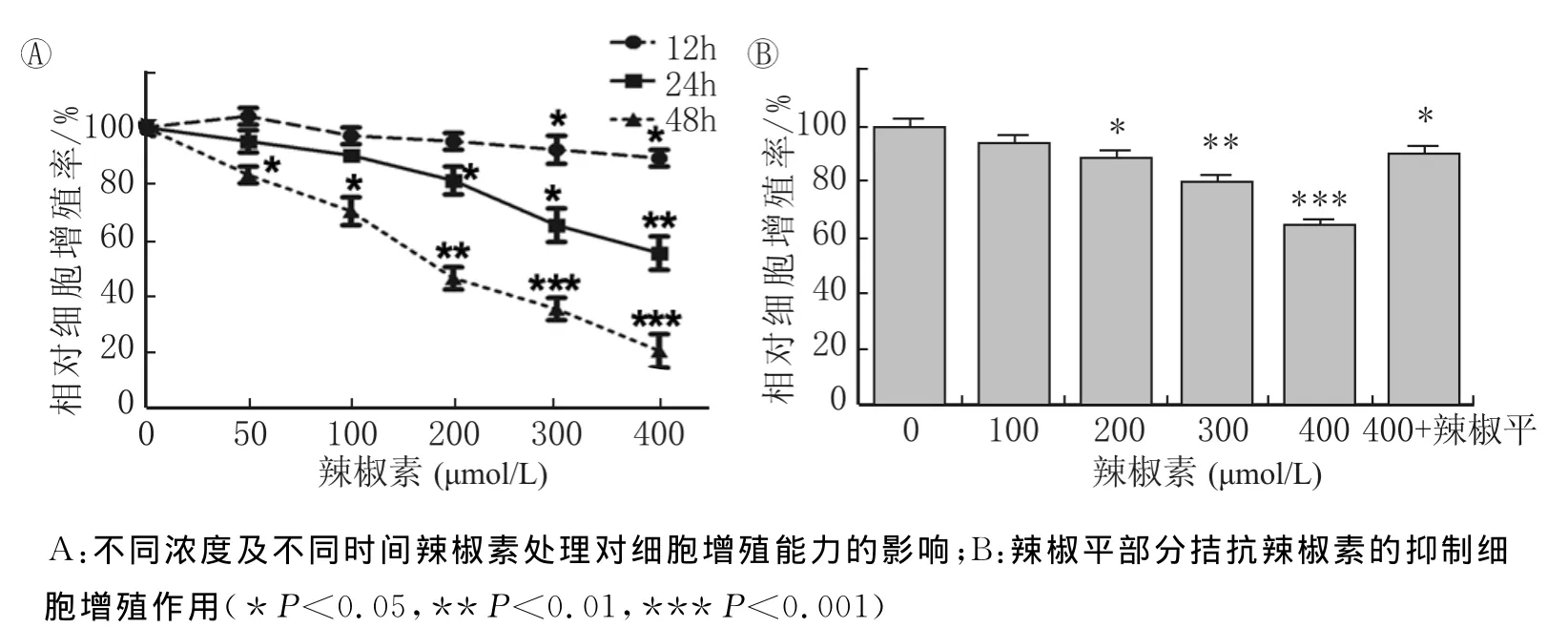
图1 辣椒素对786-O细胞的增殖抑制
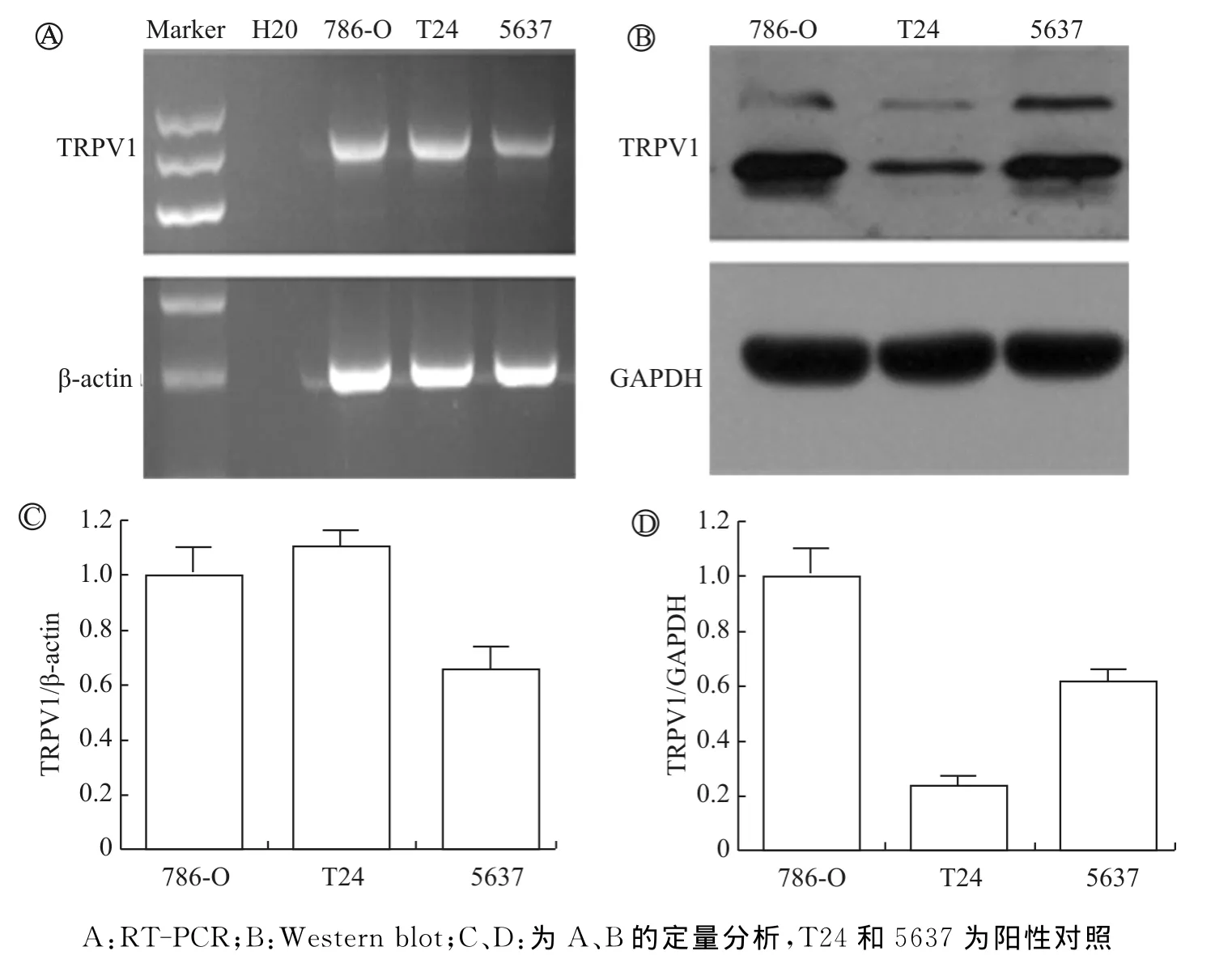
图2 TRPV1的表达
三、辣椒素使细胞内活性氧水平升高
活性氧测定结果表明,与对照组相比,100、200和300μmol/L辣椒素分别增加了25.35%、83.74%和162.80%的活性氧水平(图3)。同样,辣椒平预处理也能对抗该效应,图3的数据显示,辣椒平预处理后,300μmol/L辣椒素仅能引起23.49%的活性氧增加,这仅与单独使用100μmol/L辣椒素的效应相当。

四、辣椒素诱导786-O细胞凋亡
流式细胞实验结果表明,100、200和300μmol/L辣椒素处理24h后细胞凋亡率分别为7.11%、11.13%和17.80%,与对照组(凋亡率1.98%)相比差异均有统计学意义(图4A和4B)。同样,辣椒平预处理使得辣椒素促凋亡效应也大大减弱,300μmol/L辣椒素单独处理时凋亡率为17.80%,而加用辣椒平预处理后再用辣椒素时凋亡率仅为7.72%(图4A和4B)。此外,Hochest染色显示,辣椒素处理后,786-O细胞内发生了显著的核浓缩和核碎裂现象,且凋亡形态学变化也能被辣椒平减弱(图4C)。
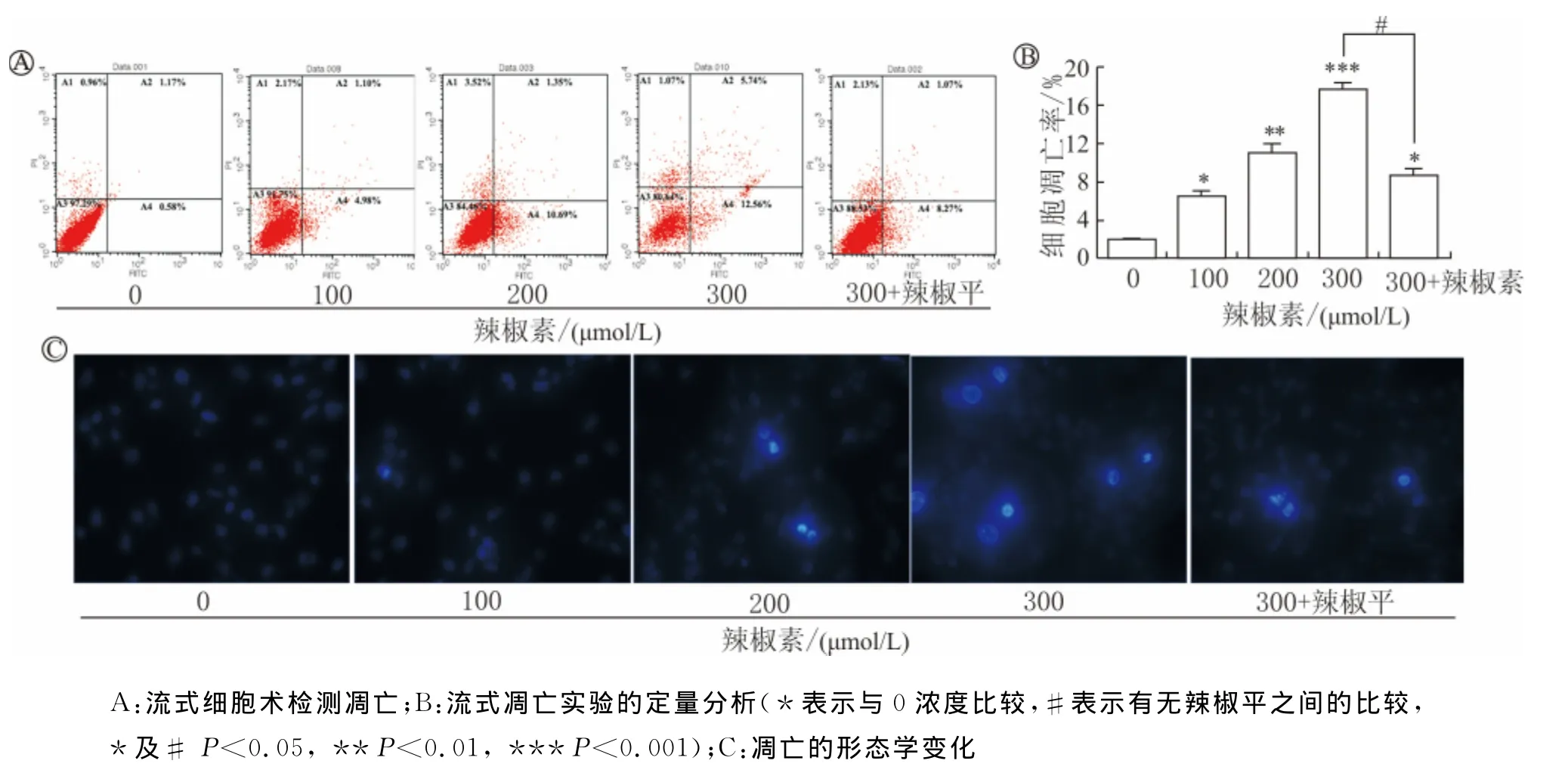
图4 辣椒素诱导786-O细胞凋亡及辣椒平对该效应的影响
五、凋亡相关分子的变化
本实验用Western blot技术检测具有代表性的凋亡相关分子(包括c-myc、FADD、Bax及caspase-3、-8、-9裂解片段等)表达水平的变化。实验结果表明,辣椒素处理能显著促进促凋亡分子c-myc、FADD、Bax等的表达,以及caspase-3、-8、-9等凋亡分子的裂解激活,而降低抗凋亡分子Bcl2的表达水平(图5)。

图5 凋亡相关分子的表达变化
讨 论
辣椒作为食物调料和传统药物已有上千年历史。流行病学资料显示,偏食辣味食物的墨西哥人和印度人,其癌症发病率远低于欧美人[9]。辣椒素是辣椒主要活性成分,它作为配体能刺激选择性钙通道TRPV1,引起该通道激活释放Ca2+流,增加细胞内Ca2+浓度,从而引发一系列生理病理变化[10]。辣椒素对风湿性关节炎、骨关节炎、糖尿病性神经痛、带状疱疹后遗性神经痛及银屑病等的临床疗效已经得到充分肯定[4-6]。近年来,有关辣椒素抗癌效应的研究在国内外均日益受到关注。研究初步证明辣椒素不仅在体内外对多种肿瘤细胞(如人膀胱癌[7,11]、前列腺 癌[12]、神 经 胶 质 瘤[13]和 胃 癌[14]等)的增殖具有显著抑制效应,并且破坏线粒体从而引发肿瘤细胞凋亡,还可以激活机体的抗肿瘤特异性免疫活性,此外还可抑制肿瘤新生血管形成[15],但对正常健康细胞毒性作用极低[16]。这充分提示,作为一种天然食材成分,辣椒素具有成为新一代广谱抗肿瘤药物的潜力。
肾细胞癌对常规放化疗不敏感,这对肾癌(尤其是晚期肾癌)的临床治疗带来了极大的困难。截至目前为止,辣椒素对肾癌是否有效在国内外文献中均未见报道。本研究发现,辣椒素能降低786-O细胞的存活能力,而该抑制效应能被TRPV1拮抗剂辣椒平减弱,说明TRPV1参与了辣椒素786-O细胞的抗增殖效应。更进一步地研究还发现辣椒素能引起显著的细胞凋亡,该效应同样也能被辣椒平部分抵消。辣椒素诱导细胞凋亡的机制可能与促凋亡分子c-myc、FADD、Bax等的表达升高,和caspase-3、-8、-9等凋亡分子的裂解激活,以及抗凋亡分子Bcl2的表达水平下降等有关。辣椒素作为潜在抗肿瘤药物具有以下4个方面的优势:①辣椒素是天然食材成分,人类上千年的实践证明其作为食物和药物的安全性,美国早在1999年就将辣椒素及其同系物(统称为辣椒素类物质)引入药典;②辣椒素通过TRPV1介导其抗增殖效应和促凋亡效应,而本研究证实TRPV1在肾癌细胞(786-O细胞)中表达,有可能成为肾癌治疗的新靶标;③辣椒素能显著促进肾癌细胞的凋亡发生,抑制肿瘤细胞逃逸凋亡途径,其机制可能为促凋亡分子c-myc、FADD、Bax等的表达升高,和caspase-3、-8、-9等凋亡分子的裂解激活,以及抗凋亡分子Bcl2的表达水平下降;④辣椒素在减轻疼痛方面的作用已经被肯定[4],基于这一点可以推断其对减轻晚期肾癌患者的疼痛、提高生存质量方面也可能具有较大的优势。
综上所述,辣椒素可抑制肾细胞癌786-O细胞的增殖,诱导其凋亡,其抗肿瘤效应有可能受到TRPV1的介导。然而,本研究尚有待完善之处,比如本实验使用单一细胞系,仅能证明辣椒素对单一细胞有效,而尚不能排除细胞特异性效应。另外,未使用正常肾源性细胞系作为对照,无法强有力证实药物对肿瘤的选择性杀伤效应。因此,在本课题组的进一步深入研究中,将对以上不足作更为细致的探讨。当然,进一步探讨TRPV1在正常肾组织和肾肿瘤组织中的表达差异模式将对肾癌靶向治疗提供更加可靠的理论依据。此外,有关辣椒素衍生物对肾癌细胞的抗癌效应(包括对肿瘤发生、肿瘤细胞周期、肿瘤转移等方面的影响)及辣椒素诱导肾癌细胞凋亡的信号通路和信号转导机制有待进一步研究探讨。
[1] Nelson EC,Evans CP,Lara PJ.Renal cell carcinoma:current status and emerging therapies[J].Cancer Treat Rev,2007,33(3):299-313.
[2] Shah AY,Karam JA,Lim ZD,et al.Clinical and pathological complete remission in a patient with metastatic renal cell carcinoma(mRCC)treated with sunitinib:Is mRCC curable with targeted therapy?[J].Urol Case Rep,2015,3(2):18-20.
[3] Liu XD,Hoang A,Zhou L,et al.Resistance to anti-angiogenic therapy is associated with an immunosuppressive tumor microenvironment in metastatic renal cell carcinoma[J].Cancer Immunol Res,2015,3(9):1017-1029.
[4] Evangelista S.Novel therapeutics in the field of capsaicin and pain[J].Expert Rev Clin Pharmacol,2015,8(4):373-375.
[5] Agrawal U,Gupta M,Vyas SP.Capsaicin delivery into the skin with lipidic nanoparticles for the treatment of psoriasis[J].Artif Cells Nanomed Biotechnol,2015,43(1):33-39.
[6] Borbely E,Botz B,Bölcskei K,et al.Capsaicin-sensitive sensory nerves exert complex regulatory functions in the serum-transfer mouse model of autoimmune arthritis[J].Brain Behav Immun,2015,45:50-59.
[7] Yang ZH,Wang XH,Wang HP,et al.Capsaicin mediates cell death in bladder cancer T24cells through reactive oxygen species production and mitochondrial depolarization[J].Urology,2010,75(3):735-741.
[8] Chen D,Yang Z,Wang Y,et al.Capsaicin induces cycle arrest by inhibiting cyclin-dependent-kinase in bladder carcinoma cells[J].Int J Urol,2012,19(7):662-668.
[9] Athanasiou A,Smith PA,Vakilpour S,et al.Vanilloid receptor agonists and antagonists are mitochondrial inhibitors:how vanilloids cause non-vanilloid receptor mediated cell death[J].Biochem Biophys Res Commun,2007,354(1):50-55.
[10] Minke B.TRP channels and Ca2+ signaling[J].Cell Calcium,2006,40(3):261-275.
[11] Li Q,Wang XH,Yang ZH,et al.Induction of cell cycle arrest in bladder cancer RT4cells by capsaicin[J].Zhonghua Yi Xue Za Zhi,2010,90(18):1230-1233.
[12] Sanchez AM,Martínez-Botas J,Malagarie-Cazenave S,et al.Induction of the endoplasmic reticulum stress protein GADD153/CHOP by capsaicin in prostate PC-3cells:a microarray study[J].Biochem Biophys Res Commun,2008,372(4):785-91.
[13] Kim JY,Kim EH,Kim SU,et al.Capsaicin sensitizes malignant glioma cells to TRAIL-mediated apoptosis via DR5 upregulation and survivin downregulation[J].Carcinogenesis,2010,31(3):367-375.
[14] Meral O,Alpay M,Kismali G,et al.Capsaicin inhibits cell proliferation by cytochrome c release in gastric cancer cells[J].Tumour Biol,2014,35(7):6485-6492.
[15] Min JK,Han KY,Kim EC,et al.Capsaicin inhibits in vitro and in vivo angiogenesis[J].Cancer Res,2004,64(2):644-651.
[16] Zelent A,Petrie K,Chen Z,et al.Molecular target-based treatment of human cancer:summary of the 10th international conference on differentiation therapy[J].Cancer Res,2005,65(4):1117-1123.
