平滑肌肉瘤的二维及彩色多普勒超声表现分析
2015-12-02唐远姣杨裕佳
钟 琳,唐远姣,杨裕佳
(四川大学华西医院超声诊断科,成都 610041)
平滑肌肉瘤(leiomyosarcoma,LMS),是一种来源于平滑肌细胞的恶性肿瘤,发病率约占所有软组织恶性肿瘤的5%~10%,好发于中老年人,女性发病率高于男性,发生部位包括躯干、四肢、腹腔及腹膜后深部及浅表软组织[1],关于平滑肌肉瘤的影像学研究多为MRI或CT,超声大宗病例报道较少。本文回顾性分析经手术病理证实的58例LMS患者的临床及超声表现,旨在评价超声对该病的诊断价值。
1 资料与方法
1.1 一般资料
收集我院2005~2014年内,58例手术病理证实为LMS的患者资料,共分析61个病灶(病灶分布于61处部位,肝脏及腹膜后同时存在病灶患者2例,腹膜后先后两次复发病灶患者1例),其中原发性病灶41个,复发转移性20个;男性21例,女性37例,男女比例约1∶1.8;年龄20~82岁,平均年龄(51.7 ±13.3)岁。
1.2 方法
检查仪器采用 Philips IU22,Philips HD11,Philips HDI5000,GE LOGIQ E9型实时彩超诊断仪,探头频率为5~12MHz线阵探头及2~5MHz凸阵探头。结合病人临床及手术资料,统计分析发病年龄、性别、发病部位、团块大小、边界、形态、内部回声、团块的血流情况,评价超声对病变的定位准确率及判断病变对周围组织产生压迫或侵犯征象的准确率。对于同一部位多发病灶以体积较大者为分析目标。将60%以上的病灶所拥有的超声表现定义为常见超声表现。肿块内血流情况按照 Adler半定量法[2]分为:0级,肿块内未见血流信号;1级,可见1~2处点状血流;2级,可见1条主要血管,其长度超过肿块的半径或同时可见2~3条小血管;3级,可见4条以上血管,或血管相连通交织成网状。
1.3 统计学处理
应用SPSS18.0统计软件进行数据分析。率的比较采用X2检验(当总数<40时,运用连续矫正法检验),P<0.05为差异有统计学意义。
2 结果
2.1 发生部位
61个病灶分别位于腹膜后34个(55.7%,肿瘤主体分布以中上腹部为主,下腹部仅3个),腹腔脏器 11个(18.0%),躯干及四肢软组织 13个(21.3%),下腔静脉 1 个(1.6%),股总静脉 2 个(3.3%),肿块具体的病变部位见表1。58例病人中单发病灶 52例(89.7%),多发病灶 6例(10.3%,分别位于肝脏3例,腹壁2例,臀部1例),其中4例为复发转移性病灶(图1)。
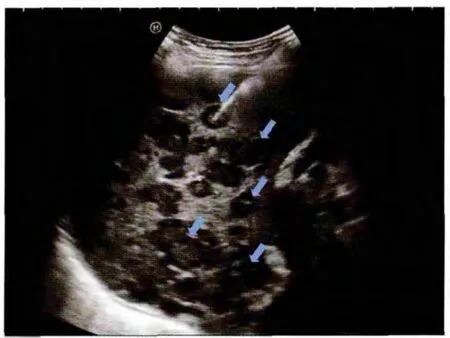
图1 肝脏转移性LMS,实质内散在多个低弱回声团块(箭头所示)
2.2 超声表现
超声显示肿瘤大小 2.1~40cm,平均(8.6±5.8)cm。61个病灶超声声像图表现为低弱回声52个(85.2%),混合回声 7 个(11.5%),稍强回声 2个(3.3%),边界较清楚 45 个(73.8%),不清楚 16个(26.2%),形态较规则25 个(41.0%),不规则36个(59.0%),内部回声较均匀 30 个(49.2%),不均匀31 个(50.8%)(图 2),其中液化 13 个(21.3),钙化4 个(6.6%),内部血流 0 级15 个(24.6%),1~2 级38 个(62.3%,图3),3 级8 个(13.1%)。与手术结果相对比,超声准确定位病变部位58处,3处腹膜后原发病变分别误诊为肠道来源、肾脏及肝脏肿瘤,超声对病变定位准确率95.1%;超声提示肿瘤包绕或压迫邻近器官征象20例,包括包绕或推挤相邻脏器引起位置形态的改变10例,以及压迫引起的继发改变如输尿管扩张及肾积水7例、血管变窄3例(图4);超声提示肿瘤对周围组织浸润13例(包括与组织分界不清9例、骨质破坏1例、血管腔内癌栓2例、淋巴结肿大1例),手术证实对周围组织侵犯18例,超声准确率72.2%。有46例患者共49个病灶同时行CT/MRI检查,超声与CT/MRI的检出率均为100%,超声与CT/MRI两组病变发现率、定位准确率、提示包绕压迫征象及浸润征象率的差异无统计学意义(P>0.05),见表2。
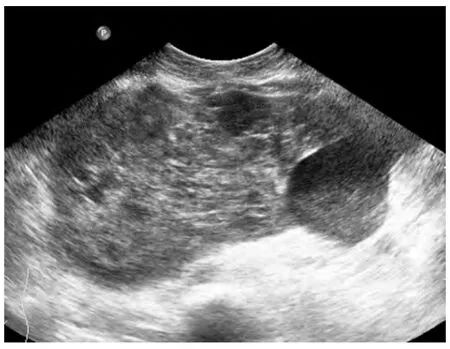
图2 腹膜后LMS,内部回声不均匀,可见片状无回声区
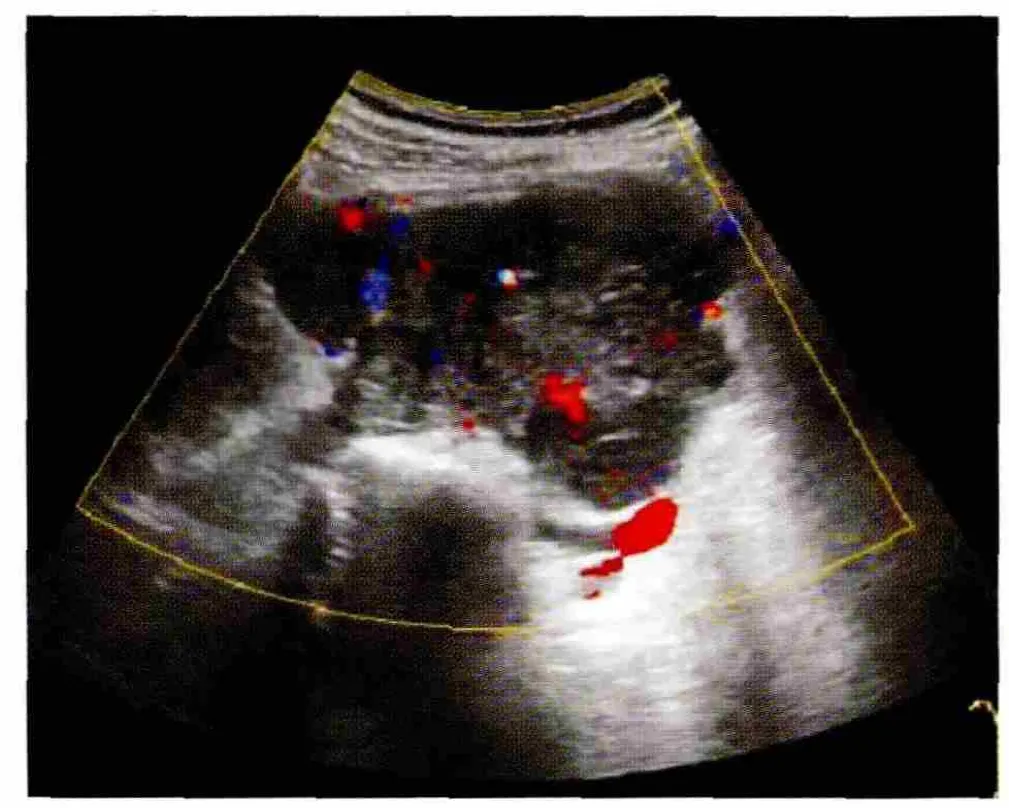
图3 腹膜后LMS,略呈分叶状,内可见点线状血流信号,血流2级
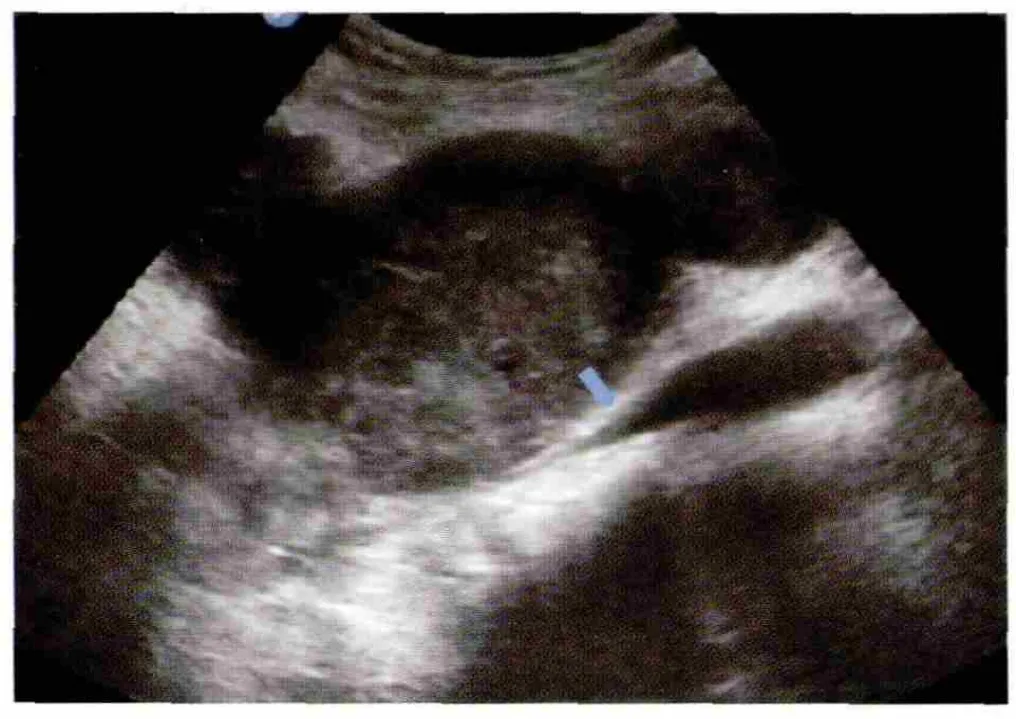
图4 腹膜后LMS,边界较清,弱回声,呈分叶状,压迫下腔静脉(箭头所示)
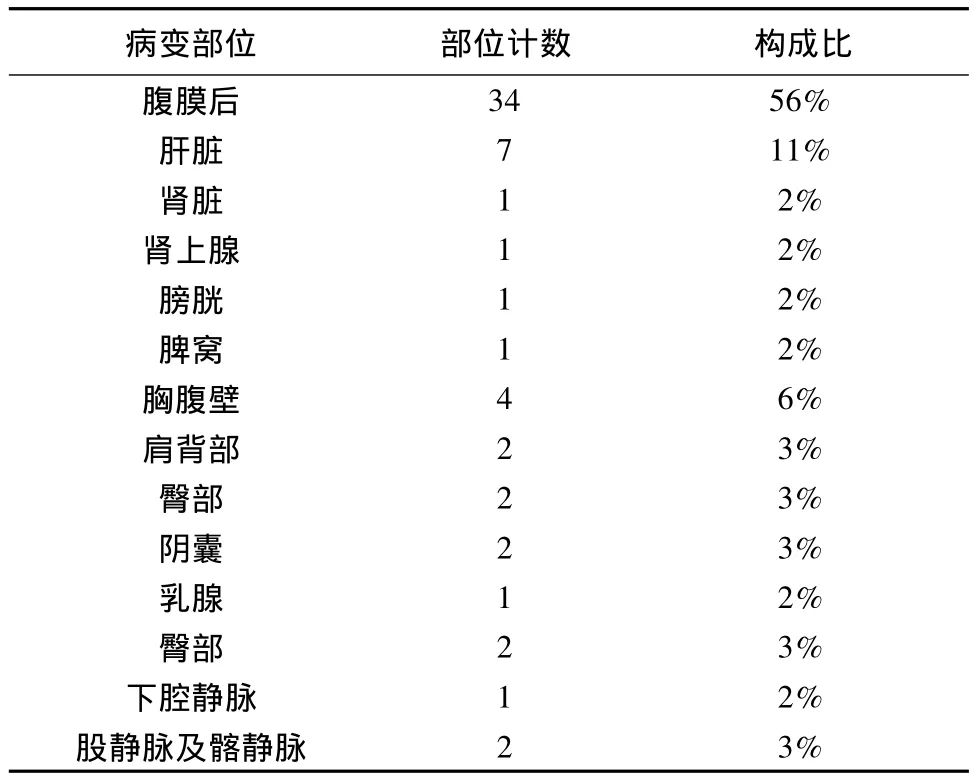
表1 病变分布部位及部位计数(构成比%)
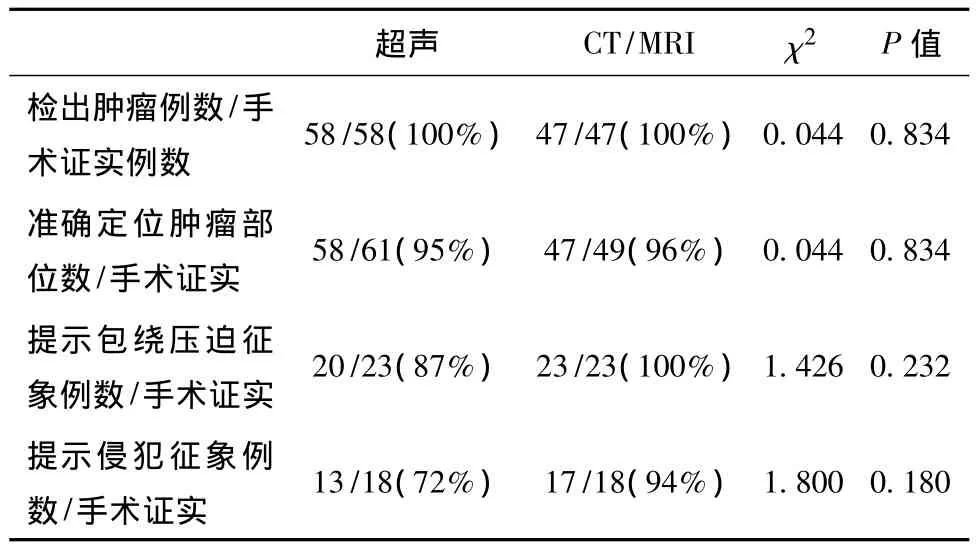
表2 超声与CT/MRI诊断符合率比较
3 讨论
平滑肌肉瘤是一种恶性度较高的肿瘤,发病率较低,好发于40~60岁人群,女性较男性发病率略高,可发生于全身各个部位,以腹膜后常见,LMS在腹膜后原发性恶性肿瘤中发病率仅次于脂肪肉瘤,约占15%[3]。按其发生部位可分为3大类别:①腹膜后及腹腔脏器;②皮肤及皮下软组织平滑肌肉瘤;③血管源性平滑肌肉瘤[4]。该病病因不明,临床表现多无特殊性,发生于腹膜后者多以腹胀及腹部扪及较大包块就诊,发生于腹腔及大血管者引起相应脏器的症状体征,如腹痛、体重减轻、黄疸、水肿等,发生于浅表软组织者常可扪及体表包块,可伴有局部的疼痛。分化较好和分化中等的LMS特征病理表现为由交织条束状或平行束状排列的嗜伊红梭形细胞组成,核居中;局部可见核深染、不规则的瘤巨细胞。另一特征为细胞内有纵行肌丝,分化较差的LMS瘤细胞呈现明显的多形性和异型性,细胞间排列紊乱[3,5]。手术切除是最主要的治疗方式,但由于该病侵袭性高,多不能完整切除,约有50%~70%复发率及30%~40%的远处转移率[6],在全身软组织肉瘤中预后较差,生存率低。根据预后及手术方式等因素,又可将其分为躯干软组织LMS,皮肤LMS及血管LMS[7],其中皮肤LMS尤其是局限于真皮层的病变,预后最好,局部复发率仅5%[6]。
本组病灶大小平均为(8.6±5.8)cm,腹膜后LMS平均为(8.9±7.1)cm,以发生率 >60%为常见超声表现,本组肿瘤的常见超声表现以实质性低弱回声为主,边界较清楚,血流信号多为1~2级。本组病灶超声表现与临床及病理结合发现:①有13个病灶超声表现出片状无回声区,内部可见细弱光点,与LMS通常呈扩张性生长,常出现液化坏死[3,8]的病理特征相符;②本组病例中腹膜后LMS分布以中上腹部为主,盆部仅3例,上述情况或为LMS分布另一特征,有待更多的病例进一步证实;③该病复发转移率高,本组病例中复发性病灶15例,转移性5例,其中腹腔及腹膜后原位复发9例,有1例病人连续两次复发;13例浅表组织中复发6例,转移性1例;7例肝脏LMS中有4例为转移性,并有3例为多发病灶,与文献报道LMS易通过血道转移到肝脏、肺等脏器相符[9];④本组共有4个病灶内出现钙化,其中3个为浅表LMS,提示浅表组织中出现钙化几率较高。CT是评价腹腔及腹膜后LMS病变范围及对周围结构的侵犯最主要的手段,平扫表现多为不规则实性团块,体积较大,密度不均匀,易于包裹或侵犯周围大血管,增强扫描呈持续性轻中度强化。必要时行MRI用于进一步评价肿瘤边界、血管丰富程度和血管侵犯情况。LMS体积一般较大,超声对病灶的检出率高,且由于LMS肝脏转移灶容易发生液化,超声显示肿瘤囊性变较CT等敏感[5,10]。本组病例中超声与 CT/MRI对 LMS检出率均为100%,超声对病变定位准确率97%,提示肿瘤包绕或压迫征象准确率87%,提示侵犯准确率72%,而CT/MRI对LMS的定位准确率96%,提示包绕压迫及侵犯准确率分别为100%、94%,二者之间差异无统计学意义。超声是LMS辅助诊断的重要影像学检查方法之一。
鉴别诊断:腹膜后LMS应与腹膜后脂肪肉瘤鉴别,脂肪肉瘤体积多较LMS大,高分化脂肪肉瘤其超声表现为稍强回声或以稍强回声为主的不均质回声团块,多提示脂肪来源肿瘤,而LMS多表现为低弱回声团块,鉴别不难[11]。其他亚型脂肪肉瘤内部多为低至中等回声,也可发生坏死液化,伴有骨化或去分化成分时出现强回声斑[12-13],与LMS表现类似,超声鉴别困难。
横纹肌肉瘤好发于青少年儿童,以头颈部最常见(约占40%),发生于腹膜后约占 7%[13-14],腹膜后包块多位于盆骶部,与本组病例LMS好发于中上腹部有明显不同,且横纹肌肉瘤回声多较均匀,液化及钙化表现少见[15]。
文献报道血管LMS好发于下腔静脉,且发病率约占所有下腔静脉肿瘤的50%~75%[16-17],本组中1例发生于下腔静脉,另2例发生于股静脉,其中1例同时累及髂静脉,表现为血管腔内实质性弱回声充填,均未浸及血管腔外,实质成分内可见点线状的信号。当检查中发现不典型“血栓”时,检查者应有该病可能的意识,适当调节仪器能较好显示实质内点线状血流信号并探及动脉频谱,进一步结合超声造影,团块动脉期不均匀强化,静脉期清退的表现,诊断LMS不难。
综上所述,LMS好发于中老年,腹膜后发生率较高,肿瘤体积较大,超声常见表现为弱回声,边界多较清,内部多可见点线状血流,超声对LMS发现率高、定位准确率较高,能发现对周围组织器官的压迫或浸润,对发现病变、定位病变及病人手术方式的选择有临床意义。
[1] Antonescu CR,Erlandson RA,Huvos AG.Primary leiomyosarcoma of bone:a clinicopathologic,immunohistochemical,and ultrastructural study of 33patients and literature review[J].Am J Surg Pathol,1997,21(11):1281-1294.
[2] Adler DD,Carson PL,Rabin JM,et al.Doppler ultrasound color flow imaging in the study of breast cancer:preliminary findings[J].Ultrasound Med Biol,1990,16(6):553-559.
[3] 王 坚,喻 林.腹膜后软组织肿瘤病理学类型和组织学特征[J].中国实用外科杂志,2013,33(10):821-825.
[4] 王炯元,朱 隽,练士贤,等.腹部软组织平滑肌肉瘤外科治疗体会[J].外科理论与实践,2012,17(40):346-348.
[5] 周宇红,陆维祺.腹腔和腹膜后平滑肌肉瘤[J].外科理论与实践,2012,17(4):308-311.
[6] Massi D,Franchi A,Alos L ,et al.Primary cutaneous leiomyosarcoma:clinicopathological analysis of 36 cases[J].Histopathology,2010,56(2):251-262.
[7] Bharti JN,Dey B,Desai P,et al.Primary leiomyosarcoma of peritoneal cavity[J].Rare Tumors,2014,6(5165):22-23.
[8] Vallejo M,Reinado D,Achirica M ,et al.Giant retroperitoneal leiomyosarcoma.multiorgan block removal[J].Int J Surg Case Rep,2014,5(12):1050 – 1053.
[9] Metta H,Corti M,Trione N,et al.Primary hepatic leiomyosarcomaa rare neoplasm in an adult patient with AIDS:second case report and literature review[J].J Gastrointest Cancer,2014,45(1):S36– S39.
[10]娄宏智.腹膜后平滑肌肉瘤的CT-病理表现特征及其诊断[J].中国 CT 和 MRI杂志,2009,7(1):42-44.
[11]王 蕾,宋 光.原发性腹膜后脂肪肉瘤的超声和CT诊断[J].中国疗养医学,2013,22(12):1068-1069.
[12]马青梅.腹膜后肿瘤46例超声诊断分析[J].长江大学学报(自然科学版),2011,8(12):168-169.
[13]刘玉林,陈长春,陈 宪.原发腹膜后少见肿瘤的影像鉴别诊断[J].临床放射学杂志,2014 ,33(6):950-952.
[14] Freling NJ,Merks JH,Saeed P,et al.Imaging findings in craniofacial childhood rhabdomyosarcoma[J].Pediatr Radiol,2010,40(11):1723-1738.
[15]诸静其,汤光宇,周国兴,等.横纹肌肉瘤的影像学诊断[J].临床放射学杂志,2014,33(8):1237-1242.
[16] Suffat LP,Mazza L,Farina EC,et al.Leiomyosarcoma of the inferior vena cava:report of two cases and review of literature[J].Ann Ital Chir,2007 ,78(4):303-306.
[17]虞奇跃.原发性下腔静脉平滑肌肉瘤的CT诊断[J].医学影像学杂志,2013,23(12):2020-2023.
