IL-8在猪脑死亡器官供体模型的变化及其与肾功能指标的相关性分析
2015-11-30陈立冯学泉万晨光左娜穆红
陈立 冯学泉 万晨光 左娜 穆红
目前,针对脑死亡供体(donation after brain death,DBD)器官的保护效果不甚理想,即使在西方发达国家,仍有约25%的潜在DBD器官在维护过程中逐渐失去功能。研究[1,2]表明脑死亡过程可诱导炎症和免疫反应的发生,从而对潜在供体器官的质量造成损伤。因此,为提高DBD器官质量,有必要就脑死亡过程急性炎症反应进行深入探讨。白细胞介素-8(interleukin-8,IL-8)亦称为嗜中性粒细胞趋化因子,为公认的介导炎性反应的细胞因子。其来源可以是单核细胞、巨噬细胞、内皮细胞、成纤维细胞和表皮细胞等,生物学作用不但能趋化嗜中性粒细胞,而且趋化T淋巴细胞和嗜碱性粒细胞,在杀伤病原微生物的同时也会对自身组织细胞造成损伤。
本文通过对实验长白小猪的脑死亡模型时间序列IL-8的水平检测研究,进一步为DBD器官抗炎损伤的保护提供理论和实践依据。
1 材料与方法
1.1 实验动物 健康、清洁级长白小猪7头,体质量(33.6±4.7)kg,雌雄不限,购自天津市动物实验中心。术前禁食12 h,禁水6 h。
1.2 主要设备 美国强生Codmen颅内压监测仪;以色列RIMED公司经颅多普勒(transcranial doppler,TCD); 美国BIOPAC公司MP150型 16通道生理信号记录分析系统;美国HARVARD动物手术台;美国Matrx model 3000型动物麻醉机;深圳Beneview T8麻醉监护仪;美国Cobas DDP全自动生化分析仪。
1.3 脑死亡模型建立 取猪称重,麻醉后备皮,股动、静脉插管,分别接压力传感器(描记动脉压)和静脉通道;气管插管接微型呼吸器并监测呼吸波;连接心、脑电图电极监测心、脑电图;膀胱造瘘;颅顶正中开孔经导管渐进式注入生理盐水,直至达到脑死亡标准。静脉滴注多巴胺≤10μg/kg·min维持循环,观察心电图、血压及血气的变化。
脑死亡判定标准及颅内加压停止标准参考我国2009年颁布的《脑死亡判定标准(成人)》[3],拟定脑死亡判定标准如下:(1)瞳孔对光反射消失;(2)角膜反射消失;(3)刺激猪头面部,实验猪无反应;(4)无自主呼吸;(5)经TCD显示振荡波、尖小收缩波或血流信号消失;(6)脑电图显示电静息;(7)阿托品试验阴性。首次判定12 h后再次复查,结果仍符合脑死亡判定标准者,方可最终确认为脑死亡。
1.4 颈内静脉取血时间点及处理 麻醉、插管、放置探头等处理后,分别在颅内加压前、脑死亡0 h、脑死亡3 h、脑死亡6 h、脑死亡9 h各时间点取静脉血5 ml,室温静置 1-2 h 后,以离心半径 15 cm,3000 r/min离心10 min分离血清,置于-80℃保存待测。
1.5 IL-8及肾功能指标检测 采用免疫芯片荧光定量法检测血清IL-8水平,试剂由广州RayBiotech公司提供。采用美国Cobas DDP全自动生化分析仪及其配套试剂检测血清尿素、肌酐(creatinine,Cr)水平。严格按试剂盒说明书进行操作。
1.6 统计学处理 采用SPSS18.0统计软件对数据进行统计学分析。IL-8 检测结果采用 M(P25~P75)表示,脑死亡后各时间点与脑死亡前IL-8检测结果比较采用Mann-Whitney U检验,脑死亡后各时间点IL-8检测结果比较采用独立样本非参数Kruskal-Wallis H检验;肾功能指标检测结果以±s表示,脑死亡后各时间点与脑死亡前肾功能指标检测结果比较采用独立样本t检验;IL-8各时间点检测结果与肾功能指标间的相关性分析采用双侧Spearman相关性分析,以P<0.05为差异有统计学意义。
2 结果
2.1 脑死亡前后各时间点 IL-8检测结果比较脑死亡后 IL-8 检测结果开始升高,3 h、6 h、9 h 的IL-8检测结果均高于脑死亡前,且差异均有统计学意义(P均<0.05)。脑死亡后各时间点 IL-8 的检测结果差异无统计学意义(H=7.840,P=0.098),见表1,图1。
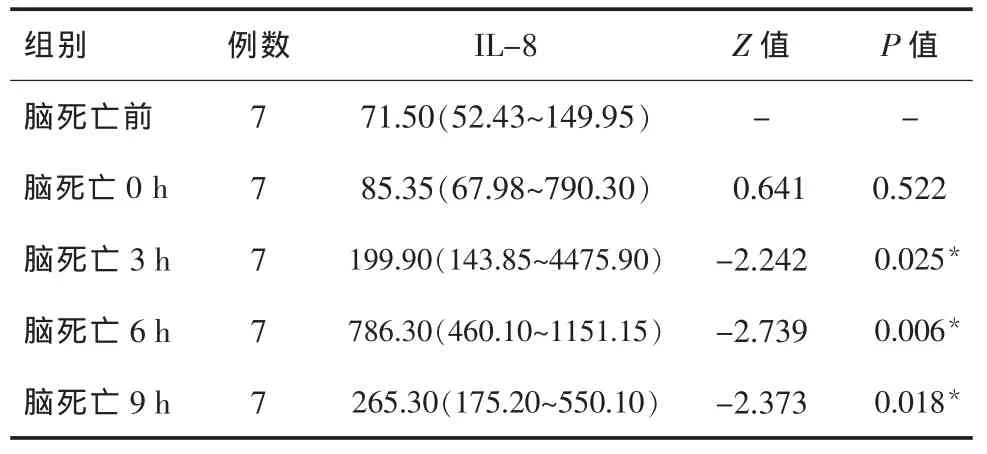
表1 脑死亡前后各时间点IL-8检测结果比较[M(P25~P75),pg/mL]
2.2 脑死亡前后各时间点尿素、Cr检测结果比较脑死亡后3 h、6 h、9 h的尿素检测结果均高于脑死亡前,差异均有统计学意义(P均<0.05)。脑死亡后6 h、9 h的Cr检测结果均高于脑死亡前,差异均有统计学意义(P均<0.05),见表2,图2、3。
2.3 脑死亡后血清IL-8水平与肾脏功能指标的相关性分析结果 脑死亡后血清IL-8与尿素检测结果呈正相关性(r=0.453,P=0.012),与Cr检测结果无相关性(r=0.209,P=0.267)。

图1 脑死亡前后各时间点IL-8检测结果

图2 脑死亡前后各时间点血清尿素检测结果

图3 脑死亡前后各时间点血清Cr检测结果
3 讨论
表2 脑死亡前后各时间点尿素、Cr检测结果比较(±s)

表2 脑死亡前后各时间点尿素、Cr检测结果比较(±s)
注:*与脑死亡前比较,P<0.05
?
脑死亡是一个复杂的病理生理过程。近年的研究[2]结果显示,脑死亡可造成血流动力学的剧烈改变、交感神经系统的改变、内分泌系统和代谢的改变,激活诸多细胞因子,引起机体内环境的紊乱、激素浓度的改变、内分泌代谢的显著变化以及炎性和免疫反应的激活,从而导致潜在脑死亡供体器官的损伤。因此,脑死亡过程可诱导多种促炎症因子的释放并能激活细胞因子间的级联反应。IL-8为1987年Yoshimura 发现的相对分子质量为(8~10)×103的多肽,是机体的重要炎性反应细胞因子之一。主要作用可诱导嗜中性粒细胞形态改变并驱化炎性反应,同时引起细胞内游离钙离子浓度升高、颗粒内含物释放、黏附蛋白上调,生物活性脂质形成和呼吸爆发,释放超氧化物和溶酶体酶,从而促进炎性反应导致细胞损伤[2,4]。
本文研究结果显示,长白小猪脑死亡0 h时血清IL-8浓度较脑死亡前有所升高,但差异无统计学意义(P>0.05)。脑死亡 3 h 时 IL-8 检测水平较脑死亡前水平明显升高,脑死亡6 h时IL-8水平达高峰,之后逐渐下降,上述研究结果提示IL-8升高为脑损伤及脑死亡发生时的应激反应,与相关报道[4]IL-8的反应强度与脑损伤程度及脑死亡进程有关相一致。但本文研究结果显示,脑死亡后各时间点IL-8的检测结果差异无统计学意义,推测与本文研究中长白小猪脑死亡模型的形成过程缓慢而平稳,并非急性脑损伤导致的脑死亡有关。而IL-8检测结果出现先升高后降低趋势,推测与随着时间推移,应激反应减弱以及IL-8半衰期较短导致其浓度达到高峰后逐渐衰减有关。因此,为保护DBD器官,应尽可能早地,至少在脑死亡后6 h即IL-8达到高峰之前采取干预措施,以有效降低脑死亡进程中IL-8所致的炎性器官损伤。肾功能指标尿素升高与IL-8同步,Cr稍有滞后,且Cr浓度在脑死亡后3 h内出现轻度下降,之后逐渐升高,可能由于抗利尿激素急剧下降、肾灌注尚可而形成的暂时性肾小球滤过相对增强所致[4]。但尿素与Cr在脑死亡3 h后均随时间推移表现出不可逆的上升趋势,与IL-8在脑死亡9 h 之后检测结果逐渐下降不同。据报道[5,6],脑死亡后光镜下可见肾小管内有均质状粉染物,肾小管上皮细胞肿胀,界限不清,管腔狭窄闭塞,部分可见炎症细胞浸润,少数肾小管细胞坏死。说明脑死亡早期,肾脏组织即可出现明显的病理生理改变。本文研究将IL-8检测水平与肾功能指标具体检测数据做相关性分析的结果显示,IL-8水平与尿素的变化呈正相关,而与Cr的变化无相关性,从而进一步证实了脑死亡早期升高的IL-8因子可造成组织器官局部嗜中性粒细胞聚集并首先攻击肾小管,引起肾小管的炎性损伤,但其对肾小球损伤相对较轻,尿素升高的原因可能是IL-8的升高激活嗜中性粒细胞对组织细胞的损伤,组织细胞坏死及凋亡后出现的蛋白质降解造成尿素来源的增高,最终导致血液尿素浓度的升高[7,8]。
综上所述,脑死亡可引起机体大量释放IL-8,并可导致组织器官的不可逆性损伤。因此,临床为保护潜在移植器官应在脑死亡确立以后及时采取有效的血液净化吸附IL-8,以尽可能降低组织器官的炎性损伤。
1 Auraen H,Mollnes TE,Bjortuft O,etal.Multiorgan procurement increases systemic inflammation in brain dead donors.Clin Transplant,2013,27:613-618.
2 Ranasinghe AM,Bonser RS.Endocrine changes in brain death and transplantation.Best Pract Res Clin Endocrinol Metab,2011,25:799-812.
3 卫生部脑死亡判定标准起草小组.脑死亡判定标准(成人)(修订稿).中国脑血管病杂志,2009,6:220-224.
4 Rech TH,Moraes RB,Crispim D,etal.Management of the braindead organ donor:a systematic review and meta-analysis.Transplantation,2013,95:966-974.
5 Floerchinger B,Oberhuber R,Tullius SG.Effects of brain death on organ quality and transplant outcome.Transplant Rev(Orlando),2012,26:54-59.
6 Oltean S,Pullerits R,Flodén A,etal.Increased resistin in brain dead organ donorsisassociated with delayed graft function after kidney transplantation.JTransl Med,2013,11:233.
7 Watts RP,Thom O,Fraser JF.Inflammatory signallingassociated with brain dead organ donation:from brain injury to brain stem death and posttransplant ischaemia reperfusion injury.J Transplant,2013,52:1369.
8 Zhao G,Shen X,Nan H,etal.Remifentanil protects liver against ischemia/reperfusion injury through activation of anti-apoptotic pathways.JSurg Res,2013,183:827-834.
