硫氯双酚通过应激活化蛋白激酶通路诱导人胶质瘤细胞凋亡
2015-11-30JIBRILKhalifdiriye楼美清
JIBRILKhalif diriye,楼美清
硫氯双酚通过应激活化蛋白激酶通路诱导人胶质瘤细胞凋亡
JIBRILKhalif diriye,楼美清
同济大学附属第十人民医院神经外科,上海 200072
目的 探讨抗寄生虫药物硫氯双酚对人胶质瘤细胞U251的作用及其机制。方法 应用CCK 8法、流式细胞仪和Western blotting观察不同浓度硫氯双酚对人胶质瘤细胞U251的存活率、细胞凋亡、应激活化蛋白激酶(c-Jun N-terninalkinase,JNK)及其磷酸化水平变化,以及JNK特异性抑制剂SP600125抑制JNK活性对硫氯双酚诱导细胞凋亡的影响。结果 与对照组相比,硫氯双酚作用U251细胞24 h后,U251细胞存活率明显降低(P<0.05),死亡率明显升高(P<0.05),且有剂量依赖性;凋亡相关Capspase3、DNA修复酶PARP(paly ADP-ribose polymerase,PARP)表达和JNK和其化水平均显著升高(P<0.05);SP600125抑制JNK活性可显著阻断硫氯双酚诱导的细胞凋亡。结论 硫氯双酚可诱导人胶质瘤细胞U251凋亡,其机制可能与激活JNK信号通路有关。
脑胶质瘤;硫氯双酚;凋亡;应激活化蛋白激酶信号通路
脑神经胶质瘤起源于神经外胚层,是目前最常见的中枢神经系统原发性肿瘤是神经外科侵袭性最强和治疗难度最大的肿瘤,具有增殖快、浸润生长、术后易复发、恶性程度高、预后较差的特点[1]。目前治疗包括手术、放疗与化疗三方面,但疗效不甚理想。即使采取广泛性外科切除联合放、化疗的综合疗法仍可再次复发;特别是高级别胶质瘤由于呈浸润性生长难以做到真正的肿瘤全切,难以治愈、复发率高,预后极差,患者生存改善有限。因此,如何提高胶质瘤的疗效是神经外科医师面临的艰巨任务,也是当今神经肿瘤学的重要研究方向。新的肿瘤敏感的药物研发虽然是老调重弹,但也尤为关键[2]。
我们团队发现,硫氯双酚(2,2′-Sulfanediylbis (4,6-dichlorophenol),一种20世纪中后期美国FDA通过的上市广谱口服抗寄生虫药物(主要是抗肺吸虫及肝吸虫),对脑胶质瘤具有较好的抑制作用。国外报道,硫氯双酚对黑色素瘤[3]、卵巢癌[4]、宫颈癌、乳腺癌有良好的临床前抑制作用,而对非肿瘤患者的体内毒性作用较小;而对自毒素(autotaxin)及NF-κB信号通路的抑制被认为是其可能的主要抗肿瘤机制。本研究探索硫氯双酚对人脑胶质瘤细胞的体外作用及其可能机制。
1 材料和方法
1.1 材料
U251细胞(中国科学院上海细胞所细胞库);硫氯双酚(Sigma公司,美国);DMEM培养基(Gibco公司,美国);CCK8(同仁化学研究所,日本);AnnexinⅤ/PI双染色流式试剂盒(BD Pharm ingine公司,美国);Caspase3、PARP、Bax、JNK、phospho-JNK抗体(Cell Signaling公司,美国);辣根酶过氧化物标记的二抗(Santa Cruz公司,美国)。SP600125 (Selleck公司,美国)。Hoechst33258购自碧云天有限公司(上海,中国)。JNK特异性抑制剂SP600125购自Selleck公司(美国)。
1.2 细胞培养
U251及U87人脑胶质瘤细胞常规培养于体积分数为10%的胎牛血清的DMEM完全培养基中,置于37℃,体积分数为5%的CO2细胞培养箱中培养,每1~2 d换液1次。待细胞铺满培养瓶底90%后,胰酶消化,1∶1稀释传代。SP600125终浓度为10μmol/L,预处理细胞3 h后加入硫氯双酚。硫氯双酚溶于DMSO中,制成20mmol/L的储液,4℃保存,使用时分别稀释成所需要的浓度。
1.3 CCK8检测细胞增殖
以5×103孔U251及U87细胞接种于96孔板中,24 h后,将U251与U81细胞分别与浓度为0、50、100、150μmol/L的硫氯双酚进行孵育,时间分别为24 h、48 h、72 h,到达作用时间后。向每孔内加入20μl CCK8达作用时间并孵育4 h,避光孵育30 m in并震荡,酶标仪检测OD550 nm值。计算出光敏剂最佳孵育时间。存活率(%)=(实验组OD490 nm-调零孔OD490 nm)/(空白对照组OD490 nm-调零孔OD490 nm)/(最佳孵)。
1.4 AnnexinV-FITC/PI法检测U251细胞凋亡
将对数生长期的U251细胞消化、离心和计数,以每皿2×105个均匀的接种于35mm2培养皿中,经0、50、100μmol/L硫氯双酚分别处理24 h后,离心并用PBS洗2次,先加入5μl Annexin V,37℃孵育30m in后加入5μl PI,轻轻混匀,避光室温反应15m in,流式细胞仪检测细胞凋亡率。
1.5 Hoechst33258检测U251细胞凋亡
应用荧光染料Hoechst33258进行细胞凋亡检测。以2×105/孔U251细胞接种于培养皿中,采用0、50、100μmol/L浓度硫氯双酚处理细胞24 h,收集细胞,PBS洗3次并加入1m l Hoechst33258染液37℃避光孵育15m in,用PBS轻柔冲洗一次,激光共聚焦显微镜下观察并照相。
1.6 Western-blot蛋白定量分析
采用0、50、100μmol/L浓度硫氯双酚处理细胞U251细胞24 h后弃去培养液,PBS洗2次,把PBS液吸取干净后加入细胞裂解液,冰上至少孵育15m in,用细胞刮匙将细胞刮下收集到1.5m l的EP管中,4℃,12 000 r/m in离心15m in,吸取上清液至一干净的EP管。用BCA(标准曲线)定量蛋白浓度后,100℃煮沸10m in,置-20℃冰箱保存备用。各组样品采取25总蛋白量上样,经SDS-PAGE电泳,湿转至PVDF膜后封闭,加一抗过夜,次日加入辣根酶过氧化物标记的二抗,室温孵育2 h,加入 ECL底物,暗室中X线胶片曝光。B-actin设为内参。
1.7 统计学分析
以上实验均独立重复3次。实验数据采用SPSS 18.0(SPSS公司,美国)统计软件包进行统计分析,数据采用(±s表示,两组间存活率、凋亡率、蛋白表达量与空白组比较均采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 硫氯双酚抑制脑胶质瘤细胞U251、U87存活
如图1CCK8结果所示,相比于对照组,50、100μmol/L硫氯双酚作用于脑胶质瘤细胞U251、U87 24~72 h均能明显杀伤细胞,对U251细胞的24 h、48 h的IC50分别为55.0μmol/L、50μmol/L,对U87细胞24 h、48 h的IC50为50.0μmol/L、62μmol/ L;且均有明显的剂量-时间依赖性(P<0.05)。
2.2 硫氯双酚诱导脑胶质瘤细胞U251凋亡
为探讨硫氯双酚影响脑胶质瘤细胞存活的机制,本实验用Annexin VFITC/PI双染法和Hoechst33258检测细胞是否发生凋亡。应用0、50、100μmol/L硫氯双酚作用12 h后,流式细胞仪检测表明,随硫氯双酚浓度增加,PI阳性率(坏死细胞)逐渐增加(P<0.05),呈浓度-时间依赖性;50μmol/L浓度作用的U251细胞总凋亡率为37.4%,而100μmol/L率为浓度则达47.9%(图2);Hoechst33258检测显示U251胶质瘤细胞呈高蓝光、核变形分裂、核固缩的典型凋亡改变(图3)。表明,50、100μmol/L亡改变硫氯双酚均可诱导U251胶质瘤细胞凋亡。

图1 CCK 8检测硫氯双酚对脑胶质瘤细胞U251及U87存活率的影响A:U251 cellsproliferation is inhibited after processing by 0~150μmol/L bithionol:bithionolsignificantly inhibit the proliferation of U251 cells,depending on the concentration-time table;B:U87 cellsproliferation is inhibited after processing by 0~150μmol/L bithionol:bithionolsignificantly inhibit the proliferation of U87 cells,depending on te concentration-time tableFig.1 Cellproliferation assay by CCK 8 in bithionol treated cell

图2 流式细胞仪检测硫氯双酚诱导U251细胞凋亡A:Flow cytometry instrument(FCM)to detectapoptosis of U251 cellswhich w ere processed by 0~100μmol/L bithionol.Bithionol induced apoptosisof U251 cells,depending on the concentration;B:Quantitative analysisof apoptosisby(FCM)detection.Fig.2 Flow cytom etry for U251 apop tosis induced by bithionol
硫氯双酚作用U251细胞24 h后,Hoechst33324染色共聚焦激光显微镜观察显示U251细胞核变小分裂、核固缩,呈浓度依赖性。
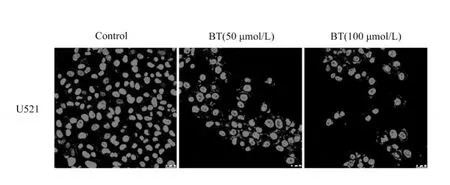
图3 Hoechst33258检测U251细胞凋亡Fig.3 Hoechst33258 assay for U251 apoptosis image
2.3 硫氯双酚对U251凋亡蛋白及信号通路蛋白的影响
经硫氯双酚作用U251细胞24 h后收集总蛋白,Western检测显示,相比于空白对照组(0.1%),50、100μmol/L比于硫氯双酚处理组凋亡蛋白Cleaved-caspase3、Cleaved-PARP、Bax表达明显增高,且呈剂量依赖性;磷酸化JNK表达量亦明显提高,P<0.05(图4)。
2.4 JNK抑制剂SP600125对硫氯双酚诱导脑胶质瘤细胞凋亡的影响
细胞增殖实验显示,单用10μmol/LJNK抑制剂SP600125处理U251细胞24 h,细胞存活率与空白DMSO对照组(0.1%)无差异;单用50μmol/L硫氯双酚组细胞存活率59.2%;SP600125+硫氯双酚组(用10μmol/LSP600125预处理6 h后再行50μmol/L硫氯双酚处理U251细胞)细胞存活率89.2%,细胞凋亡较少(图5)。
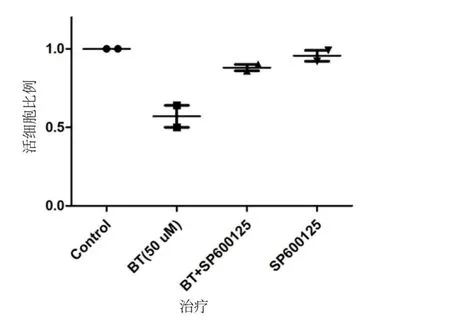
图5 JNK抑制剂对BT诱导的U251细胞凋亡的抑制作用Fig.5 JNK specific inhibitor SP600125 attenuate the apoptosiseffect induced by bithionol
3 讨论
脑胶质瘤是脑原发恶性肿瘤,其中胶质母细胞瘤患者平均生存期不超过一年[5]。虽神经外科手术技术不断发展,化疗药物层出不断,但胶质瘤患者的生存率及中位生存期等预后指标在近20年几无改善。
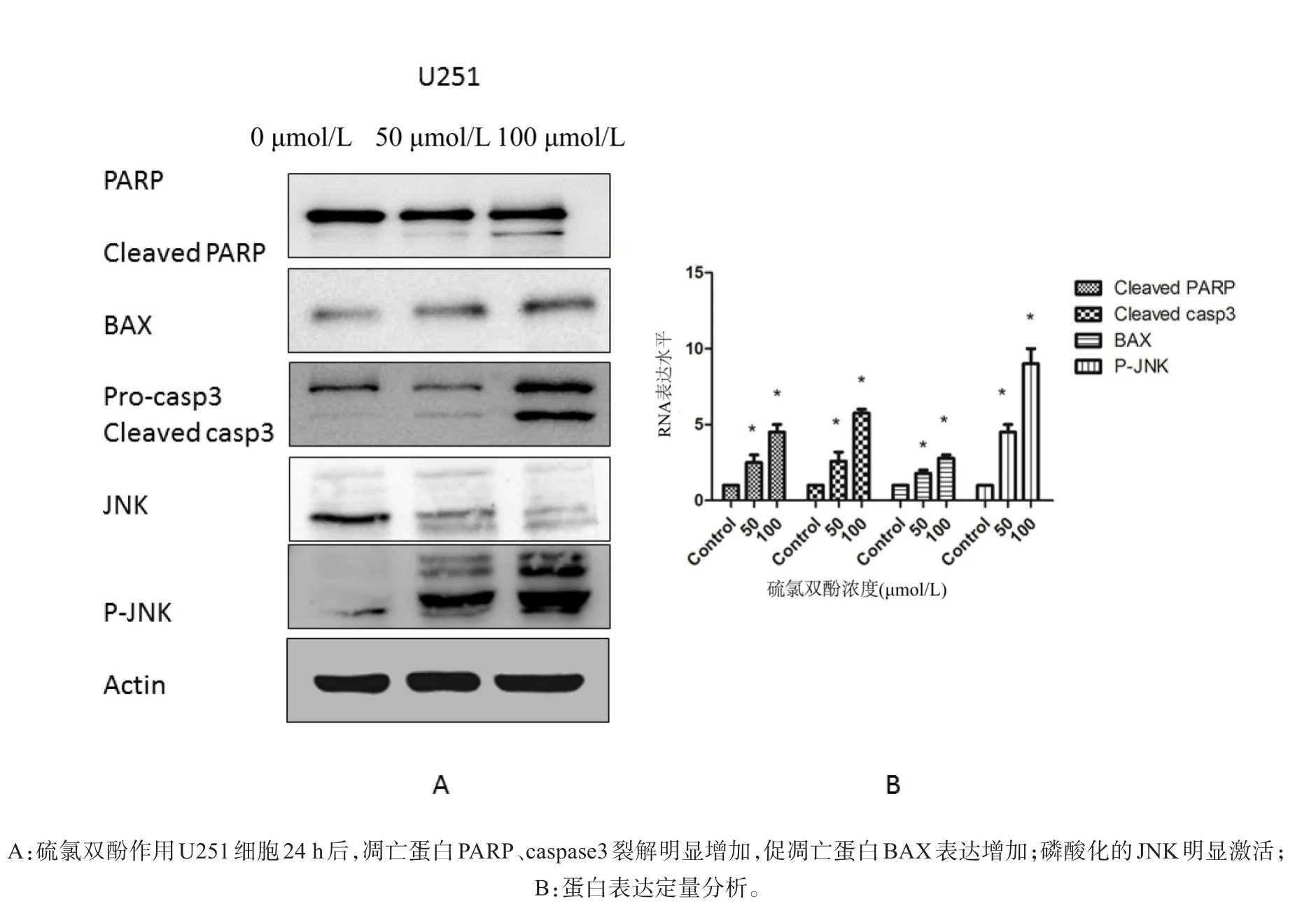
图4 Western检测硫氯双酚处理后U251凋亡蛋白及信号通路蛋白改变
细胞凋亡是细胞自我保护更新的一个重要机制。肿瘤细胞凋亡则是抗肿瘤治疗的重要方面[6],许多抗肿瘤药物即通过诱导或调节肿瘤细胞凋亡进行肿瘤杀伤。本研究提示,硫氯双酚对脑胶质瘤细胞U251及U87具有较强的浓度-时间依赖的抑制作用,硫氯双酚能显著诱导U251脑胶质瘤细胞的凋亡。目前认为,凋亡是遗传调节下的总的细胞现象;在凋亡基因中,BCL-2家族基因(包括抗凋亡基因BCL-2及促凋亡基因BAX)是调节凋亡的重要核心基因,促凋亡和抗凋亡基因的平衡调节着肿瘤细胞的生长和侵袭[7];Caspase家族基因在细胞周期和增殖中起重要调节作用,Caspase 3作为凋亡的最终执行者,其活性常受BAX及BAL-2调节;JNK信号通路在细胞周期、生殖、凋亡和细胞应激等多种生理和病理过程中起重要作用[8]。JNK表达提高可调节细胞凋亡,JNK活化常以JNK磷酸化作为标志,故P-JNK表达与细胞凋亡明确相关。本研究U251细胞经硫氯双酚处理后,BAX表达增高,BCL-2下调,Caspase3、JNK磷酸化水平提高,而总JNK水平无变化,提示抗寄生虫药物硫氯双酚可能通过上调BAX、Caspase3、PARP、P-JNK表达,下调BCL-2表达诱导脑胶质瘤细胞U251凋亡。而JNK特异性抑制剂SP600125可逆转其诱导的细胞凋亡提示,该细胞凋亡机制可能受JNK信号同路调节。因此,作为传统的抗寄生虫药物硫氯双酚,可能是潜在的抗脑胶质瘤药物。
[1] Kros JM,Huizer K,Hernandez-Lain A,et al.Evidence-Based Diagnostic A lgorithm for Glioma:Analysis of the Results of Pathology Panel Review and Molecular Parameters of EORTC 26951 and 26882 Trials[J].JClin Oncol,2015,33(17):1943-1950.
[2] Veldhuijzen van Zanten SE,Jansen MH,Sanchez A liaga E,et al.A twenty-year review of diagnosing and treating children with diffuse intrinsic pontine glioma in The Netherlands[J].ExpertRev Anticancer,2015,15(2):157-164.
[3] Doroshina MV.Effect of bithinol on the body of sheep[J].Veterinariia,1975,10(3):103-105.
[4] Saunders LP,Ouellette A,Bandle R,et al.Identification of small-molecule inhibitors of autotaxin that inhibit melanoma cellm igration and invasion[J].Mol Cancer Ther,2008,7(10):3352-3362.
[5] Ayyagari VN,Brard L.Bithionol inhibits ovarian cancer cell grow th in vitro-studies on mechanism(s)of action[J].BMC Cancer,2014,14(61):1471-2407.
[6] Braganza MZ,Rajaraman P,Park Y,et al.Cigarette smoking,alcohol intake,and risk of glioma in the NIH-AARPDiet and Health Study[J].Brit JCancer,2014,110(1):242-248.
[7] Xiao J,Liu L,Zhong Z,etal.Mangiferin regulates proliferation and apoptosis in glioma cells by induction of m icroRNA-15b and inhibition of MMP-9 expression[J].Oncol Rep,2015,33 (6):2815-2820.
[8] Correia C,Lee SH,Meng XW,et al.Emerging understanding of Bcl-2 biology:Implications for neoplastic progression and treatment[J].BBA-M ol Cell Res,2015,1853(7):1658-1671.
Bithionol inhibits p roliferation and inducesapop tosis in gliom a cellU251 in vitro
JIBRILKhalifdiriye,LOUMeiqing Department of Neurosurgery,ShanghaiTenth People's Hospital,TongjiUniversity Schoolof Medicine,Shanghai 200072,China
Objective To observe the anti-tumor activity of anti-parasite drug Bithionol and its possible mechanism in vitro.M ethods The viability of glioma cells was measured by CCK8 assay.The cell apoptosis was assayed by flow cytometry and Hoechst33258.Apoptosis-related protein expressions of Caspase 3/Cleaved caspase 3,PARP/Cleaved PARP were determ ined by Western blotting.The level of JNK-P-JNK induced by Bithionol was measured by Western blotting with or without the treatment of JNK specific inhibitor SP600125.Resu lts A fter treatment of Bithionol for 24 hours,the grow th of glioma cells U251 and U87 were significantly inhibited in dosedependentmanner(P<0.05);and U251 cell apoptosis also increased in dose-dependentmanner(P<0.05).Compared with the control group,the levels of Caspase 3/Cleaved caspase 3,PARP/Cleaved PARPwere significantly increased in Bithinol group(P<0.05).JNK was activated in the U251 cells exposed to Bithinol and phosphorylation of JNK also increased.This activation of apoptosis could be reversed by the pre-treatment of SP600125.Conclusion Bithinolmay induce apoptosis in glioma cells in vitro by the activation of JNK-P-JNK signaling pathway.
Glioma cell;Bithionol;Apoptosis;c-Jun N-terninal kinase signaling pathw ay
R739.41
A
2095-378X(2015)03-0158-05
10.3969/j.issn.2095-378X.2015.03.005
JIBRILKhalifdiriye(1986—),男,索马里人,硕士研究生
楼美清,电子信箱:loumeiqing@sina.com
