高效液相色谱法测定饮料中的呋喃-2,5-二甲酸
2015-11-29夏立新彭新凯李晰晖
汪 辉,李 莎,夏立新,2,彭新凯,2,李晰晖,周 鹏
(1.长沙市食品质量安全监督检测中心,湖南 长沙 410013;2.湖南省食品安全生产工程技术研究中心,湖南 长沙 410013)
呋喃-2,5-二甲酸(FDCA)为白色粉末状固体,是重要的有机合成中间体,可用于制备各种烷基取代或酯类呋喃衍生物[1-2],也可用于新型聚酯材料聚乙烯呋喃-2,5-二甲酸乙二醇酯(PEF)的合成[3]。在药理学方面,呋喃-2,5-二甲酸的二乙基酯具有与可卡因类似的麻醉作用,2,5-呋喃二甲酸钙盐具有抑制巨大芽孢杆菌生长的功能[1]。
近年来,基于可再生资源的呋喃芳香性聚合物材料越来越受关注[3]。PEF瓶也已大规模生产并用于食品饮料行业[4-5]。2014年10月,欧盟食品安全局发表的《关于安全评价的科学意见:呋喃-2,5-二甲酸,CAS:3238-40-2,用于食品接触材料》指出,当呋喃-2,5-二甲酸作为生产聚乙烯呋喃酸酯聚合物(PEF)的单体时,物质本身迁移到食品中的量若不超过5 mg/kg,则不会对人体构成威胁[6]。因此,建立饮料中呋喃-2,5-二甲酸的测定方法,有利于及时掌握PEF瓶中呋喃-2,5-二甲酸向饮料中的迁移情况,同时也可为食品安全监控提供有力的技术支撑。
目前,国内外测定呋喃类物质的方法有液相色谱(HPLC)法[7-8]和气相色谱-质谱(GC-MS)法[9-10],主要用于测定呋喃醛、呋喃醇和呋喃一元酸,而关于呋喃二元酸的测定较少报道。陈天明[11]建立了红外光谱法测定呋喃二元酸的分析方法,但仅适用于高含量呋喃-2,5-二甲酸,而不适用于食品中微量和痕量呋喃-2,5-二甲酸的分析[12]。本方法结合呋喃-2,5-二甲酸的化学性质,采用高效液相色谱法测定其在饮料中的含量[13-14],利用保留时间,结合紫外光谱定性,外标法定量,结果令人满意。
1 实验部分
1.1 仪器与材料
1260型高效液相色谱仪,配在线脱气机、四元泵、柱温箱、自动进样器和二极管阵列检测器(美国Agilent公司);SK-1型快速混匀器(江苏金坛医疗仪器厂);A10型超纯水处理器(美国Millipore公司)。
乙腈(色谱纯,德国Merck公司);冰乙酸(色谱纯,纯度≥99.5%,天津市化学试剂研究所);乙酸铵(分析纯,国药集团化学试剂有限公司);实验用水为超纯水。
1.2 标准溶液的配制
准确称取10 mg呋喃-2,5-二甲酸于100 mL容量瓶中,加水溶解并定容至刻度,配成100 mg/L的标准储备液,于4℃冷藏保存。使用时,用水逐级稀释成标准中间液,现配现用。
1.3 HPLC仪器条件
色谱柱为Venusil HILIC(4.6 mm×250 mm,5 μm);柱温为40℃;流速为1.0 mL/min;流动相为0.02 mol/L乙酸铵(冰乙酸调至pH 3.5)-乙腈(50∶50),等度洗脱;波长扫描范围为190~400 nm,检测波长为265 nm;进样量为10 μL。
1.4 样品前处理
准确称取样品9 g(精确至0.1 mg),加水定容至10 mL,混匀后过0.45 μm微孔滤膜,滤液待测试用。
2 结果与讨论
2.1 波长的选择
配制5.0 mg/L呋喃-2,5-二甲酸溶液,不接色谱柱直接进样分析,采用二极管阵列检测器检测,波长扫描范围为190~400 nm。结果发现,呋喃-2,5-二甲酸在265 nm处有最大吸收,故本实验选择检测波长为265 nm。
2.2 色谱柱的选择
利用Ultimate AQ-C18色谱柱(4.6 mm×250 mm,5 μm)对呋喃-2,5-二甲酸进行检测,采用纯水作为流动相,但由于目标化合物的极性较大,其保留值较小。进一步考察了采用极性改性固定相的InspireTMHILIC(4.6 mm×250 mm,5 μm)色谱柱和采用中性的酰胺键合基团的Venusil HILIC(4.6 mm×250 mm,5 μm)色谱柱对呋喃-2,5-二甲酸的测定情况,结果发现,前者较后者的保留能力弱,且目标化合物在不同pH值流动相(0.02 mol/L乙酸铵-乙腈)下均出现双峰。故本实验选择Venusil HILIC(4.6 mm×250 mm,5 μm)为最佳色谱柱。
2.3 流动相的选择
考察了不同比例的0.02 mol/L乙酸铵(pH 6.8)-乙腈(60∶40,50∶50,40∶60,30∶70,20∶80)作为流动相时的测定情况。结果发现,当0.02 mol/L乙酸铵(pH 6.8)-乙腈比例为20∶80时,目标化合物出现双峰;比例为30∶70时,色谱峰前延;比例为60∶40,50∶50和40∶60时峰形对称,但随着乙腈比例的升高,目标化合物的保留值增大,且响应值降低,考虑到长时间高比例水相会影响色谱柱的寿命,因此最终选择比例为50∶50的流动相。另外,考察了0.02 mol/L乙酸铵-乙腈(50∶50)流动相在不同pH值(pH 6.8,5.0,3.5)条件下对目标化合物的测定情况(见图1),结果发现,目标化合物的保留值随着pH值的降低而升高;当采用0.02 mol/L乙酸铵(pH 3.5)-乙腈(50∶50)作为流动相时,目标化合物的峰形对称,保留值合适,分离度较高,因此实验选其作为流动相。
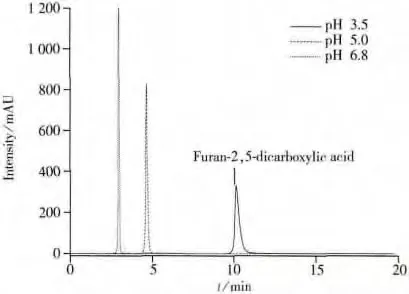
图1 呋喃-2,5-二甲酸在不同pH值流动相下的色谱图Fig.1 Chromatograms of furan-2,5-dicarboxylic acid in mobile phase system with different pH values
2.4 线性关系、灵敏度与仪器精密度
配制8个不同浓度的标准溶液,按本方法进行测定,以呋喃-2,5-二甲酸的质量浓度(X,mg/L)为横坐标,对应峰面积(Y)为纵坐标,绘制标准曲线。结果表明,呋喃-2,5-二甲酸在0.5~100 mg/L范围内线性关系良好,回归方程为Y=66.86X-5.780,相关系数(r2)为0.999 9。采用空白混合样品溶液稀释低浓度标准溶液,以信噪比S/N≥3确定方法的检出限(LOD)为0.15 mg/kg,以S/N≥10确定方法的定量下限(LOQ)为0.5 mg/kg。
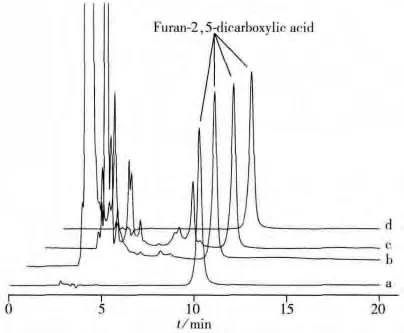
图2 标准溶液与加标样品溶液的色谱图(5 mg/L)Fig.2 Chromatograms of standard solution and spiked sample solution(5 mg/L)
配制相同浓度的矿物质水、可乐和鲜橙多加标溶液,按照本方法分别重复进样6次进行测定,计算呋喃-2,5-二甲酸保留值的相对标准偏差(RSD)分别为0.61%,0.66%和0.18%,峰面积的RSD分别为0.57%,0.62%和0.98%,均符合定性(<1.0%)与定量(<3.0%)的重复性要求[15],表明仪器具有良好的精密度。
2.5 回收率与精密度
采用空白样品加标法测定样品中呋喃-2,5-二甲酸的回收率。在矿物质水、可乐饮料和鲜橙多饮料空白样品中分别添加LOQ,2LOQ和10LOQ浓度的目标化合物,每个加标水平进行6次平行实验(见图2)。空白样品中呋喃-2,5-二甲酸的回收率为93.2%~109.0%,RSD为0.9%~4.2%,结果见表1,符合实验室质量控制要求[16]。

表1 空白样品中呋喃-2,5-二甲酸的加标回收率与相对标准偏差(n=6)Table 1 Recoveries and RSDs of furan-2,5-dicarboxylic acid spiked in blank samples(n=6)
2.6 稳定性考察
取相同浓度的标准溶液以及矿物质水、橙汁与可乐的加标溶液,分别在0,2,4,8,12,24 h采用本方法进行测定,记录保留值和峰面积,计算得上述溶液的保留值RSD不超过0.6%,峰面积的RSD不超过1.0%,说明呋喃-2,5-二甲酸在24 h内稳定性良好。
2.7 干扰实验
饮料中一般含有机酸和食品添加剂,为考察这些化合物对呋喃-2,5-二甲酸测定的干扰情况,分别将有机酸(柠檬酸、苹果酸和酒石酸)、防腐剂(山梨酸、苯甲酸和脱氢乙酸)、甜味剂(乙酰胺磺酸钾和糖精钠)和人工合成着色剂(亮蓝、柠檬黄、日落黄、苋菜红、胭脂红、赤藓红和诱惑红)标准溶液加入到呋喃-2,5-二甲酸的标准溶液和加标混合样品溶液中,使其质量浓度均为5 mg/L,采用本方法对上述溶液进行测定。结果表明:在优化条件下,部分化合物在265 nm处无响应,部分化合物虽有响应,但与目标化合物的保留时间不一致,可与目标化合物达到基线分离(见图3)。因此上述化合物对本方法测定呋喃-2,5-二甲酸几乎无干扰[17]。
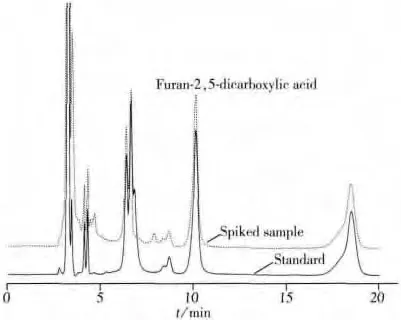
图3 干扰实验中呋喃-2,5-二甲酸的色谱图Fig.3 Chromatograms of furan-2,5-dicarboxylic acid in interference tests
2.8 实际样品的测定
在优化条件下,采用本方法测定了12份市售饮料(饮用水、果汁饮料和碳酸饮料)中呋喃-2,5-二甲酸的含量,采用保留时间和紫外光谱定性,辅以样品加标定性,外标法定量。结果均未检出呋喃-2,5-二甲酸(<0.15 mg/kg)。
3 结论
本文建立了测定饮料中呋喃-2,5-二甲酸含量的高效液相色谱分析方法,采用亲水色谱柱Venusil HILIC(4.6 mm×250 mm,5 μm)对目标化合物进行分析,二极管阵列检测器测定。该方法操作简便,线性范围宽,回收率高,完全能够满足饮料中呋喃-2,5-二甲酸的测定要求。
[1]Liu L,Yang S L,Li H B,Chen K,Wu Y,Ma C P,Zhang Y G,Yang J Q.Fine Chem.(刘浪,杨顺利,李鸿波,陈凯,吴毅,马昌鹏,张永岗,杨俊卿.精细化工),2011,28(4):410-412.
[2]Chen T M,Lin L.Chem.Reagent(陈天明,林鹿.化学试剂),2011,33(1):11-12.
[3]Liu Q.Study on the Preparation of PEF and Its Structure and Properties.Changchun:Changchun University of Technology(刘茜.PEF的制备及其结构和性能的研究.长春:长春工业大学),2012.
[4]Jiang Z H.China Synthetic Fiber Industry(江镇海.合成纤维工业),2014,37(1):37.
[5]Xue M.Modern Plastics Processing and Applications(薛敏.现代塑料加工应用),2012,24(1):30.
[6]European Food Safety Authority.J.EFSA,2014,12(10):3866.
[7]Xu Y F.Shanghai Measurement and Testing(徐燕锋.上海计量测试),2012,1:18-21.
[9]Goldmann T,Périsset A,Scanlan F,Stadler R H.Analyst,2005,130:878 -883.
[10]Zhao S S,Fan W L,Xu Y,Zhang G Q,Xu Q X,Li Z Q.China Brewing(赵书圣,范文来,徐岩,张国强,徐钦祥,李志强.中国酿造),2008,21:10-13.
[11]Chen T M.Study on the Conversion of Glucose to 5-Hydroxymethylfurfural and Furan-2,5-dicarboxylic Acid.Guangzhou:South China University of Technology(陈天明.葡萄糖转化为5-羟甲基糠醛和2,5-呋喃二甲酸的研究.广州:华南理工大学),2011.
[12]Wuhan University.Analytical Chemistry.Fifth Ed.,Vol.1.Beijing:Higher Education Press(武汉大学.分析化学,第五版,上册.北京:高等教育出版社),2006.
[13]Sun H W,Li H,Gao W H,Zhou X T.Food Sci.(孙汉文,李挥,高文惠,周晓婷.食品科学),2012,33(2):235-239.
[14]Yang B F,Tang Z X,Gao X,Niu Z Y,Luo X,Wang F M,Jian H M.J.Instrum.Anal.(杨博锋,汤志旭,高昕,牛增元,罗忻,王凤美,简慧敏.分析测试学报),2012,31(10):1272-1276.
[15]JJG 705-2014.Liquid Chromatographs.Verification Regulation of the Peoples Republic of China(液相色谱仪.中华人民共和国计量检定规程).
[16]GB/T27404 -2008.Criterion on Quality Control of Laboratories- Chemical Testing of Food.Standards of the Peoples Republic of China(实验室质量控制规范食品理化检测.中华人民共和国国家标准).
[17]Xiao L D,Tang A G,Mo X M,Luo X B,Pi L G.Chin.J.Chromatogr.(肖乐东,唐爱国,莫喜明,罗昔波,皮兰敢.色谱),2009,27(2):220-223.
