不同形式蛋氨酸对建鲤生长性能及血清游离氨基酸含量的影响
2015-11-29单玲玲李小勤郑小淼赵鑫鑫冷向军
单玲玲 李小勤, 3, 4 郑小淼 赵鑫鑫 冷向军, 3, 4
不同形式蛋氨酸对建鲤生长性能及血清游离氨基酸含量的影响
单玲玲1, 2李小勤1, 2, 3, 4郑小淼1赵鑫鑫1冷向军1, 2, 3, 4
(1. 上海海洋大学水产与生命学院, 上海 201306; 2. 上海海洋大学农业部淡水水产种质资源重点实验室, 上海 201306; 3. 上海市水产养殖工程技术研究中心, 上海 201306; 4. 上海高校知识服务平台, 上海海洋大学水产动物遗传育种中心ZF1206, 上海 201306)
为考察不同形式蛋氨酸对建鲤生长的作用效果, 实验以豆粕、鱼粉、棉粕为蛋白源, 配制缺乏蛋氨酸的基础饲料(对照组, 蛋氨酸含量为0.48%), 在基础饲料中分别添加晶体蛋氨酸、微囊蛋氨酸、蛋氨酸羟基类似物(MHA)及蛋氨酸羟基类似物钙盐(MHA-Ca), 使蛋氨酸含量达到0.58%, 获得5个饲料处理组, 饲养平均体重为(8.6±1.0) g的建鲤(Jian)8周。结果显示: 各组鱼体增重率分别为343.51%、350.77%、382.80%、384.02%和385.59%; 饲料系数分别为1.58、1.55、1.42、1.42和1.41; 晶体蛋氨酸组鱼体增重率、饲料系数与对照组无显著差异(<0.05), 微囊蛋氨酸组、MHA组、MHA-Ca组增重率较对照组提高11.4%、11.8%、12.2% (<0.05), 饲料系数降低10.1%、10.1%、10.8% (<0.05)。各处理组在肌肉水分、脂肪含量间无显著差异(>0.05), MHA组肌肉粗蛋白含量较晶体蛋氨酸组显著下降, 其他各组间无显著差异(>0.05)。对摄食后不同时间的血清游离氨基酸浓度变化的分析表明, 对照组在摄食后2h或3h达到峰值, 晶体蛋氨酸组、MHA组在摄食后1h达到吸收峰值, 微囊蛋氨酸组在摄食后1h或2h达到峰值, 而MHA-Ca组则在摄食后3h达到峰值。上述结果表明, 在蛋氨酸缺乏的颗粒饲料中补充晶体蛋氨酸, 对建鲤生长性能无改善作用, 而添加微囊蛋氨酸、蛋氨酸羟基类似物、蛋氨酸羟基类似物钙盐则显著提高了鱼体生长性能, 降低饲料系数。
建鲤; 晶体蛋氨酸; 微囊蛋氨酸; 蛋氨酸羟基类似物; 生长; 血清游离氨基酸
由于鱼粉资源的紧缺和价格的不断上涨, 越来越多的植物蛋白源被应用于水产饲料, 其中豆粕是应用最为广泛的植物蛋白源之一。在豆粕中蛋氨酸较为缺乏, 而蛋氨酸是必需氨基酸, 对鱼体正常生长及新陈代谢有重要作用[1], 饲料中蛋氨酸的缺乏会对动物生长造成不利影响[2]。因此, 补充外源性蛋氨酸成为提高豆粕营养价值的重要措施。目前, 研究应用过的蛋氨酸有晶体DL-蛋氨酸、微囊DL-蛋氨酸、蛋氨酸羟基类似物(MHA)、蛋氨酸羟基类似物钙盐(MHA-Ca)等[3]。
在饲料中添加晶体DL-蛋氨酸, 对虹鳟()[4]、真鲷()[5]、五条()[6]、尖吻鲈()[7]、罗非鱼()[8]等生长具有改善作用; 但在草鱼()[9]、胭脂鱼()[10]、鲤()[11]、异育银鲫()[12]、斑节对虾()[13]的研究中, 饲料中补充晶体氨基酸对生长性能并无显著改善。水产动物对晶体氨基酸利用效果不佳的原因, 通常认为与晶体氨基酸和饲料中蛋白态氨基酸吸收不同步有关[14]。为改善水产动物对晶体氨基酸利用, 通常的做法是对晶体氨基酸进行缓释处理, 如包膜、微胶囊化等, 目前, 氨基酸缓释处理后改善了利用性的报道, 已见于鲤[11]、异育银鲫[12]、草鱼[9]、斑节对虾[13], 在罗非鱼饲料中添加微囊蛋氨酸较添加晶体蛋氨酸具有更好的改善生长的效果[8]。
蛋氨酸羟基类似物(MHA), 是蛋氨酸的氨基被羟基替代所形成的具有蛋氨酸活性的物质, 呈液态; 由于液体在运输、储存和使用中存在诸多不便, 因此, 在MHA基础上, 又进一步发展了其固体的钙盐形式, 蛋氨酸羟基类似物钙盐(MHA-Ca)。MHA有L型、D型两种异构体, MHA进入机体后需转化成L-蛋氨酸才能被机体利用。在小鼠[15]和肉鸡[16]的研究中, MHA在通过肠道黏膜上皮细胞扩散时就开始发生转化: 在过氧化物酶体系下发生氧化生成酮型蛋氨酸(KMB), KMB经转氨基作用生成L-蛋氨酸, 所有的氨基酸都可提供氨基[17]。催化L-MHA、D-MHA氧化的酶分别是L-2-羟基酸氧化酶(L-HAOX)、D-2-羟基酸脱氢酶(D-HADH); L-HAOX主要存在于肝脏和肾脏[18, 19], D-HADH存在于全身的线粒体细胞中[16]。
蛋氨酸羟基类似物在动物养殖上的作用效果并不一致。在仔猪饲料中添加DL-蛋氨酸、MHA-Ca均改善了生长性能, 提高了氮保留率[20]; MHA-Ca可提高肉鸡对植物性饲料的利用率, 并达到了与D-蛋氨酸同样的作用效果[21]; 而且MHA较DL-蛋氨酸能更好地促进肉鸡肌肉生长, 改善肌肉品质及质构特性[22]。在鱼类的研究中, 在植物性饲料中添加L-蛋氨酸、DL-蛋氨酸及蛋氨酸羟基类似物, 均能显著提高红鼓鱼()增重率、饲料转化效率和蛋白质转化效率[23]; 在豆粕型饲料中添加0.135%蛋氨酸羟基类似物钙盐, 可显著提高建鲤()增重率和饲料利用效率[24]; 杂交条纹鲈()[25, 26]也能有效利用蛋氨酸羟基类似物。然而, Robinson等[27]发现斑点叉尾() 对蛋氨酸羟基类似物利用率只有L-蛋氨酸的26%(以增重率为指标); 杂交狼鲈()[28, 29]、虹鳟()[30]等对蛋氨酸羟基类似物的利用效果均不如DL-蛋氨酸, 在肉鸡上也有类似报道[31]。
建鲤是以荷包红鲤和沅江鲤为亲本选育的良种, 具有生长速度快、抗病能力强、含肉多等特点, 是我国淡水养殖的重要品种之一。目前, 建鲤对蛋氨酸的需求量并没有标准, 多是参考普通鲤的需求量。有研究表明, 在饲料蛋白质水平为35%条件下, 蛋氨酸水平为1.16%时, (12—20) g幼建鲤生长最佳[32]。本实验以豆粕为主要蛋白源, 配制了蛋氨酸缺乏的基础饲料, 在此基础上添加晶体蛋氨酸、微囊蛋氨酸、蛋氨酸羟基类似物、蛋氨酸羟基类似物钙盐, 形成4组实验饲料, 饲喂建鲤, 以比较不同形式蛋氨酸对建鲤的作用效果, 并检测各组建鲤摄食后血清中游离氨基酸的变化情况, 为不同形式蛋氨酸在水产饲料中的合理应用提供依据。
1 材料与方法
1.1 实验饲料
以豆粕、棉粕、鱼粉为蛋白源, 配制蛋氨酸缺乏的基础饲料(蛋氨酸0.48%)。根据NRC标准(2012)[33], 鲤对赖氨酸的需求量为2.2%, 蛋氨酸0.7%, 依据赖氨酸与蛋氨酸的比值为0.318, 在基础饲料(对照组)中分别添加晶体蛋氨酸、微囊蛋氨酸、MHA及MHA-Ca, 使蛋氨酸含量达到0.58%。基础饲料配方见表1。上述5组饲料原料全部粉碎过40目筛, 充分混匀, 加水搅拌均匀, 以平模制粒机制成粒径为2 mm的颗粒饲料[制粒温度为(70±5)℃], 共5种饲料, 即对照组(C)、晶体蛋氨酸组(CM)、微囊蛋氨酸组(EM)、MHA组及MHA-Ca组。所用晶体蛋氨酸为DL-Met, 有效含量98%; 微囊蛋氨酸有效含量49%; MHA有效含量88%; MHA-Ca有效含量86%。
1.2 实验鱼及饲养管理
实验用建鲤购回后, 暂养于循环水养殖桶中, 饲喂商业配合饲料(粗蛋白含量33%, 粗脂肪含量5%)。暂养期结束, 挑选体格健壮、体重8.6 g左右的450尾建鲤, 随机分配于15个自动充气循环的玻璃水族缸(0.6 m×0.55 m×0.5 m), 共5个处理组, 每处理组3个平行(缸), 每缸25尾鱼。每天于8:00、12:00和17:00投喂, 实验初期投饲量为鱼体重的3%—5%, 并根据天气和摄食情况作适当调整, 以投饲后5min内食完为宜, 各箱投饲量保持一致。养殖期间, 水温为(23—27)℃, pH 7.0—8.0, 溶氧>7 mg/L, 氨氮≤0.1 mg/L。
1.3 样品采集
在养殖过程中, 每两周以缸为单位称量鱼体重并计数(称量前饥饿24h), 计算增重率、成活率。养殖8周实验结束后, 禁食24h, 每缸取4尾鱼, 解剖取内脏、肝脏并称重, 取肌肉保存于–80℃用于肌肉常规营养成分测定。
在养殖实验结束后, 实验鱼正常饲喂3d, 禁食24h, 饱食投喂, 分别在饲喂前(0h)及饲喂后1h、2h、3h、4h、5h, 每缸取3尾鱼, 于尾静脉处采血, 3000 r/min离心10min、取血清, –80℃冻存以测定游离氨基酸水平。
1.4 测量指标及方法
生长性能增重率=(末重–初重)/初重×100%
饲料系数=饲料摄入量/(末重–初重)×100%
蛋白质效率()=体重增加量/(饲料摄取量×饲料蛋白质含量)×100%
肝体比=肝胰腺重/体重×100%
脏体比=内脏重/体重×100%
肌肉营养成分肌肉成分分析按照AOAC (1995)[34]标准方法。将肌肉解冻制成肉糜进行常规分析, 水分含量、粗蛋白含量及粗脂肪含量的测定分别采用105℃烘干法、凯氏定氮法、索氏抽提法。
血清游离必需氨基酸的测定 在血清4℃解冻后, 取400 µL于离心管, 加入100 µL 10%的磺基水杨酸, 8000 r/min离心10min, 取上清, 重复以上步骤2次以去除血清中的蛋白质。所得上清液按体积比1︰1加入乙酸乙酯(HPLC), 混匀, 离心, 取下层液, 重复三次, 去除血清中脂类。将处理好的血清样品按体积比1︰2加入锂盐稀释液, 以0.22 µm的滤膜过滤, 用Sykam S-433D全自动氨基酸分析仪(德国)测定血清中游离氨基酸含量。

表1 实验饲料组成营养成分含量
注: 1. 矿物质预混料配方(mg or g/kg 饲料): I, 0.4 mg; Co, 0.1 mg; Cu, 4 mg; Fe, 150 mg; Zn, 80 mg; Mn, 20 mg; Se, 0.1 mg; Mg, 100 mg; 沸石粉, 3.539 g; 2. 维生素预混料配方(mg or IU/kg 饲料): VA, 6000IU; VB1, 15 mg; VB2, 15 mg; VB3, 30 mg; VB5, 35 mg; VB6, 6 mg; VB12, 0.03 mg; VC, 200 mg; VD3, 2000IU; VE, 50 mg; VK3, 5 mg; 肌醇, 200 mg; 叶酸, 3 mg; 生物素, 0.2 mg
Note: 1. Ingredient of mineral permix (mg or g/kg diet): I, 0.4 mg; Co, 0.1 mg; Cu, 4 mg; Fe, 150 mg; Zn, 80 mg; Mn, 20 mg; Se, 0.1 mg; Mg, 100 mg; zeolite power, 3.539 g; 2. Ingredient of vitamin permix (mg or g/kg diet): VA, 6000IU; VB1, 15 mg; VB2, 15 mg; VB3, 30 mg; VB5, 35 mg; VB6, 6 mg; VB12, 0.03 mg; VC, 200 mg; VD3, 2000IU; VE, 50 mg; VK3, 5 mg; inositol, 200 mg; folic acid, 3 mg; biotin, 0.2 mg
1.5 数据分析
数据采用SPSS 17.0软件进行单因素方差分析和Duncan’s 多重检验及独立样本检验, 用平均数± 标准差表示,<0.05表示差异显著。
2 结果
2.1 生长性能
养殖期间各阶段(2、4、6、8周)的建鲤体重见图1。在第2周, MHA-Ca组的鱼体重显著高于晶体蛋氨酸组(<0.05), 其他各组间无显著差异(>0.05); 在第4、第6周, 微囊蛋氨酸组、MHA组、MHA-Ca组体重较对照组、晶体蛋氨酸组有增加趋势(<0.10);在第8周, 微囊蛋氨酸组、MHA组、MHA-Ca组建鲤体重均显著高于对照组和晶体蛋氨酸组(<0.05)。
在养殖8周后, 各组建鲤成活率均为100% (表3)。在颗粒饲料中补充晶体蛋氨酸对鱼体生长性能无改善(>0.05), 补充微囊蛋氨酸、MHA、MHA-Ca分别提高增重率11.4%、11.8%、12.2%(<0.05), 降低饲料系数10.1%、10.1%、10.8%(<0.05); 微囊蛋氨酸组、MHA组、MHA-Ca组蛋白质效率较对照组、晶体蛋氨酸组也显著提高(>0.05)。
各组建鲤在脏体比、肝体比方面没有表现显著差异(>0.05), 但各蛋氨酸添加组的肝体比较对照组呈现出降低的趋势(<0.10)。
同一阶段的柱形图上, 具不同字母者, 表示差异显著(<0.05)
Values in the column at the same time with different letters are significantly difference (<0.05)
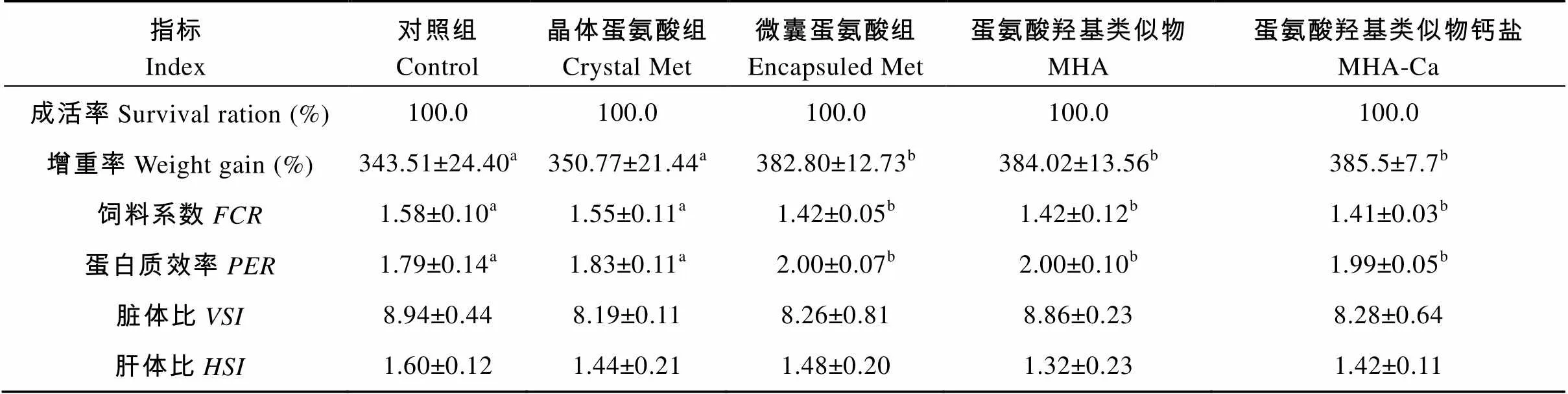
表2 不同形式蛋氨酸对建鲤生长性能的影响
注: 同行上标小写字母不同表示两者之间有显著差异 (<0.05); 下同
Note: Values in the same row with different letters are significantly difference (<0.05); the same applies bellow
2.2 肌肉成分
从表3可见, MHA组肌肉蛋白质含量显著低于晶体蛋氨酸组(<0.05), 其他各组没有显著差异(>0.05); 水分、粗脂肪含量在各组间无显著差异(>0.05)。
2.3 摄食后不同时间段血清游离氨基酸变化
从图2可见, 对照组在摄食后2h或3h达到峰值, 晶体蛋氨酸组、MHA组在摄食后1h达到吸收峰值, 微囊蛋氨酸组在摄食后1h或2h达到峰值, 而MHA-Ca组则在摄食后3h达到峰值。这说明, 与对照组相比, 晶体蛋氨酸组、MHA组的氨基酸吸收峰出现时间提前; 与晶体蛋氨酸组相比, 微囊蛋氨酸组、MHA-Ca组的氨基酸吸收峰出现时间有了一定的延滞。
表3 不同形式蛋氨酸对建鲤肌肉成分的影响(湿重)

Tab.3 Influence of five diets with adding crystal methionine, encapsuled methionine, MHA and MHA-Ca on the nutrition composition of Jian carp (%)
3 讨论
一些水产动物不能有效利用外源添加的晶体氨基酸, 这与晶体氨基酸与饲料结合态氨基酸不能同步吸收有关[9, 14, 35]。在晶体蛋氨酸被摄食后, 在肠道被机体快速吸收, 而饲料中其他结合态氨基酸(完整蛋白质)要经水解作用, 分解成小肽或游离氨基酸再被吸收, 两种形态的氨基酸被肠道吸收的不同步性, 造成了较早被吸收的晶体蛋氨酸不能及时参与蛋白质合成, 而被氧化分解或排出体外[36, 37]。蛋氨酸经包被、微囊处理, 起到了缓释作用, 从而缩短了与结合态氨基酸的吸收时间差, 使之可以得到有效利用, 从而促进鱼体生长。在本实验中, 建鲤摄食含晶体蛋氨酸饲料后, 其氨基酸峰值出现时间较对照组提前, 而微囊蛋氨酸组峰值则较晶体氨基酸组延迟, 这说明蛋氨酸经微囊处理后延长了在肠道的滞留时间, 提高了蛋氨酸利用率, 从而促进了建鲤生长。这与本实验室之前在鲤[11]、异育银鲫[12]上的实验结果一致。
蛋氨酸羟基类似物作为蛋氨酸添加剂, 其生物效价一直存在争议。杂交条纹鲈摄食含L-蛋氨酸、MHA-Ca或MHA与锌混合物的饲料后, 其生长性能显著改善且各组间无显著差异[25]; 在蛋氨酸缺乏的饲料中添加DL-蛋氨酸、MHA均提高了红鼓鱼增重率、饲料转化率和蛋白质效率[23]; 类似的报道也见于建鲤[24]、虹鳟[30]等鱼类; MHA的添加, 还提高了建鲤免疫力[38]。在本实验中, 添加MHA或MHA-Ca, 提高了鱼体增重率11.8%、12.23%, 与上述研究结果相一致。这表明, 对于建鲤, 蛋氨酸羟基类似物是一种有效的蛋氨酸添加剂。然而在虹鳟的研究中, 用豆粕部分替代鱼粉, 并补充MHA, 并未改善其生长效果[39]; 斑点叉尾对蛋氨酸羟基类似物的利用效果仅为L-蛋氨酸的26%[27]; 鲈对蛋氨酸羟基类似物钙盐的利用效果相当于L-蛋氨酸的75%[28]。由上可见, 鱼类对蛋氨酸羟基类似物的利用可能存在种属间差异, 这尚有待于进一步研究。
MHA进入机体后需转化成L-蛋氨酸才能被机体利用。在小鼠[15]和肉鸡[16]中, 这个转化过程在MHA通过肠道黏膜上皮细胞扩散时就开始发生, 在鱼类是否也存在类似机制, 目前尚未见报道。在本次实验中, 建鲤摄食含MHA饲料后, 血清游离必需氨基酸峰值出现在摄食后1h, 与晶体蛋氨酸组相类似, 这说明MHA能被机体迅速吸收并转化为蛋氨酸, 根据前述理论, 这样可能存在与结合态氨基酸吸收不同步的问题, 但MHA却为建鲤所有效利用, 并改善了生长性能, 其原因有可能是MHA进入机体后, 转化为蛋氨酸的过程需要一定的时间, 尽管这个时间并不长, 但也在一定程度上缓解了吸收不同步问题。在本次实验中, 摄食后的采血时间间隔为1h, 可能仍然偏长, 不足以反映出MHA组和晶体氨基酸在血液氨基酸峰值上的时间差异, 这有待于今后更为细致的研究。
在本实验中, MHA-Ca组在摄食后3h出现血液游离氨基酸峰值, 较MHA组和晶体蛋氨酸组延缓。对于呈酸性的MHA-Ca, 在建鲤碱性的肠道环境中其结构会被破坏, 分离出钙离子, 再进入肠上皮细胞进行L-蛋氨酸的转化。在肠道中解离钙离子的过程使得MHA进入细胞的时间延迟, 这可能是MHA-Ca组的血清氨基酸吸收峰较MHA组延缓的原因。
另外, 本次研究虽然在饲料中只补充了蛋氨酸, 但在摄食后不同时间段的血清氨基酸中, 并非只有蛋氨酸水平出现了变化, 其他氨基酸的吸收峰值也表现出一定程度的延迟或提前, 也就是说不同形式蛋氨酸的添加影响了其他氨基酸的吸收时间。是否蛋氨酸(或蛋氨酸羟基类似物)或其分子结构中的某一个基团作为一种信号因子, 影响了其他氨基酸吸收, 尚有待于今后进一步研究。
[1] Luo Z, Liu Y, Mai K,. Dietary L-methionine requirement of juvenile grouper Epinephelus coioides at a constant dietary cystine level [J]., 2005, 249: 409—418
[2] Goff J B, Gatlin D M. Evaluation of different sulfur amino acid compounds in the diet of red drum,, and sparing value of cystine for methionine [J]., 2004, 241: 465—477
[3] Jendza J A, Geraert P A, Ragland D,. The site of intestinal disappearance of dl-methionine and methionine hydroxy analog differs in pigs [J]., 2011, 89(5): 1385—1391
[4] Cheng Z J, Ronaild W H, James L U. Effect of lysine supplementation in plant protein-based diets on the performance of rainbow trout and apparent digestibity coefficients of nutritions [J]., 2003, 215: 255—265
[5] Takagi S, Shimeno S, Hosokawa H,. Effect of lysine and methionine supplementation to a soy protein concentrate diet for red sea breammajor [J]., 2001, 67(6): 1088—1096
[6] Watanabe T, Aoki H, Watanabe K,. Quality evaluation of different types of non-fish meal diets for yellowtail [J]., 2001, 67: 461—469
[7] Williams K, Barlow C, Rodgers L. Efficacy of crystalline and protein‐bound amino acids for amino acid enrichment of diets for barramundi/Asian seabass (Bloch) [J]., 2001, 32(s1): 415—429
[8] Leng X J, Tian J, Chen B A,. Effects of crystalline or coated methionine on Tilapia (×) [J]., 2013, 37(2): 235—242 [冷向军, 田娟, 陈丙爱, 等. 罗非鱼对晶体蛋氨酸、包膜蛋氨酸利用的比较研究. 水生生物学报, 2013, 37(2): 235—242]
[9] Liu Y J, Tian L X, Liu D H,. Influence of practical diet supplementation with free or coated lysine on the growth, plasma free amino acids and protein synthesis rates in the muscle of[J], 2002, 26(3): 252—258 [刘永坚, 田丽霞, 刘栋辉, 等. 实用饲料补充结晶或包膜氨基酸对草鱼生长、血清游离氨基酸和肌肉蛋白质合成率的影响. 水产学报, 2002, 26(3): 252—258]
[10] Yong C Y, Gong S Y, Yang H J,. Effects of supplementation of crystalline or coated lysine and/or methionine on growth performance and feed utilization of the Chinese sucker,[J]., 2011, 316: 31—36
[11] Chen B A, Leng X J, Li X Q,. Study of the effect of crystalline or coated amino acids for[J]., 2008, 32(5): 774—778 [陈丙爱, 冷向军, 李小勤, 等. 晶体或包膜氨基酸对鲤鱼的作用效果研究. 水生生物学报, 2008, 32(5): 774—778]
[12] Leng X J, Wang G, Li X Q,. Supplemental effects of crystalline or coated amino acids on growth performance and serum free amino acids of allogynogenetic crucian carp [J]., 2007, 31(6): 743—748 [冷向军, 王冠, 李小勤, 等. 饲料中添加晶体或包膜氨氨酸对异育银鲫生长和血清游离氨基酸水平的影响. 水产学报, 2007, 31(6): 743—748]
[13] Alam M S, Teshima S I, Koshio S,. Supplemental effects of coated methionine and/or lysine to soy protein isolate diet for juvenile kuruma shrimp,[J]., 2005, 248: 13—19
[14] Leng X J, Li X Q, Chen B A,. Recent advance of utilizing crystalline amino acids by fish [J]., 2009, 33(1): 119—123 [冷向军, 李小勤, 陈丙爱, 等. 鱼类对晶体氨基酸利用的研究进展. 水生生物学报, 2009, 33(1): 119—123]
[15] Langer B W. The biochemical conversion of 2-hydroxy-4-methylthiobutyric acid into methionine by the rat[J]., 1965, 95: 683—687
[16] Dibner J J, Knight C D. Conversion of 2-hydroxy-4- (methylthio) butanoic acid to L-methionine in the chick: a stereospecific pathway [J]., 1984, 114(9): 1716—1723
[17] Martín-Venegas R, Teresa Brufau M, Mercier Y,. Intestinal cell conversion of DL-2-hydroxy-(4-methylthio) butanoic acid: dietary up-regulation by this methionine precursor [J]., 2011, 106(3): 350—356
[18] Dibner J J, Ivey F J. Capacity in the liver of the broiler chick for conversion of supplemental methionine activity to L-methionine [J]., 1992, 71(4):700—708
[19] Gordon R S, Sizer I W. Conversion of methionine hydroxy analogue to methionine in the chick [J]., 1965, 44(3):673—678
[20] Opapeju F O, Htoo J K, Dapoza C,. Bioavailability of methionine hydroxy analog-calcium salt relative to DL-methionine to support nitrogen retention and growth in starter pigs [J]., 2012, 6(11): 1750—1756
[21] Yodseranee R, Bunchasak C. Effects of dietary methionine source on productive performance, blood chemical, and hematological profiles in broiler chickens under tropical conditions [J]., 2012, (44): 1957—1963
[22] Tang X, Zhao R Y, Yu W,. Effects of methionine and methionine hydroxy analogue on muscle protein synthesis and flesh texture in broiler chickens [J]., 2012, 23(33): 53—56 [唐雪, 赵瑞英, 于玮, 等. 蛋氨酸及其羟基类似物对肉鸡肌肉蛋白质合成及质构特性的影响. 食品工业科技, 2012, 23(33): 53—56]
[23] Jonathan B, Delbert M. Evaluation of different sulfur amino acid compounds in the diet of red drum,, and sparing value of cystine for methionine [J]., 2004, 241: 465—477
[24] Shen X Z, Zhou H Q, Hua X M,. Effect of calcium salt of 2-hydroxy-4-(methylthio) butanoic acid (MHA-Ca) on growth performance and white muscle composition of common carp () [J]., 2007, 16(2): 118—223 [沈晓芝, 周洪琪, 华雪铭, 等. 羟基蛋氨酸钙对鲤生长性能和白肌营养组成的影响. 上海海洋大学学报, 2007, 16(2): 118—223]
[25] Savolainen L C, Gatlin III D M. Evaluation of sulfur amino acid and zinc supplements to soybean-meal-based diets for hybrid striped bass [J]., 2010, (307): 260—265
[26] Kelly M, Grisdale-Helland B, Helland S J,. Refined understanding of sulphur amino acid nutrition in hybrid striped bass, ()[J]., 2006, 37(15): 1546—1555
[27] Robinson E H, Allen Jr O W, Poe W E,. Utilization of dietary sulfur compounds by fingerling channel catfish: L-methionine, DL-methionine, methionine hydroxy analogue, taurine and inorganic sulfate [J]., 1978, 108(12): 1932—1936
[28] Keembiyehetty C N, Gatlin III D M. Evaluation of different sulfur compounds in the diet of juvenile sunshine bass () [J]., 1995, 112(1): 155—159
[29] Keembiyehetty C N, Gatlin III D M. Performance of sunshine bass fed soybean-meal-based diets supplemented with different methionine compounds [J]., 1997, 59(1): 25—30
[30] Poston H A. Response of rainbow trout to source and level of supplemental dietary methionine [J]., 1986, 83(4): 739—744
[31] Van Weerden E J, Bertram H L, Schutte J B. Comparison of DL-methionine, DL-methionine-Na, DL-methionine hydroxy analogue-Ca, and DL-methionine hydroxy analogue free acid in broilers by using a crystalline amino acid diet [J]., 1982, 61(6): 1125—1130
[32] Shuai K. Effect of methionine on digestion and immune function of juvenile jian carp [D]. Thesis for Master of Science. Sichuan Agricultural University. Sichuan. 2006 [帅柯. 蛋氨酸对建鲤消化功能和免疫功能的影响. 硕士学位论文. 四川农业大学. 四川. 2006]
[33] NRC, 2012. Nutrient Requirements of Common Carp
[34] Association of Official Analytical Chemists (AOAC), 1995. Official Methods of Analysis of Official Analytical Chemists International, 16th edn. Association of Official Analytical Chemists, Arlington, VA
[35] Zarate D D, Lovell R T, Payne M. Effects of feeding frequency and rate of stomach evacuation on utilization of dietary free and protein bound lysine for growth by channel catfishIctalurus punctatus [J]., 1999, 5: 17—22
[36] Murai T, Ogata H, Takeuchi T,. Composition of free amino acid in excretion of carp fed amino acid diets and casein gelatin diets [J].,1984, 50(11): 1957
[37] Liou C H, Lin S C, Cheng J H. Urinarl amino acid excretion by marine shrimp,, in response to orally administrated intact protein and crystalline amino acids [J]., 2005, 248: 35—40
[38] Kuang S Y, Xiao W W, Feng L,. Effects of graded levels of dietary methionine hydroxy analogue on immune response and antioxidant status of immune organs in juvenile Jian carp (Jian) [J]., 2012, 32(5): 629—636
[39] Cheng Z J, Hardy R W, Blair M. Effects of supplementing methionine hydroxy analogue in soybean meal and distiller’s dried grain-based diets on the performance and nutrient retention of rainbow trout [(Walbaum)] [J]., 2003, 34(14): 1303—1310
EFFECTS OF DIFFERENT FORMS OF DIETARY METHIONINE ON THE GROWTH AND FREE AMINO ACIDS IN SERUM OF JIAN CARP
SHAN Ling-Ling1, 2, LI Xiao-Qin1, 2, 3, 4, ZHENG Xiao-Miao1, ZHAO Xin-Xin1and LENG Xiang-Jun1, 2, 3, 4
(1. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China; 2. Key Laboratory of Freshwater Fishery Germplasm Resources, Ministry of Aquaculture, P. R. China, Shanghai 201306, China; 3. Shanghai Engineering Research Center of Aquaculture, Shanghai 201306, China; 4. Shanghai University Knowledge Service Platform, Shanghai Ocean University Aquatic Animal Breeding Center (ZF1206), Shanghai 201306, China)
In the present study, a methionine-eficient (0.48% methionine) diet was formulated as control. Crystal methionine, encapsulated methionine, methionine hydroxy analogue (MHA), and methionine hydroxyl analog calcium salt (MHA-Ca) were added separately into the control diet to form four experimental diets with the methionine level at 0.58%. Jian carp with an initial body weight of 8.6 g were fed with these five diets and their growth rates were compared after eight weeks. The weight gain (WG) of the control group, crystal methionine group, encapsulated methionine group, MHA group and MHA-Ca group were 343.51%, 350.77%, 382.80%, 384.02%, 385.59% respectively; the feed conversion ratios () of the five groups were 1.58, 1.55, 1.42, 1.42, 1.41 respectively. Compared to the control group, the WGincreased by 11.4%, 11.8%, 12.2% in the encapsulated methionine group, the MHA group and the MHA-Ca group respectively (<0.05); thedecreased by 10.1%, 10.1%, 10.8% respectively (<0.05). However the growth was not affected by the addition of crystal methionine. There were no significant differences in the muscle moisture and crude fat contents between the five groups. The crude protein content in the muscles from the MHA group was significantly lower than that from the crystal methionine group. The free essential amino acids (FEAA) in the serum peaked at the first hour after feeding for both the crystal methionine group and the MHA group, which was one hour earlier than the control group. The serum FEAA of the encapsulated methionine group reached the maximum around the same time as the control group. The serum FEAA of the MHA-Ca group was observed to peak three hours after feeding. These results indicated that the growth of Jian carp could be improved by the addition of dietary encapsulated methionine,MHA, and MHA-Ca, but not crystal methionine.
Jian carp; Crystal Met; Encapsulated Met; MHA; Growth; Serum free amino acids
10.7541/2015.34
S965.1
A
1000-3207(2015)02-0259-08
2014-03-20;
2014-06-21
上海市农委“科技兴农”重点攻关项目(2009-6-6); 上海市重点学科建设项目(Y1101)资助
单玲玲(1988-), 女, 山东省潍坊人; 硕士研究生; 主要研究方向为水产动物营养与饲料科学。E-mail: 893613053@qq.com
冷向军, 博士生导师; E-mail: xjleng@shou.edu.cn
猜你喜欢
杂志排行
水生生物学报的其它文章
- 达氏鲟生长激素基因cDNA克隆、表达及免疫荧光定位研究
- 杂交鲟对六种蛋白原料的表观消化率
- SUPPRESSION OF LIGASE4 OR XRCC6 ACTIVITIES ENHANCES THE DNA HOMOLOGOUS RECOMBINATION EFFICIENCY IN ZEBRAFISH PRIMORDIAL GERM CELLS
- 大兴安岭硅藻的中国新记录属、种
- 鲢快速逃逸游泳行为研究
- EFFECT OF FIBROUS ROOT OF COPTIS CHINENSIS FRANCH AND BERBERINE ON THE NON-SPECIFIC IMMUNITY AND RESISTANCE AGAINST AEROMONAS HYDROPHILAINFECTION IN GRASS CARP (CTENOPHARYNGODON IDELLA)
