大黄鱼幼鱼对饲料硒的需求量
2015-11-29曹娟娟张文兵麦康森孙瑞健
曹娟娟 张文兵 徐 玮 麦康森 孙瑞健, 2
大黄鱼幼鱼对饲料硒的需求量
曹娟娟1张文兵1徐 玮1麦康森1孙瑞健1, 2
(1. 中国海洋大学水产动物营养与饲料农业部重点实验室, 海水养殖教育部重点实验室, 青岛 266003; 2. 通威股份有限公司技术中心, 成都 610041)
为确定大黄鱼()对饲料硒的需求量, 以Na2SeO3为饲料硒源, 配制6种饲料, 硒的添加水平分别为0(对照组)、0.05、0.2、0.4、0.6和0.9 mg/kg, 实测值分别为0.08、0.16、0.27、0.44、0.66和0.96 mg/kg。在海水浮式网箱中养殖初始体重为(9.14±0.09) g的大黄鱼幼鱼10周, 结果表明增重率()、全鱼和骨骼中的硒含量随着饲料硒含量的升高而显著升高(<0.05)。当饲料硒含量分别超过0.27、0.66、0.66 mg/kg时, 这些指标的变化趋于平稳。饲料硒含量对存活率()、饲料效率()、体组成、肝体比()、脏体比()和肥满度()都没有显著影响(0.05)。在血清中谷胱甘肽过氧化物酶(GPX)活性、超氧化物歧化酶(SOD)活性和总抗氧化力(T-AOC)随着饲料硒含量的升高呈现先升高后稳定的趋势(<0.05), 并分别在饲料硒含量为0.44、0.44、0.16 mg/kg时达到最大值。肝脏中GPX活性、SOD活性、T-AOC、过氧化氢酶(CAT)活性和谷胱甘肽还原酶(GR)活性与血清中相应酶的活性有相同的趋势。在肝脏中谷胱甘肽硫转移酶(GST)活性随着饲料硒含量的升高呈现先降低后升高的趋势(<0.05), 并在饲料硒含量最高(0.96 mg/kg)时其活力取得最大值。以为评价指标, 得出大黄鱼幼鱼对饲料中硒的需求量为0.178 mg/kg。以全鱼和骨骼中硒含量、肝脏GPX活性为评价指标, 得出大黄鱼幼鱼对饲料中硒的最小需求量分别为0.575、0.387和0.440 mg/kg。
大黄鱼; 硒; 生长; 抗氧化; 需求量
硒是动物所必需的微量元素, 在生长、免疫、抗氧化和维持体内元素平衡等方面发挥着重要作用, 因而被广泛关注[1, 2]。硒的生物学活性、功能及作用机理在陆生脊椎动物上已有系统研究, 但在水生动物中的研究还很少, 只有少数水生动物的硒的营养需求和代谢反应有所报道, 包括虹鳟()[3]、斑点叉尾()[4]、石斑鱼()[2]、鲈()[5]、草鱼()[6]和皱纹盘鲍(Ino)[7]等。
大黄鱼()是我国特有的重要海水经济鱼类, 2012年全国养殖产量达到0.95´108kg, 位居我国海水养殖鱼类产量第三[8]。然而, 目前大黄鱼的养殖还主要依赖投喂冰鲜鱼, 这导致了资源浪费、环境污染和疾病频发等一系列问题, 配合饲料的普及率尚不足20%。大黄鱼专用配合饲料的研制和推广应用亟需开展。营养均衡的配合饲料是建立在相关的营养研究基础上的, 近年来, 已有较多关于大黄鱼营养研究的报道, 主要涉及蛋白质和氨基酸[9—12]、脂肪[13, 14]等的营养需求。关于大黄鱼矿物元素营养的报道有磷、铁和锌, 其需求量分别0.89%—0.91%[15]、101.2 mg/kg[16]、59.6— 84.6 mg/kg[17]。本研究拟通过配制含不同梯度硒的饲料养殖大黄鱼, 结合生长和生理指标确定饲料硒的最适需求量, 为大黄鱼高效配合饲料的开发提供基础数据。
1 材料与方法
1.1 实验饲料
实验饲料配方及组成见表1。以酪蛋白、明胶和鱼肉浓缩蛋白为蛋白源, 鱼油、卵磷脂为脂肪源, 糊精为糖源, 配制等氮(粗蛋白含量47%)、等脂(粗脂肪含量9%)的半精制饲料。以Na2SeO3(Ruibio)为饲料硒源, 配制6种饲料。硒的添加水平分别为0(对照组)、0.05、0.2、0.4、0.6和0.9 mg/kg, 实测值分别为0.08、0.16、0.27、0.44、0.66和0.96 mg/kg。饲料制作前, 所有原料经粉碎后过80目筛网, 各原料混合均匀后加入鱼油和卵磷脂搓匀, 随后加适量的水揉匀, 经F(II)-26型双螺杆挤条机(华南理工大学, 广州)加工制成粒径为3 mm×5 mm的颗粒饲料。然后置于45℃鼓风烘箱烘干至水分含量10%以下, 并用塑料袋包装后保存于–20℃冰箱中备用。
1.2 养殖管理
实验用大黄鱼幼鱼购自福建宁德市富发水产有限公司, 采用当年孵化的同一批鱼苗, 在海水浮式网箱中进行养殖实验。养殖实验开始前, 所有大黄鱼暂养在尺寸为3.0 m×3.0 m×3.0 m网箱中, 用商业饲料饲养2周, 使实验鱼适应颗粒饲料和养殖环境。

表1 实验饲料配方(%干重)
注:a酪蛋白(不含维生素): 粗蛋白92.24%, 粗脂肪0.84% (Sigma Chemical, St. Louis, MO., USA);b多维(mg/kg饲料): 维生素A醋酸酯, 32; 维生素D3, 5; 甲基萘醌亚硫酸氢钠, 5.1; α-生育酚, 120; 维生素B1, 25; 核黄素, 36.7; 维生素B6, 20; 维生素B12, 0.1; D-泛酸钙, 60; 盐酸, 200; 叶酸, 20; 生物素, 1.2; 肌醇, 792; 维生素C, 2000; 氯化胆碱, 4000; 微晶纤维素, 12683;c多矿(不添加硒) (mg/kg饲料): MgSO4·7H2O, 1826; CuSO4·7H2O, 9.8; FeSO4·7H2O, 119; ZnSO4·7H2O, 76; MnSO4·H2O, 44; CoCl2·6H2O, 2; Ca(IO3)2·6H2O, 2.35; 微晶纤维素, 7920
Note:aCasein, vitamin-Free: crude protein 92.24%, crude lipid 0.84% (Sigma Chemical, St. Louis, MO., USA);bVitamin premix (mg/kg diet): retinol acetate, 32; cholecalciferol, 5; menadione sodium bisulfite, 5.1; α-tocopherol, 120; thiamin-HCl, 25; riboflavin, 36.7; pyridoxine-HCl, 20; vitamin B12, 0.1; D-pantothenic acid calcium, 60; niacin acid, 200; folic acid, 20; biotin, 1.2; inositol, 792; ascorbic acid, 2000; choline chloride, 4000; microcrystalline cellulose, 12683;cMineral premix, selenium-free (mg/kg diet): MgSO4·7H2O, 1826; CuSO4·7H2O, 9.8; FeSO4·7H2O, 119; ZnSO4·7H2O, 76; MnSO4·H2O, 44; CoCl2·6H2O, 2; Ca(IO3)2·6H2O, 2.35, microcrystalline cellulose, 7920
实验开始前, 所有大黄鱼饥饿24h, 然后称重, 随机挑选规格相似[平均初始重量: (9.14±0.09) g]、体格健壮的大黄鱼随机分配到18个尺寸为1.5 m× 1.5 m× 2.0 m的网箱中, 每个网箱放养60尾, 每个处理组设3个重复。在实验过程中, 每天饱食投喂2次, 投喂时间分别是05:00和17:30, 养殖周期是10周。在整个养殖过程中, 海水温度是22—29.5℃, 盐度25‰—28‰, 溶解氧在7 mg/L左右。定期取海水样测其中硒含量, 没有检测到硒。
1.3 样品收集和分析
在养殖实验结束后, 所有的实验鱼饥饿24h, 然后对每个网箱中的鱼计数、称重, 计算增重率()和存活率()。每个网箱中随机取5尾鱼保存在–20℃冰箱中, 用于测定全鱼体组成(水分、灰分、粗脂肪、粗蛋白)和鱼体中硒含量。另从每个网箱中随机取12尾鱼, 测量体长、体重, 用于计算肥满度。随后立即从尾静脉取血放置在4℃冰箱中静置过夜, 随后3000 r/min离心15min, 将所得血清分装到0.5 mL离心管中, 用于测定超氧化物歧化酶(SOD)活性、谷胱甘肽过氧化物酶(GPX)活性和总抗氧化力(T-AOC)。取血后的鱼分别取肝脏和内脏并称重, 计算肝体比()和脏体比()。另从每个网箱中随机取6尾鱼, 测定肝脏中SOD、GPX、谷胱甘肽硫转移酶(GST)、谷胱甘肽还原酶(GR)和过氧化氢酶(CAT)活性, 以及T-AOC。取肝脏后的鱼保存于–20℃,用来测定骨骼中硒含量。
全鱼和饲料中常规成分的测定方法采用AOAC[18]的标准方法。全鱼和骨骼中的硒含量采用氢化物原子荧光光谱法(HG-AFS)测定。采用相应的试剂盒(南京建成生物工程研究所)测定血清和肝脏中上述酶的活性和T-AOC。
1.4 计算和统计分析
增重率(, %)=(终末体重–初始体重)/初始体重×100
存活率(, %)=(实验鱼终末尾数/实验鱼初始尾数)×100
饲料效率()=(终末体重–初始体重)/摄食饲料重量
肝体比(, %)=(肝脏重量/鱼体重量)×100
脏体比(, %)=(内脏重量/鱼体重量)×100
肥满度(, %)=(鱼体重量/鱼体体长3)×100
所有数据采用平均值±标准差(=3)表示。运用SPSS 17.0分析软件进行单因素方差分析(ANOVA), 当达到差异显著(<0.05)时, 用Tukey检验比较不同处理组间差异。利用折线模型对全鱼、骨骼中硒含量和肝脏GPX活性进行分析[19], 以确定大黄鱼对饲料中硒的需求量。
2 结果
2.1 生长和饲料利用
大黄鱼生长状况和饲料利用情况见表2。饲料中硒含量对大黄鱼的终末体重和有显著影响(<0.05)。当饲料硒含量从0.08 mg/kg上升到0.27 mg/kg时,逐渐升高, 之后趋于稳定。对进行折线模型回归分析, 得出大黄鱼饲料中最适硒含量为0.178 mg/kg (图1)。

表2 饲料硒对大黄鱼增重率、存活率和饲料效率的影响
注: 平均值±标准差,=3; 同一列有相同上标字母的数值表示差异不显著(>0.05); 下同
Note: Mean±SD,=3; Values in the same column sharing a common superscript letter were not significantly different (>0.05); the same applies bellow
饲料中硒含量对大黄鱼的和没有显著影响(>0.05)。的值为75.24%—82.38%,的值为0.76—0.81。
2.2 体组成
大黄鱼体组成情况见表3。饲料硒含量对大黄鱼全鱼水分、粗蛋白、粗脂肪和灰分都没有显著影响(>0.05)。全鱼水分含量为72.66%—73.55%, 全鱼粗蛋白含量为16.25%—16.94%, 全鱼粗脂肪含量为7.76%—8.07%, 全鱼灰分含量为3.42%—3.58%。
2.3 形体指标
鱼体肝体比、脏体比和肥满度等形体指标没有受到饲料硒含量的显著影响(>0.05)(表4)。肝体比的数值为1.24%—1.36%, 脏体比的数值为3.04%— 3.57%, 肥满度的数值为1.61—1.66。
2.4 组织硒含量
饲料硒含量对大黄鱼体内组织中硒含量的影响结果见表5。饲料硒含量为0.08—0.66 mg/kg时, 全鱼硒含量随着饲料硒含量的升高而升高。在饲料硒含量为0.66—0.96 mg/kg时, 全鱼硒含量趋于平稳, 并在饲料硒含量为0.66 mg/kg时取得最大值。骨骼中硒含量与饲料硒含量之间的关系和全鱼硒含量有相同的趋势, 也在饲料硒含量为0.66 mg/kg时取得最大值。对全鱼中硒含量和骨骼中硒含量进行折线回归模型分析, 得出大黄鱼幼鱼对饲料硒的最小需求量分别为0.575 mg/kg (图2)和0.387 mg/kg (图3)。

表3 饲料硒对大黄鱼体组成的影响
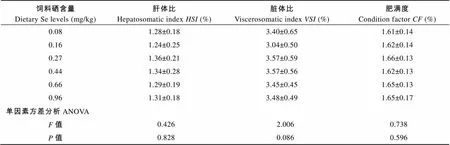
表4 饲料硒对大黄鱼形体指标的影响
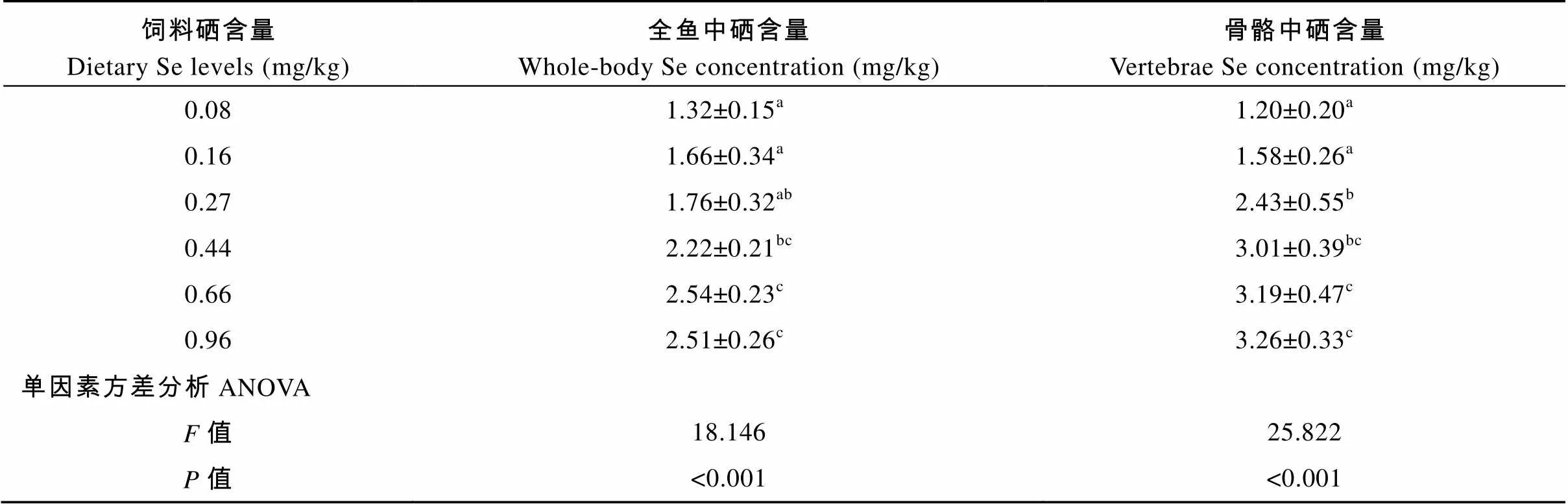
表5 饲料硒对大黄鱼体内硒含量的影响
2.5 血液和肝脏指标
饲料硒含量对血清中各检测酶活性的影响结果见表6。在饲料中不添加硒的处理组, GPX活性和T-AOC最低。二者随着饲料硒含量的增加而显著升高(<0.05), 随后保持稳定, 并分别在饲料硒含量为0.44 mg/kg和0.27 mg/kg时取得最大值。血清SOD活性随着饲料硒含量的升高呈现先升高后降低的趋势(<0.05), 饲料硒含量最高(0.96 mg/kg)处理组中血清SOD活性最低。
由表7可知, 当饲料硒含量为0.08—0.44 mg/kg时, 肝脏中GPX和GR的活性随着饲料硒含量的增加而显著升高(<0.05)。当饲料硒含量达到0.66 mg/kg时, GPX活性保持平稳, 而GR活性显著降低。当饲料硒含量为0.08—0.27 mg/kg时, 肝脏中SOD、T-AOC活性随着饲料硒含量的增加显著升高(<0.05)。当饲料硒含量0.44—0.96 mg/kg时, T-AOC不再升高并出现平台期, SOD活性先下降后达到平台期。肝脏中GST活性随着饲料硒含量的升高呈现先下降后上升的趋势(<0.05)。在饲料硒含量为0.96 mg/kg时, GST活性取得最大值。肝脏中CAT活性随着饲料硒含量的升高呈现先上升后降低的趋势(<0.05), 在硒含量为0.16 mg/kg时CAT活性有最大值。对肝脏中GPX活性进行折线回归模型分析, 得出大黄鱼幼鱼对饲料硒的最小需求量为0.440 mg/kg (图4)。
3 讨论
3.1 饲料中硒含量对大黄鱼幼鱼生长状况的影响
本研究结果表明, 在饲料中添加硒对养殖大黄鱼的生长和维持正常生理功能是必要的。以增重率为评价指标得出大黄鱼幼鱼对饲料硒的需求量为0.178 mg/kg (图1), 与在斑点叉尾(0.25 mg/kg)[4]、虹鳟(0.28 mg/kg)[20]中的研究结果一致。然而石斑鱼、军曹鱼(L.)和草鱼对饲料硒的需求量分别为0.7[2]、0.788[21]和0.631 mg/kg[6], 比本研究中的需求量稍高。不同鱼类对饲料硒的耐受能力有差异, 当虹鳟[3]长时间投喂含硒量为13 mg/kg的饲料时, 会出现慢性中毒现象, 具体表现为生长减缓、饲料效率降低和死亡率升高等。根据Gatlin 和Wilson[4]、Tashjian等[22]的报道, 鱼类对饲料中硒毒性的阈值是10—20 mg/kg。由此可以看出, 鱼类对饲料硒的敏感度不同, 再加上养殖模式、管理方式和生活状态等的不同, 导致不同鱼类对饲料硒的需求量有所差异。
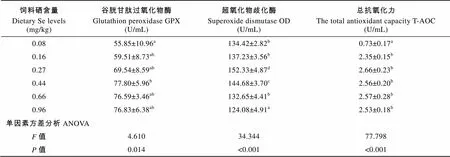
表6 饲料硒对大黄鱼血清中酶活性的影响
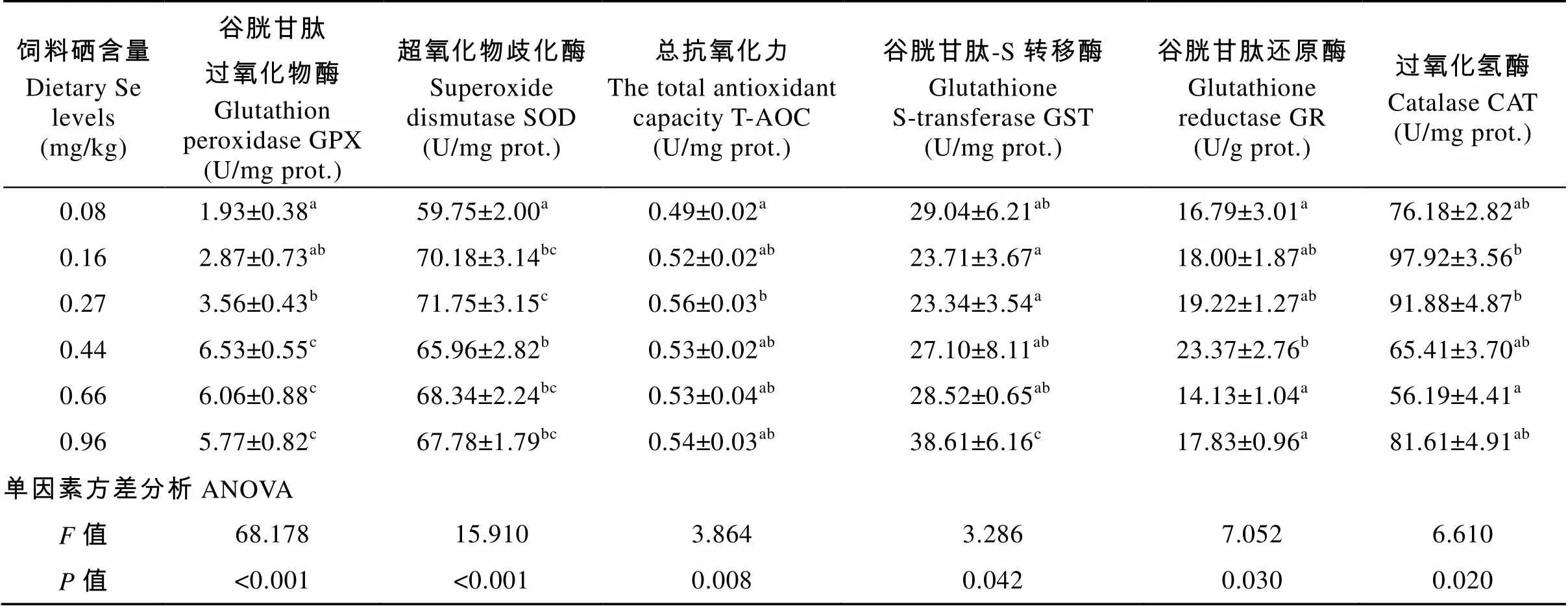
表7 饲料硒对大黄鱼肝脏中酶活性的影响
3.2 饲料硒含量对大黄鱼体内硒含量的影响
动物机体中营养元素的含量, 是估计机体需要量的一个重要指标[23]。在本研究中, 随着饲料硒含量的增加, 全鱼和骨骼中硒含量也随之增加(图3、图4)。虹鳟[3]的肾脏、肝脏和全鱼的硒含量, 以及斑点叉尾[4]肌肉中的硒含量均随着饲料硒含量的增加出现显著升高的趋势, 和本研究结果一致。Elia等[24]对鲤()的研究发现, 在投喂硒含量为0.25和1 mg/kg的饲料60d后, 硒含量为1 mg/kg的饲料对应鲤肾脏中有最高的硒累积量。在肾脏、肝脏和肌肉这三个组织中累积硒的能力依次为: 肾脏>肝脏>肌肉。这与Hamilton[25]报道的肝脏和肾脏是硒的主要累积位点的研究结果一致。在其他鱼类的研究中也发现了这种现象。Lin和Shiau[2]对石斑鱼的研究表明, 当饲料硒含量为4 mg/kg时, 肝脏中硒含量最高, 其次是硒含量为2.02 mg/kg的饲料组, 然后是硒含量为1.38 mg/kg的饲料组, 基础饲料组中(0.21 mg/kg)肝脏硒含量最低。以全鱼和骨骼中硒含量为评价指标, 通过折线模型分析, 大黄鱼幼鱼对饲料中硒的最小需求量分别为0.575 mg/kg (图2)和0.387 mg/kg(图3)。
3.3 饲料硒含量对大黄鱼血清和肝脏中抗氧化酶活性的影响
硒对体内抗氧化酶活性的影响在其他鱼类的研究中已有报道, 主要包括罗非鱼(spp.)[26]、鲤(L)[27]、石斑鱼[2]、石脂鲤()[28]、虹鳟()[29]和鲫()[30]等。SOD可以催化超氧阴离子形成H2O2和O2, 随后H2O2在GPX和CAT的作用下分解生成水和氧气。在本研究中肝脏SOD和CAT活性随着饲料中硒含量的升高而升高, 当饲料中硒含量超过0.27 mg/kg时两者都达到平台期, 这可能是由于肝脏中这两种酶活性的升高, 抵消了高含量的硒诱导的促氧化反应[24]。硒是GPX的重要组成部分, 在H2O2和脂质过氧化物的分解中有着重要的作用。在本研究中肝脏GPX活性随着饲料硒含量的升高而升高, 组织中高水平的硒能诱导GPX的活性, 增强解毒能力, 能抵抗H2O2带来的损害[24]。维持GPX的最佳活性需要在饲料中添加硒, 然而硒含量过高或者过低都会导致脂质过氧化物水平增加。Wang等[30]对鲫的研究发现, 在饲料中添加0.5 mg/kg的硒可以促进其生长、提高GPX活性和肌肉中硒含量。在对斑点叉尾()[31]的研究发现, 在缺硒处理组, GPX活性降低、GST活性升高。但是在对大西洋鲑()[32]的研究中发现, 添加1 mg/kg的硒对肝脏中GPX活性没有显著影响。GR可以将GSSG转换为GSH。在本研究中, 投喂高硒饲料显著降低大黄鱼肝脏GR活性, 这可能是由于高含量硒促进了机体氧化作用, 这一结果和Lin和Shiau[2]的研究结果一致。后者在投喂硒含量为0.77 mg/kg的饲料后, 石斑鱼肝脏中活性显著下降。GST可以参与肝脏的解毒功能。在本研究中, 随着饲料硒含量的升高GST的活性也升高, 这与Elia等[24]对鲫的研究结果一致。T-AOC也是机体抗氧化效果的一个重要指标。在本研究中随着饲料硒含量的升高, T-AOC先升高后达到一个平台期。综合以上研究结果可以看出, 饲料硒含量在一定范围内升高可以提高大黄鱼机体的抗氧化能力。但是过高含量的硒会影响机体抗氧化能力, 导致抗氧化酶活性下降, 并可能引起体内氧化压力的增加。以肝脏中GPX活性为评价指标, 通过折线模型分析, 大黄鱼幼鱼对饲料中硒的最小需求量为0.440 mg/kg (图4)。
总的来说, 硒对大黄鱼幼鱼的生长和抗氧化功能至关重要。以为评价指标, 得出大黄鱼幼鱼对饲料硒需求量为0.178 mg/kg。分别以全鱼和骨骼中硒含量、肝脏GPX活性为评价指标, 得出大黄鱼幼鱼对饲料硒的最小需求量分别为0.575、0.387和0.440 mg/kg。
[1] National Research Council. Nutrient Requirements of Fish [M]. National Academy Press, Washington DC, USA. 1993, 144
[2] Lin Y H, Shiau S Y. Dietary selenium requirements of juvenile grouper,[J]., 2005, 250: 356—363
[3] Hilton J W, Hodson P V, Slinger S J. The requirement and toxicity of selenium in rainbow trout() [J]., 1980, 110: 2527—2535
[4] Gatlin III D M, Wilson R P. Dietary selenium requirement of fingerling channel catfish [J]., 1984, 114: 627—633
[5] Liang M Q, Wang J L, Mai K S,. Effects of dietary Se on growth performance and activities of related enzymes in juvenile Japanesen seabass[J]., 2006, 13: 1017—1022 [梁萌青, 王家林, 麦康森, 等. 饲料中硒的添加水平对鲈鱼生长性能及相关酶活性的影响. 中国水产科学, 2006, 13: 1017—1022]
[6] Su C F. Studies on dietary selenium requirements of juvenile grass carp[D]. Chongqing: Southwest University. 2008 [苏传福. 草鱼幼鱼硒的营养需要研究. 重庆: 西南大学. 2008]
[7] Wang W F, Mai K S, Zhang W B,. Dietary selenium requirement and its toxicity in juvenile abalone[J]., 2012, 330: 42—46
[8] China Fishery Statistical Yearbook, Fishery Bureau, Ministry of Agriculture. China Agriculture Press, Beijing, China. 2013 [中国渔业统计年鉴, 农业部渔政局. 中国农业出版社, 中国北京. 2013]
[9] Sun R J, Zhang W B, Xu W,. Effects of dietary protein level and feeding frequency on the growth performance, body composition and protein metabolism of juvenile large yellow croaker,R. [J]., 2013, 37(2): 281—289 [孙瑞健, 张文兵, 徐玮, 等. 饲料蛋白质水平与投喂频率对大黄鱼生长, 体组成及蛋白质代谢的影响. 水生生物学报, 2013, 37(2): 281—289]
[10] Yu H R, Ai Q H, Mai K S,.Effects of dietary protein levels on the growth, survival, amylase and trypsin activities in large yellow croaker,R., larvae [J]., 2012, 43: 178—186
[11] Xie F J, Ai Q H, Mai K S,. Dietary lysine requirement of large yellow croaker(,Richardson 1846) larvae [J]., 2012, 43: 917—928
[12] Mai K S, Wan J L, Ai Q H,Dietary methionine requirement of large yellow croakerR [J]., 2006a, 253: 564—572
[13] Zhang F. Lipid requirement and fishmeal replacement in diets of large yellow croaker,R [D]. Qingdao: Ocean University of China, 2012 [张帆. 大黄鱼 (R) 脂类营养生理和饲料替代蛋白源的研究, 青岛: 中国海洋大学. 2012]
[14] Zhang W, Xu S L, Shen Q,. Fatty acid cimposition in muscle and liver of large yellow croaker[J]., 2009, 117—121 [张薇, 徐善良, 沈勤, 等. 大黄鱼鱼种阶段脂肪酸组成研究. 水产科学, 2009, 117—121]
[15] Mai K S, Zhang C X, Ai Q H,. Dietary phosphorus requirement of large yellow croaker,R [J]., 2006b, 251: 346—353
[16] Zhang J M. Studies on nutritional physiology of Zinc and Iron for Japanese seabass,and large yellow croaker,R.[D]. Qingdao: Ocean University of China. 2007 [张佳明. 鲈鱼和大黄鱼微量元素—锌, 铁的营养生理研究, 青岛: 中国海洋大学. 2007]
[17] Zhang J M, Ai Q H, Mai K S,. Dietary zinc requirement of juvenile large yellow croaker,[J]., 2008, 32: 417—424 [张佳明, 艾庆辉, 麦康森, 等. 大黄鱼幼鱼对饲料中的锌需要量. 水产学报, 2008, 32: 417—424]
[18] Association of Official Analytical Chemists (AOAC) [M]. Official Methods of Analysis, 16thed, Association of Official Analytical Chemists, Arlington, VA. 1995
[19] Robbins K R, Norton H W, Baker D H. Estimation of nutrient requirements from growth data [J]., 1979, 109: 1
[20] Wang C, Lovell R T. Organic selenium sources, selenomethionine and selenoyeast, have higher bioavailability than an inorganic selenium source, sodium selenite, in diets for channel catfish () [J]., 1997, 152(1): 223—234
[21] Liu K, Wang X J, Ai Q H. Dietary selenium requirement for juvenile cobia,L [J]., 2010, 41: e594—e601
[22] Tashjian D H, Teh S J, Sogomonyan A,Bioaccumulation and chronic toxicity of dietary l-selenomethionine in juvenile white sturgeon () [J]., 2006, 79: 401—409
[23] Baker D H. Problems and pitfalls in animal experiments designed to establish dietary requirements for essential nutrients [J]., 1986, 116: 2239—2249
[24] Elia A C, Prearo M, Pacini N,. Effects of selenium diets on growth, accumulation and antioxidant response in juvenile carp [J]., 2011, 7: 166—173
[25] Hamilton S J. Review of selenium toxicity in the aquatic food chain [J]., 2004, 326: 1—21
[26] Abbas H H H, Authman M M N. Effects of accumulated selenium on some physiological parameters and oxidative stress indicators in Tilapia fish (spp.) [J]., 2009, 5: 219—22
[27] Jovanovic A, Grubor-Lajsic G, Djukic N,The effect of selenium on antioxidant system in erythrocytes and liver of the carp (L) [J]., 1997, 37: 443—448
[28] Monteiro D A, Rantin F T, Kalinin A L. The effects of selenium on oxidative stress biomarkers in the freshwater characid fish matrinxã,(Gunther, 1869) exposed to organophosphate insecticide Folisuper 600 BR(methyl parathion) [J]., 2009, 149: 40—49
[29] Orun I, Talas Z S, Ozdemir I,. Antioxidative role of selenium on some tissues of (Cd2+, Cr3+)-induced rainbow trout [J]., 2008, 71: 71—75
[30] Wang Y, Hanb J, Lia W,. Effect of different selenium source on growth performances, glutathione peroxidase activities, muscle composition and selenium concentration of allogynogenetic crucian carp () [J]., 2007, 134: 243—251
[31] Gatlin III D M, Poe WE, Wilson R P. Effects of singular and combined dietary deficiencies of selenium and vitamin E on fingerling channel catfish () [J]., 1986, 116: 1061—1067
[32] Lorentzen M, Maage A, Julshamn K. Effects of dietary selenite or selenomethionine on tissue selenium levels of Atlantic salmon () [J]., 1994, 121: 359—367
DIETARY SELENIUM REQUIREMENT OF JUVENILE LARGE YELLOW CROAKER
CAO Juan-Juan1, ZHANG Wen-Bing1, XU Wei1, MAI Kang-Sen1and SUN Rui-Jian1, 2
(1. The Key Laboratory of Aquaculture Nutrition and Feeds, Ministry of Agriculture; the Key Laboratory of Mariculture, Ministry of Education; Ocean University of China, Qingdao 266003, China; 2. Tongwei Co., LTD., Chengdu 610041, China)
To study the effects of selenium to the juvenile large yellow croaker,six experimental diets were formulated to contain the following diets with increment levels of selenium 0 (control), 0.05, 0.2, 0.4, 0.6 and 0.9 mg/kg, respectively. The final content of selenium in each diet was 0.08, 0.16, 0.27, 0.44, 0.66, and 0.96 mg/kg, respectively. Each diet was randomly assigned to triplicate groups of 60 large yellow croaker juveniles [initial body weight: (9.14 ± 0.09) g]. Fish were fed twice daily (5:00 and 17:30) to satiation for 10 weeks. The results showed that the weight gain rate (), whole-body, and vertebrae Se concentration significantly increased with the increased dietary selenium levels (<0.05), and no further increases when the dietary Se concentration was 0.27 mg/kg or higher in the diet. No significant differences were found in the survival rate (), feed efficiency (), body compositions, hepatosomatic index (), viscerosomatic index (), and condition factor () cross the 6 treatment groups (>0.05). The serum glutathione peroxidase (GPX) activity, superoxide dismutase (SOD) activity and total antioxidant capacity (T-AOC) significantly increased with the increasing of dietary selenium levels (<0.05) with the highest activities at 0.44 mg/kg and 0.16 mg/kg of dietary selenium, respectively. The GPX activity, SOD activity, T-AOC, catalase (CAT) activity, and glutathione reductase (GR) activity in liver had a similar trend with serum enzyme activity. The liver glutathione S-transferase (GST) activity significantly decreased with the increasing of dietary selenium levels (<0.05), and then increased (<0.05). The highest activity was found in the highest Se level (0.96 mg/kg). Based on, the dietary Se requirement of juvenile large yellow croaker was 0.178 mg/kg. Based on the whole-body and vertebrae Cu concentration, liver GPX activity, the minimum dietary Se requirements were 0.575, 0.387 and 0.440 mg/kg, respectively.
Large yellow croaker; Selenium; Growth; Antioxidation; Requirement
10.7541/2015.32
S963.7
A
1000-3207(2015)02-0241-09
2014-04-04;
2014-06-18
国家公益性行业(农业)科研专项经费项目(编号: 201003020, 200903029)资助
曹娟娟(1986—), 女, 山东济宁人; 硕士; 研究方向为水产动物营养与饲料。E-mail: caojuan2010_cool@126.com
张文兵, 教授; E-mail: wzhang@ouc.edu.cn
猜你喜欢
杂志排行
水生生物学报的其它文章
- 达氏鲟生长激素基因cDNA克隆、表达及免疫荧光定位研究
- 杂交鲟对六种蛋白原料的表观消化率
- SUPPRESSION OF LIGASE4 OR XRCC6 ACTIVITIES ENHANCES THE DNA HOMOLOGOUS RECOMBINATION EFFICIENCY IN ZEBRAFISH PRIMORDIAL GERM CELLS
- 大兴安岭硅藻的中国新记录属、种
- 鲢快速逃逸游泳行为研究
- EFFECT OF FIBROUS ROOT OF COPTIS CHINENSIS FRANCH AND BERBERINE ON THE NON-SPECIFIC IMMUNITY AND RESISTANCE AGAINST AEROMONAS HYDROPHILAINFECTION IN GRASS CARP (CTENOPHARYNGODON IDELLA)
