IHNV单克隆抗体的制备及其初步应用
2015-11-29景宏丽王静波王小亮徐立蒲
曹 欢 景宏丽 王 姝 王静波 王小亮 徐立蒲
IHNV单克隆抗体的制备及其初步应用
曹 欢1景宏丽2王 姝1 王静波1 王小亮1 徐立蒲1
(1. 北京市水产技术推广站, 北京100021; 2. 中国检验检疫科学研究院动物检验检疫研究所, 北京100029)
传染性造血器官坏死病毒; 单克隆抗体; 双抗体夹心ELISA法
传染性造血器官坏死(Infectious haematopoietic necrosis, IHN) 是严重危害我国鲑、鳟鱼苗种业的一种病毒性疾病。主要感染虹鳟、硬头鳟等冷水鱼类, 急性感染时累计死亡率可达95%以上[1, 2], 并可垂直传播给子代。IHN被世界动物卫生组织(OIE)列为必须申报的动物疫病, 被我国列为二类动物疫病。该病最早流行于北美和欧洲一些国家, 目前已经蔓延至我国辽宁、河北、甘肃等主要冷水鱼养殖地区, 并造成较大经济损失[3, 4]。
该病的病原是传染性造血器官坏死病毒(Infectious haematopoietic necrosis virus, IHNV), 属弹状病毒科(), 粒外弹状病毒属()。目前我国对IHNV检测方法的研究相对落后, 主要集中在检测病毒核酸的PCR方法[5, 6], 由于缺乏IHNV的相应抗体, 免疫学诊断技术的研究比较缺乏。本研究旨在制备抗传染性造血器官坏死病毒的特异性单克隆抗体, 以期研制出特异、灵敏、快速、大通量的病毒检测方法。
1 材料与方法
1.1 实验材料
传染性造血器官坏死病毒(IHNV-UK)由英国Weymouth的OIE参考实验室赠送给中国检验检疫科学研究院水生动物检疫实验室江育林研究员并惠赠给本实验室。实验用鱼类细胞系及病毒株均由本实验室保藏, BALB/c小白鼠购自北京军事科学与医学研究院。RPMI 1640 购自HYCLONE公司, 特级胎牛血清购自杭州四季青公司, HAT、HT、聚乙二醇(PEG1500)购自GIBCO公司, 二甲基亚砜购自上海生物公司, 辣根过氧化物酶(HRP)标记的羊抗小鼠Ig、硫酸盐(TMB)、弗氏完全佐剂和不完全佐剂购自SIGMA公司, 羊抗鼠IgG亚类检测试剂盒购自Southern Biotech公司, CKX41倒置相差显微镜为OLYMPUS公司产品, 二氧化碳培养箱为SANYO公司产品; Avanti J-30I 超速离心机为BECKMAN公司产品。其他生化试剂均为国产分析纯。
1.2 抗原的制备及动物免疫
培养鲤上皮瘤细胞(EPC), 传代16—24h内接种IHNV-UK, 加入含10%胎牛血清的培养液置于17.5℃培养。当细胞产生90%病变(CPE)之后冻融1次, 收集病毒液。8000 r/min离心30min, 收集的上清再24000 r/min离心2h以沉淀病毒, 沉淀用适量0.01 mol/L PBS重悬。免疫BALB/c小鼠, 共免疫5次, 首次免疫为病毒加等量弗氏完全佐剂, 第2次免疫为病毒加等量弗氏不完全佐剂, 其余各次免疫仅用全病毒, 免疫剂量为每次0.1 mL纯病毒(约15 mg/mL), 免疫途径为腹腔注射。
1.3 细胞融合及阳性杂交瘤细胞株的筛选
按照常规方法[7]进行细胞融合, 阳性杂交瘤细胞株的筛选参照文献[8]中的间接ELISA方法, 不同的是包被抗原用提纯的IHNV-UK, 包被抗原浓度为15 mg/L。用羊抗IHNV血清的稀释度通过做方阵滴定试验决定。
1.4 阳性杂交瘤细胞株的建立及腹水的制备
将鉴定为阳性的细胞孔中的细胞扩大培养, 并及时冻存, 同时按照有限稀释法进行亚克隆, 至杂交瘤细胞孔抗体阳性率为100%时, 即可定株。按照常规方法[8]进行小鼠腹水的制备。
1.5 单克隆抗体特性鉴定
mAb效价测定收集杂交瘤细胞培养上清液及腹水, 以2倍比进行稀释, 用间接ELISA法测定效价。
mAb的亚类鉴定按照SouthernBiotech单抗分型试剂盒介绍的方法进行亚类鉴定。
Werstern-blot分析按常规方法[9]将纯化的病毒进行SDS-PAGE和Werstern-blot, 浓缩胶为5%, 分离胶为12%。一抗为制备的腹水单抗(1∶500)二抗为辣根过氧化物酶(HRP)标记的羊抗鼠IgG(1∶5000), DAB显色。
中和活性的测定将腹水从1∶20起做倍比稀释至1︰2560, 将病毒20050/100 mL与各稀释度腹水等体积混合, 25℃感作1h , 然后接种到新鲜制备的单层EPC细胞上, 每天观察细胞病变, 连续观察7d, 按Reed-Muench法计算单抗的中和效价。
1.6 mAb双夹心ELISA法的建立
mAb双夹心ELISA法操作步骤用2.5 μg/mL羊抗IHNV多抗包板4℃过夜, 100 µL/孔。PBST洗3遍; 加1︰10的鱼组织匀浆上清液, 并设阳性、阴性对照, 100 µL/孔。37℃ 1h, PBST洗3遍; 加单抗 1B10, 100 µL/孔, 37℃ 1h, PBST洗2遍; 加0.1% H2O2, 300 µL/孔, 37℃ 15min, PBST洗2遍; 加羊抗鼠IgG-HRP, 100 µL/孔, 37℃ 1h, PBST洗3遍; 加显色液(TMB+H2O2) 100 µL/孔, 室温避光作用5—10min, 用2 mol/L H2SO4溶液终止, 150 µL/孔, 测定OD450。当样品的OD值>阴性OD值的平均值+3SD时, 判定为阳性。
mAb双夹心ELISA法的特异性以5种鱼类病毒和8株鱼类细胞为样品, 用建立的mAb双夹心ELISA法进行检测。
mAb双夹心ELISA法的灵敏度纯化的IHNV病毒(5.4 mg/mL)以10倍比稀释, 未纯化的病毒 (105.550/100 µL)以2倍比稀释; 病毒接种EPC细胞, 每24h取样, 用建立的mAb双夹心ELISA法进行检测。
1.7 mAb双夹心ELISA法的应用
对分离株的测定取9个IHNV分离株, 用建立的mAb双夹心ELISA法进行检测, 同时采用Karber法计算50[10]。
对样品的测定随机抽取43份盲样(每个样品不少于15尾鱼), 取肝、脑、脾、肾组织匀浆后, 用0.01 mol/L PBS 1︰10稀释制成混悬液, 离心取上清, 用建立的mAb双夹心ELISA法进行检测。同时, 采用细胞培养分离病毒和PCR鉴定的方法对样品进行平行检测, 比较两种方法的一致程度。
2 结果
2.1 细胞融合
在细胞融合后, 经含HAT的培养基进行筛选, 产生100多个杂交瘤细胞, 用建立的间接ELISA法筛选, 阳性孔经3次克隆纯化后, 最终得到1株可高效、稳定分泌抗IHNV-UK抗体的杂交瘤细胞株, 命名为1B10。
2.2 mAb1B10的生物学特性
间接ELISA法测得细胞上清的抗IHNV效价在1︰160以上, 腹水的抗IHNV效价在1︰2.5×105以上。中和试验结果显示, mAb 1B10没有中和IHNV的能力。抗体亚类鉴定结果显示, mAb 1B10为IgG1亚类, 轻链为Kappa链。采用SDS-PAGE和Western-blot方法测定, mAb 1B10针对的抗原决定簇位点位于IHNV-UK的相对分子量(Mt)42000的蛋白条带上。推断该蛋白为IHNV核蛋白, 该结果与文献[11]报道一致, 赵永欣等[12]表达了IHNV- ZYX的核蛋白大小约48 kD, 与本文推断基本相符。
2.3 mAb双夹心ELISA法的特异性
用建立的mAb双夹心ELISA法测定5种病毒和8种鱼类细胞的OD值, 结果显示, 仅IHNV-UK呈阳性反应, 而其他5种病毒和8种鱼类细胞均呈阴性反应。
2.4 mAb双夹心ELISA法的灵敏度测定
将提纯的IHNV-UK按1︰10的稀释度作倍比稀释后用建立的mAb双夹心ELISA法检测, 最低检出限为540 ng/mL; 将病毒悬液按1︰2稀释度作倍比稀释后用建立的mAb双夹心ELISA法检测, 检测灵敏度达到1︰64 (活病毒量为103.750/100 µL); 将病毒接种EPC细胞, 每24h取样用建立的mAb双夹心ELISA法检测, 在EPC细胞接种病毒72h后即可在细胞中检测到病毒。
2.5 mAb双夹心ELISA法的初步应用
对各地分离到的毒株的检测用建立的mAb双夹心ELISA法对9份来源于不同地区的IHNV毒株以及IHNV-UK进行检测(表5)。提示该方法的特异性能够覆盖分离到的各个IHNV毒株, 但是病毒量和OD值之间并无相关关系。编号为13071的样品OD平均值最高为0.527, 编号为12096的样品OD平均值最低为0.259。
表1 mAb双夹心ELISA法特异性检测结果
Tab. 1 The reaction of double antibodies sandwich ELISA against fish viruses and cell lines (±S, n=2)

表1 mAb双夹心ELISA法特异性检测结果
病毒及细胞系Fish viruses and cell linesA450检测结果Results 病毒 Fish viruses IHNV-UK0.275±0.016+ 病毒性出血败血症病毒(Viral Hemorrhagic Septicemia virus, VHSV)0.066±0.001– 鲤春血症病毒(Spring viraemia of carp virus, SVCV)0.069±0.000– 草鱼出血病病毒(Grass carp reovirus, GCRV)0.069±0.001– 传染性胰脏坏死病病毒(Infectious pancreatic necrosis virus, IPNV)0.068±0.001– 流行性造血器官坏死病病毒(Epizootic haematopoietic necrosis virus, EHNV)0.068±0.000– 细胞系 Cell lines 胖头鱥肌肉细胞系(Fathead monnow cell line, FHM)0.070±0.000– 虹鳟肝细胞系(Rainbow trout liver cell line, R1)0.068±0.001– 草鱼肾细胞系(Grass carp kidney cell line, CIK)0.072±0.004– 草鱼卵巢细胞系(Grass carp ovary cell line, CO)0.072±0.001– 蓝鳃太阳鱼细胞系(Bluegill fry cell line, BF-2)0.069±0.000– 虹鳟性腺细胞系(Rainbow trout gonad cell line, RTG-2)0.074±0.001– 鲤上皮瘤细胞系(Epithelioma papulosum cyprini cell line, EPC)0.070±0.003– 大鳞大麻哈鱼胚胎细胞系(Chinook salmon embryo cell line, CHSE)0.065±0.000– 阴性对照 Negative control0.069±0.002–
表2 纯化病毒的检测灵敏度
Tab. 2 The result of sensitivity test by purified IHNV (±S, n=2)
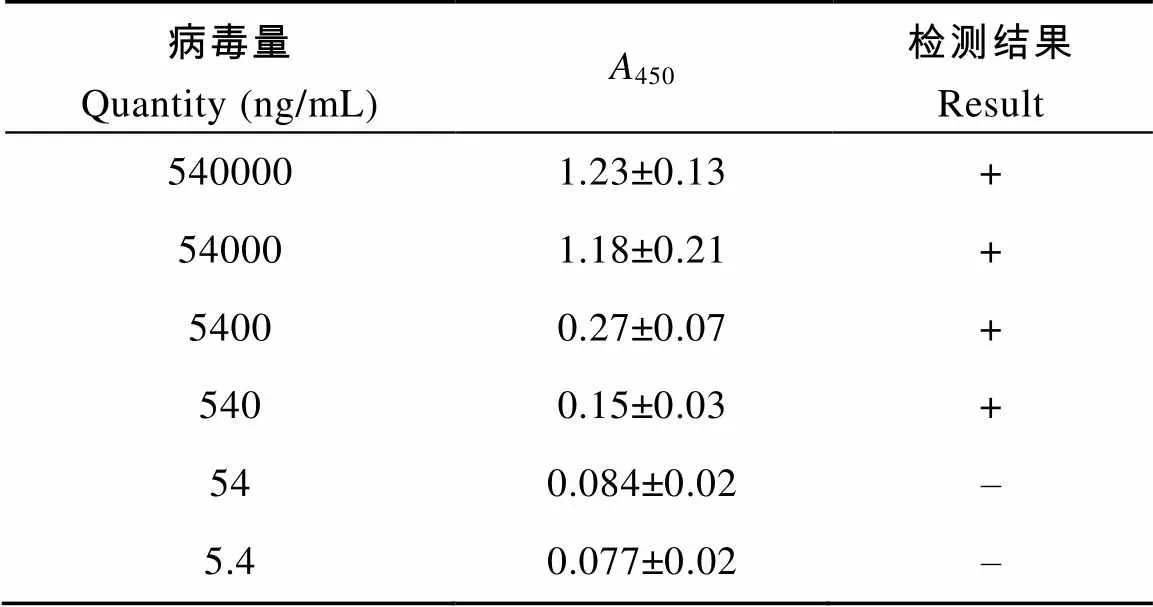
表2 纯化病毒的检测灵敏度
病毒量Quantity (ng/mL)A450检测结果 Result 5400001.23±0.13+ 540001.18±0.21+ 54000.27±0.07+ 5400.15±0.03+ 540.084±0.02– 5.40.077±0.02–
表3 病毒培养液的检测灵敏度
Tab. 3 The result of sensitivity test by cell cultured IHNV (±S, n=2)

表3 病毒培养液的检测灵敏度
稀释度DilutionA450检测结果Result 1︰40.213±0.008+ 1︰80.215±0.010+ 1︰160.169±0.001+ 1︰320.121±0.010+ 1︰640.092±0.009+ 1︰1280.080±0.006– 1︰2560.071±0.006–
表4 不同病毒分离时间的检测灵敏度
Tab. 4 The result of sensitivity test by cell cultured IHNV which was harvested at 24h intervals after infection (±S, n=2)

表4 不同病毒分离时间的检测灵敏度
培养时间Cultured time (h)A450检测结果Result 240.071±0.007– 480.087±0.003– 720.096±0.001+ 960.144±0.008+ 1200.362±0.054+ 1440.331±0.007+
对样品的检测对43份样品按OIE规定的方法, 取鱼的肝、脑、脾、肾混合制样, 用mAb双夹心ELISA法和病毒分离方法同时进行检测, 以进行比较。和黄金方法相比, ELISA方法在特异性上的符合率达到93.9% (31/33), 在灵敏度上的符合率达到80.0%(8/10); 建立mAb双夹心ELISA法与病毒分离方法检测结果的符合率为90.7% (39/43)。
3 讨论
IHNV作为制约鲑、鳟养殖业发展的重要病原, 其危害已引起了广泛的关注。由于病毒病尚无有效的治疗方法, 病原的早期、快速检测对疾病的控制至关重要。目前OIE推荐的诸多诊断方法[13]中, 病毒分离、中和试验等传统的病毒检测方法费时、费力; PCR、核酸探针等新型技术时效性较好, 但假阳性率较高。而ELISA检测方法具有快速、准确、高通量等特点, 是OIE和许多国外兽医机构认可的鱼类病毒病诊断鉴别方法, 在多个国家得到了普遍应用, 并且取得了良好效果[14—17]。国内由于受到抗体来源的限制, 免疫学技术方面的研究比较缺乏。国内学者先后表达出了IHNV的糖蛋白和核衣壳蛋白, 并制备了抗IHNV糖蛋白的多抗血清[12, 18, 19]。但是由于表达蛋白的免疫原性不稳定、弹状病毒之间抗原性比较相似等原因, 制备的抗体难以满足IHNV检测的特异性要求。本研究以差速离心纯化的全病毒作为抗原免疫小鼠, 成功制备了效价在1︰2.5×105以上, 能够特异性结合IHNV-UK核蛋白的mAb 1B10; 将其应用到ELISA检测中, 可与IHNV发生反应, 而不与SVCV、VHSV等5种病毒和8种鱼类细胞发生交叉反应。检测的特异性覆盖从北京、青海、甘肃等不同地区分离到的9个IHNV分离株。该抗体的制备, 为进一步研制传染性造血器官坏死病毒的快速、高通量检测及流行病学监测提供了检测试剂。
表5 mAb双夹心ELISA法对毒株检测结果
Tab. 5 The reaction of double antibodies sandwich ELISA against IHNV viruses isolated from Beijing Qinghai and Gansu (±S, n=2)

表5 mAb双夹心ELISA法对毒株检测结果
来源Source甘肃Gansu青海Qinghai北京Beijing英国参考株Reference virus of UK 编号Number120741207513066120961219112196121691307112171INHV-UK A4500.379± 0.0080.391± 0.000.510± 0.0280.259± 0.0060.360± 0.0160.449± 0.0080.437± 0.0030.527± 0.0110.328± 0.0160.335± 0.009 病毒量Quantity (TCID50/100 µL)105.17104. 5105.83104.83105.17105.5104.83105.5104.83104.5
利用mAb 1B10和多克隆羊抗血清建立了检测IHNV的双抗体夹心ELISA方法。通过对43份盲样进行检测, 并与黄金方法进行比较和质量评估, 证明本研究所建立的mAb双夹心ELISA诊断方法具有良好的特异性(特异性上的符合率93.9%)。但是几乎所有的检测方法, 在特异性与灵敏度之间都存在一定矛盾, 难以同时兼顾。在本项目建立的McAb双夹心ELISA诊断方法中, 灵敏度相对较低, 这可能与建立的McAb双夹心ELISA检测技术时的检测限有关。本项目建立的检测技术, 可检测到103.750/100 µL以上的病毒, 但是在病毒隐性感染或发病初期, 鱼体内的病毒可能达不到此数量, 导致诊断结果中假阴性的发生。为克服这一问题, 可以通过加大样品数量来弥补, 或者先在细胞中做短期扩增后再进行检测。实验室研究显示, 将样品接入细胞72h后, 再采用本方法检测, 特异性和灵敏度均可达到90%以上。本方法的建立能够满足传染性造血器官坏死病毒的大通量、快速检测需求, 为大规模筛查该病以及快速筛选带病鱼提供了技术依托。
[1] Xu L P, Wang X L, Yang L W,. Researd progress on the diagnosis, prevention and control of Infectious Hematopoietic Necrosis [J]., 2013, 40(3): 209—215 [徐立蒲, 王小亮, 杨丽文, 等. 传染性造血器官坏死病诊断及防控的研究进展. 中国畜牧兽医, 2013, 40(3): 209—215]
[2] Chen A P, Jiang Y L, Qian D,. Infectious Hematopoietic Necrosis [J]. China Fisheries, 2011, (2): 56—57 [陈爱平, 江育林, 钱冬, 等. 水生动物疫病病种介绍: 传染性造血器官坏死. 中国水产, 2011, (2): 56—57]
[3] Zhao Z Z, Niu Q Y. Isolation and preliminary study of a Rhabdovirus from Rainbow trout () in Benxi, China [J]., 1994, 18(4): 348—353 [赵志壮, 牛鲁祺. 中国本溪虹鳟一株弹状病毒的分离及初步研究. 水生生物学报, 1994, 18(4): 348—353]
[4] Bureau of Fisheries, Ministry of Agriculture. 2012 Aquatic Animal Health in China [M]. Beijing: China Agriculture Press. 2013, 24 [农业部渔业局. 2012年中国水生动物卫生状况报告.北京: 中国农业出版社. 2013, 24]
[5] Xu L M, Liu H B, Xu J,. Development of efficient RT-PCR assay foe detection of Infectious Hematopoietic Necrosis virus [J]., 2013, 37(6): 1164—1168 [徐黎明, 刘红柏, 徐进, 等. 传染性造血器官坏死病病毒高效RT-PCR检测方法的建立. 水生生物学报, 2013, 37(6): 1164—1168]
[6] Yue Z Q, Liu H, Liang C Z,. Real-time quantitative RT-PCR assay for detection of IHNV in fish [J]., 2008, 32(1): 91—95 [岳志芹, 刘荭, 梁成珠, 等.实时定量RT-PCR检测鱼类传染性造血器官坏死病毒方法的建立与应用. 水生生物学报, 2008, 32(1): 91—95]
[7] Hao G J, Shen J Y, Cao Z,. Preparation and characterization of the mAb against[J]., 2007, 2(9): 838—840 [郝贵杰, 沈锦玉, 曹铮, 等. 抗哈维氏弧菌单克隆抗体杂交瘤细胞系的建立及其特性鉴定. 细胞与分子免疫学杂志, 2007, 2(9): 838—840]
[8] Jing H L, Wang J B, Cao H,. Preparation and characterization of monoclonal antibodies against viral hemorrhagic septicemia virus [J]., 2013, 29(4): 400—402 [景宏丽, 王静波, 曹欢, 等. 病毒性出血败血症并毒单克隆抗体的制备及其特性分析. 细胞与分子免疫学杂志, 2013, 29(4): 400—402]
[9] Wang J Z, Fan M. The Handbook of Protein Methods [M]. Beijing: Science Press. 2002 [汪家政, 范明.蛋白质技术手册. 北京: 科学出版社. 2002]
[10] Yin Z, Liu J H. Animal Virology [M]. Beijing: Science Press. 1997 [殷震, 刘景华. 动物病毒学. 北京: 科学出版社. 1997]
[11] Ken W. Fish Viruses and Fish Viral Diseases [M]. Ithaca and London: Cornell University Press. 1988, 98
[12] Zhao Y X, Zhao L L, Liu W W,. Prokaryotic expression and antigenicity analysis of the nucleocapsid gene of infectious hematopoietic necrosis virus [J]., 2011, 41(5): 40—44 [赵永欣, 赵丽丽, 刘巍巍, 等. 传染性造血组织坏死病毒核衣壳蛋白的原核表达及抗原性分析. 淡水渔业, 2011, 41(5): 40—44]
[13] OIE. Manual of Diagnostic Tests for Aquatic Animals [M].The OIE Aquatic Animal Health Standards Commission. 2009
[14] Daniel J M, Pei W C, Terence M B. Diagnosis of infectious hematopoietic necrosis virus in Atlantic salmonby enzyme-linked immunosorbent assay [J]., 1992, 13: 147—150
[15] Jeanene M A, Aandra S R, Colleen P H,. Rapid fluorescent antibody tests for infectious hematopoietic necrosis virus (IHNV) utilizing monoclonal antibodies to the nucleoprotein and glycoprotein [J]., 1991, 3(2): 109—113
[16] Sandra S R, Jeanene A, Scott E,. Detection and characterization of rainbow trout antibody against infectious hematopoietic necrosis virus [J]., 1993, 15(2): 109—114
[17] Corbeil S, Lapatra S E, Anderson E D,. Evaluation of the protective immunogenicity of the N, P, M, NV and G proteins of infectious hematopoietic necrosis virus in rainbow troutusing DNA vaccines [J]., 1999, 39(1): 29—36
[18] Guo L L, Liu H B, Shi J,. Expression of full length glycoprotein gene of Infectious hematopoietic necrosis virus (IHNV) in[J]., 2009, 28(2): 210—213 [郭露玲, 刘海滨, 石剑, 等. 传染性造血组织坏死症病毒囊膜蛋白在原核细胞中的表达. 华中农业大学学报, 2009, 28(2): 210—213]
[19] Xu L M, Liu H B, Yin J S,. Prokaryotic expression and immunogenicity analysis of glycoprotein from infectious hematopoietic necrosis virus [J]., 2013, 2(5): 529—534 [徐黎明, 刘红柏, 尹家胜, 等. 传染性造血器官坏死病毒糖蛋白原核表达及免疫原性分析. 病毒学报, 2013, 2(5): 529—534]
PREPARATION OF MONOCLONAL ANTIBODIES AGAINST IHNV AND ITS PRELIMINARY APPLICATION
Cao Huan1, Jing Hong-li2, Wang Shu1, Wang Jing-bo1, WangXiao-liang1and Xu Li-pu1
(1. Beijing Fisheries Technical Extension Station, Beijing 100021, China; 2. Research Center of Aquatic Animal Diseases, Institute of Animal Quarantine, Chinese Academy of Inspection and Quarantine, Beijing 100029, China)
Infectious haematopoietic necrosis virus; Monoclonal antibody; Double antibodies sandwich ELISA
10.7541/2015.56
S941.4
A
1000-3207(2015)02-0426-05
2014-04-15;
2014-08-14
北京市科委项目(Z111100074311007); 北京市鲟鱼、鲑鳟鱼创新团队(SCGWZJ 20131104-3)资助
曹欢(1981—), 女, 黑龙江牡丹江人; 硕士; 主要从事水产动物病害防治的研究。E-mail: lsen1980@sina.com
徐立蒲(1972—), 男, 黑龙江人; 博士; 主要从事水产动物病害防治的研究。E-mail: bjybk@163.com
猜你喜欢
杂志排行
水生生物学报的其它文章
- 达氏鲟生长激素基因cDNA克隆、表达及免疫荧光定位研究
- 杂交鲟对六种蛋白原料的表观消化率
- SUPPRESSION OF LIGASE4 OR XRCC6 ACTIVITIES ENHANCES THE DNA HOMOLOGOUS RECOMBINATION EFFICIENCY IN ZEBRAFISH PRIMORDIAL GERM CELLS
- 大兴安岭硅藻的中国新记录属、种
- 鲢快速逃逸游泳行为研究
- EFFECT OF FIBROUS ROOT OF COPTIS CHINENSIS FRANCH AND BERBERINE ON THE NON-SPECIFIC IMMUNITY AND RESISTANCE AGAINST AEROMONAS HYDROPHILAINFECTION IN GRASS CARP (CTENOPHARYNGODON IDELLA)
