黑龙江烟区烟草马铃薯Y病毒株系的分子鉴定
2015-11-27万秀清赵淑娟李丽杰郭振楠
万秀清,乔 婵,赵淑娟,李 若,李丽杰,郭振楠
牡丹江烟草科学研究所,黑龙江省牡丹江市西地明街425号 157011
黑龙江烟区烟草马铃薯Y病毒株系的分子鉴定
万秀清,乔 婵*,赵淑娟,李 若,李丽杰,郭振楠
牡丹江烟草科学研究所,黑龙江省牡丹江市西地明街425号 157011
为明确黑龙江烟区烟草马铃薯Y病毒(Potato virus Y,PVY)株系种类及其分布状况,采用多重PCR技术及测序手段,对采集黑龙江省烟叶产区的107份疑似PVY样品进行了鉴定分析.结果表明:4个有代表性的PVY分离物HLJ-SH8、HLJ-SC2、HLJ-SC6和HLJ-MDJ4的基因组序列全长分别为9 698、9 702、9 702和9 698 bp,都包含一个由9 186 bp组成的开放读码框(ORF),编码一个由3 061个氨基酸组成的多聚蛋白.系统进化树分析结果表明这4个PVY分离物分别为PVYNTN、PVYN、PVYNW和PVYNTN-NW株系,其中PVYNTN-NW株系是侵染黑龙江烟草的优势株系.
黑龙江烟区;马铃薯Y病毒(PVY);株系鉴定;多重PCR;测序
烟草马铃薯Y病毒(Potato virus Y,PVY)是感染危害黑龙江省烟草的主要病毒之一,其寄主范围广,能侵染豆科、菊科等34属163种植物,马铃薯、辣椒、番茄和烟草等茄科作物是主要对象[1-4].目前在全国16个烟草种植省(区)均有PVY发生.随着烟草马铃薯Y病毒病的日趋严重,对马铃薯Y病毒病的发生规律及综合防治技术也进行了相关的研究,在国内多个烟草种植省(区)已有报道[5-11].而植物病毒存在不同株系,在相同的寄主植物上可引起不同的症状,通常依据病毒的生物学特性、寄主范围、血清学和核酸特异性等来划分株系.近年来,在欧洲、美洲等地区陆续发现了一系列具有高致病性的PVY新株系,主要包括PVYNTN、PVYNW、PVYN∶O和 PVYNA-NIN株系等[12].目前,中国农科院烟草研究所鉴定出山东烟区主要有PVYO和PVYN两个株系[13];吴元华等[14]鉴定出东北烟区主要有 PVYO、PVYVN、PVYC和 PVYNS4 个株系;国内已被广泛认同的PVY株系种类有PVYO、PVYN和PVYC3种[15];黑龙江烟区烟草尚未见有关PVY株系鉴定的系统报道.在国内已有的马铃薯Y病毒的株系鉴定中多以P1和CP基因序列为主,但利用基因组序列全长进行株系划分的报道并不多见.虽然P1基因是整个基因组的易变异基因,CP基因的变异也对株系划分有一定的意义,但马铃薯Y病毒的基因变异是由多个基因共同作用引起的,仅依据P1基因与CP基因对PVY进行株系鉴定存在一定的局限性.为此,采用分子生物学手段及测序技术,对采集的黑龙江烟区烟草PVY样品进行分类、测序及分析,旨在合理进行株系划分,并进一步设计不同株系特异PCR鉴定引物,对感染黑龙江烟草的PVY株系种类、发生发展情况及其区域分布进行长期监控,为烟叶生产中PVY病毒的有效防治提供技术支撑.
1 材料与方法
1.1 仪器与试剂
植物病毒总RNA提取试剂盒(德国QIAGEN公司);Ex-taq酶,RNA反转录试剂盒(日本TaKaRa公司);DNA纯化回收试剂盒E.Z.N.A.®Gel Extraction Kit(美国 OMEGA公司);低熔点琼脂糖(美国Sigma公司);PVY免疫试纸条(美国Agida公司);其他常用试剂均为国产或进口分析纯.
1.2 试验方法
1.2.1 PVY病毒样品的采集
于2010年和2011年,在黑龙江烟区的绥化、肇州、双城、宾县及牡丹江采集各种烟草PVY疑似症状的样品共计107份,其中牡丹江16份,绥化19份,宾县24份,双城16份,肇州32份.采集样品时手戴一次性PE手套,避免不同样品间相互污染.对采集的样品进行照相并标注,注明样品采集时间、样品编号、采集地点和典型症状等.
1.2.2 PVY病毒样品免疫试纸检测
每个样品使用一个研磨袋,并进行标记.首先用剪刀剪开研磨袋的顶端,注意不要溅出缓冲液.用酒精擦拭消毒后的剪刀剪下有PVY典型症状的烟草叶片并称取约0.15 g,放入含有3 mL SEB缓冲液的研磨袋中.植物样本与缓冲液比例为1∶20(g∶mL);把叶片置于研磨袋的研磨线之间,用笔或其他钝物挤压烟草叶片,使之完全破碎,再将样品混合均匀;将标有quot;samplequot;一头的试纸条的端部浸入到烟草PVY提取缓冲液中,检测过程中试纸条端部不能离开提取液.(试纸条不使用时需储存在4℃冰箱里,使用时需将其恢复到室温).最长反应时间为30 min.当检测线和控制线均显示为红色时,表明为PVY阳性;只有控制线出现而检测线未出现时为PVY阴性;如果控制线不显示红色,表明试验结果无效或是试纸条失效.经PVY免疫试纸条检测呈阳性结果的烟草样品置于-60℃低温冰箱中保存,备用.
1.2.3 分子生物学鉴定
1.2.3.1 烟草总RNA的提取及cDNA合成
用RNeasy Plant Mini(50)提取试剂盒提取检测结果为PVY阳性的病毒样品的总RNA.以Oligo dT-Adaptor Primer为引物,利用 RNA PCR Kit(AMV)Ver.3.0试剂盒进行反转录合成cDNA,具体方法参照相关试剂盒使用说明书.
1.2.3.2 PVY株系多重RT-PCR检测
以合成的cDNA为模板,以健康未染病的烟草叶片为阴性对照,多重PCR扩增引物参照Ali M C[16]设计合成,见表1.多重RT-PCR反应体系:总体积为25 μL,其中 2.5 μL 的 10XExTaq buffer,0.12 μL的TaKaRa Ex Taq酶,19.38 μL无菌水,2 μL引物混合物,1 μL cDNA模板.降落式PCR扩增循环程序:94℃预变性2 min;94℃变性30 s,64℃复性30 s,72℃延伸90 s,10次循环;94℃变性30 s,62℃复性30 s,72℃延伸90 s,10次循环;94℃变性30 s,60℃复性30 s,72℃延伸90 s,10次循环;最后72℃延伸5 min.取3 μLPCR扩增产物进行2%的琼脂糖凝胶电泳检测.
1.2.3.3 PVY基因组序列全长扩增及分析
通过PVY株系多重RT-PCR检测,根据各样品的PCR扩增结果,对样品进行初步分类,选取有代表性的4个PVY株系样品进行PVY全序列测定.根据PVY各株系比对结果,在保守区域设计合成3对PCR扩增引物,3对引物扩增片段全覆盖PVY基因组,序列见表2.PCR反应体系:5XPCR buffer 5 μL,无菌水 16.5 μL,Ex-taq 酶 0.125 μL,引物各0.25 μL,cDNA 3 µL,总体积为25 μL;PCR扩增条件:94℃预变性2 min;94℃变性40 s,50.7℃复性40 s,72℃延伸2 min,72℃延伸7 min,35个循环.PCR反应完成后进行1%的琼脂糖凝胶电泳检测并回收目标条带,然后直接对回收纯化的特异PCR扩增条带进行测序.测序后对3对PCR扩增的序列进行拼接.

表1 多重RT-PCR检测引物

表2 PVY全长扩增引物
1.2.3.4 PVY序列分析
在GenBank中下载已经登录的PVY全基因序列用于PVY病毒序列同源性分析及构建系统进化树.序列比对采用MEGA5.0软件中的ClustaW,选择MEGA5.05软件并采用邻接法(Neighbor-joining,NJ)对本实验所得到的4个PVY基因组全长序列和GenBank上登录的PVY全长序列构建系统进化树.本实验中分离的4个PVY基因组全长间的核苷酸序列与氨基酸序列的一致率用Align plus 4软件进行比对.
1.2.4 黑龙江省烟草PVY株系区域分布
根据多重RT-PCR检测结果,统计分析2010年和2011年采集的烟草PVY各株系在黑龙江烟草种植区的分布情况.
2 结果与分析
2.1 马铃薯Y病毒样品症状及免疫试纸检测分析
采集的107份烟草病毒样品典型症状如图1,主要表现症状为叶脉坏死、褪绿斑驳、点刻褪绿条带及明脉等.免疫试纸检测结果表明:PVY阳性结果(检测线出现清晰红色条带)为97个,阴性结果(检测线未出现条带)为10个,阳性检出率为90.65%.典型免疫试纸条检测阳性结果如图2.

图1PVY样品症状

图2 PVY免疫试纸检测结果
2.2 分子生物学检测分析
2.2.1 PVY分离物总RNA的提取效果
琼脂糖凝胶电泳结果见图3.PVY分离物总RNA经1%琼脂糖凝胶分离,电泳条带从上至下分别为28S、16S和5S,其中28S rRNA条带较清晰,表明所提取的RNA质量高、完整性较好,可以用来进行反转录及反转录后的PCR扩增.

图3PVY总RNA凝胶电泳图
2.2.2 PVY多重RT-PCR检测结果
图4结果表明:97个烟草PVY阳性样品的多重RT-PCR产物经1%琼脂糖凝胶电泳后,除5个混合侵染样品外,其余91个样品显示4种带型,分别为1 307+633 bp、1 307+633+441 bp、1 076+633+441 bp和853+441 bp,参照Ali M C[16]的方法,对应的株系类型分别为PVYN、PVYNTN、PVYNTN-NW(SYR-Ⅰ)和 PVYNW,其中 PVYNTN、PVYNTN-NW(SYR-I)和PVYNW为重组株系.

图4 多重RT-PCR检测结果
2.2.3 PVY全序列扩增结果
1%的琼脂糖凝胶电泳结果(图5)显示出3条不同的电泳条带,第一片段的条带大小约为3 800 bp,第二片段大小约为4 100 bp,第三片段大小约为3 100 bp,条带单一,符合预期扩增片段大小.对每个片段的PCR扩增产均取50 μL并经琼脂糖凝胶电泳后回收测序.
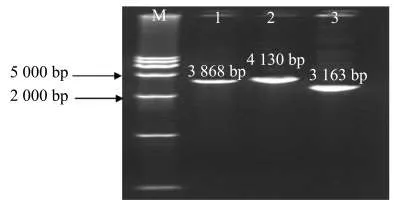
图5 PVY全序列的扩增电泳图
2.2.4 PVY分离物基因组全序列分析
2.2.4.1 PVY分离物的基因组结构
将回收的3个DNA片段分别测序,测序后用DNAMan拼接得到PVY全基因组序列.4个PVY分离物HLJ-SH8、HLJ-SC2、HLJ-SC6和HLJ-MDJ4的基因组序列全长分别为9 698 bp、9 702 bp、9 702 bp和9 698 bp.4个分离物的基因组序列都仅包含一个由9 186 bp组成的开放读码框(ORF),编码一个由3 061个氨基酸组成的多聚蛋白.HLJ-SH8、HLJ-SC6和HLJ-MDJ4的3'-UTR均由331个碱基组成,HLJ-SC2的3'-UTR由330个碱基组成.各个PVY分离物全序列碱基含量见表3.
2.2.4.2 PVY分离物的同源性分析
对4个PVY分离物核苷酸及氨基酸进行一致性比对,以HLJ-SH8为参照,结果见表4.从表4中可以看出,所分离的4个PVY分离物在核苷酸水平和氨基酸水平都有一定的差异性.
4个PVY分离物序列全长与GenBank中核酸数据进行Blast比对分析,结果表明:HLJ-SH8与PVYNW株系相似性最高,为99%;HLJ-SC2与PVYN株系的分离物NE-11相似性最高,为99%;HLJ-SC6与PVYNTN株系的分离物相似性最高,为99%;HLJ-MDJ4与PVYNTN-NW株系分离物相似性最高,为99%.可以初步判定4个PVY分离物HLJ-SH8、HLJ-SC2、HLJ-SC6和HLJ-MDJ4分别属于PVYNW株系、PVYN株系、PVYNTN株系和PVYNTN-NW株系.
2.2.4.3 系统进化分析
对从GenBank下载的55个PVY分离物的基因组全序列及本研究中克隆的4个PVY分离物的全基因组序列进行比对分析,构建系统进化树如图6.图6结果表明,PVY分离物可分为8个亚组:PVYN,非重组的PVYNTN和PVYEu-N,重组的PVYNTN、PVYN∶O、PVYNW、PVYNTN-NW、PVYO、PVYC、PVYNP.PVY分离物HLJ-SH8与09-3a亲缘性最高,同源性为99%,共同聚类到PVYNW组,说明此分离物属于PVYNW亚组.PVY分离物HLJ-SC2与NE-11亲缘性最高,同源性为99%,共同聚类到PVYN株
系组,说明此分离物属于PVYN组.PVY分离物HLJ-SC6与HN1亲缘性最高,同源性为99%,共同聚类到PVYNTN组,说明此分离物属于PVYNTN亚组.PVY分离物HLJ-MDJ4与HN2亲缘性最高,同源性为99%,与PVYNTN-NW株系分离物聚集到一起,说明此分离物属于PVYNTN-NW组.HLJ-SC6与湖南PVY分离物HN1同源性很高,在NCBI上Blast比对结果为99%.HLJ-MDJ4与湖南PVY分离物HN2、贵州分离物Guiding-3同源性很高,在NCBI上Blast比对结果均为99%,而与其他已知的PVY分离物全序列比对结果为98%以下,这说明本试验中分离鉴定的PVYNTN与PVYNTN-NW很有可能起源于我国,至于这两个PVY株系与国外PVY株系是否有地理性的差异,还需要获得更多的本地PVY全基因组序列并进行进一步验证.系统进化树结果表明,黑龙江省烟草PVY可划分为PVYNW、PVYN、PVYNTN和PVYNTN-NW4个株系,与多重RT-PCR鉴定结果一致.

表3 PVY分离物的基因组结构
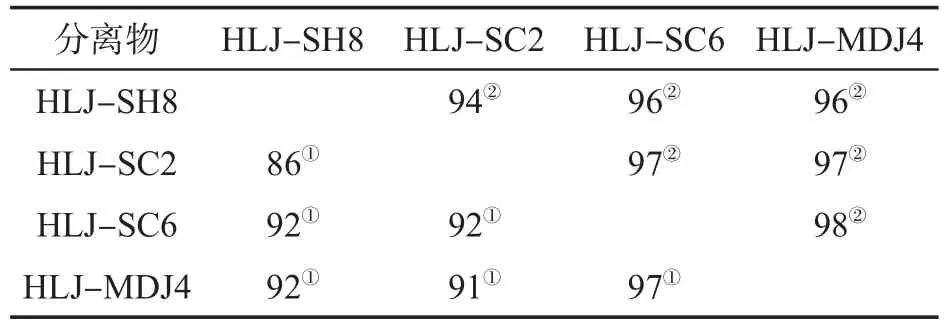
表4 4个PVY分离物间的核苷酸与氨基酸同源性比对 (%)

图6 4个PVY株系分离物进化树分析(PVY分离物/基因登录号)
2.3 黑龙江烟草马铃薯Y病毒的区域分布
根据多重RT-PCR结果对在黑龙江省采集的91个PVY分离物进行区域分布及各株系发生情况统计,结果见图7.
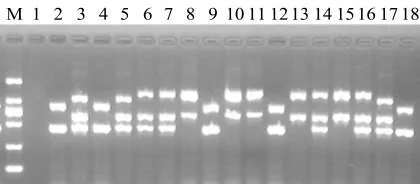
图7 多重RT-PCR电泳图
目前,除PVYO与PVYC株系,PVY其他株系在黑龙江省各个烟草种植区都有分布.其中PVYN的比例为18.75%~36.36%,PVYNTN的比例为3.13%~26.32%,PVYNW的比例为12.5%~46.88%,PVYNTN-NW的比例为21.05%~60.00%.具体株系分布情况见表5.
牡丹江烟区以PVYNTN-NW为主,绥化4个株系均匀分布,宾县以PVYN和PVYNW为主,双城以PVYN与PVYNTN-NW为主,肇州以PVYNW与PVYNTN-NW为主.总体来看PVYNTN-NW比例最高,分布最广,是感染黑龙江烟草马铃薯Y病毒的优势株系,PVYNTN的比例最低.由此表明PVY各重组株系已经在调查的黑龙江烟草种植区中大范围流行.
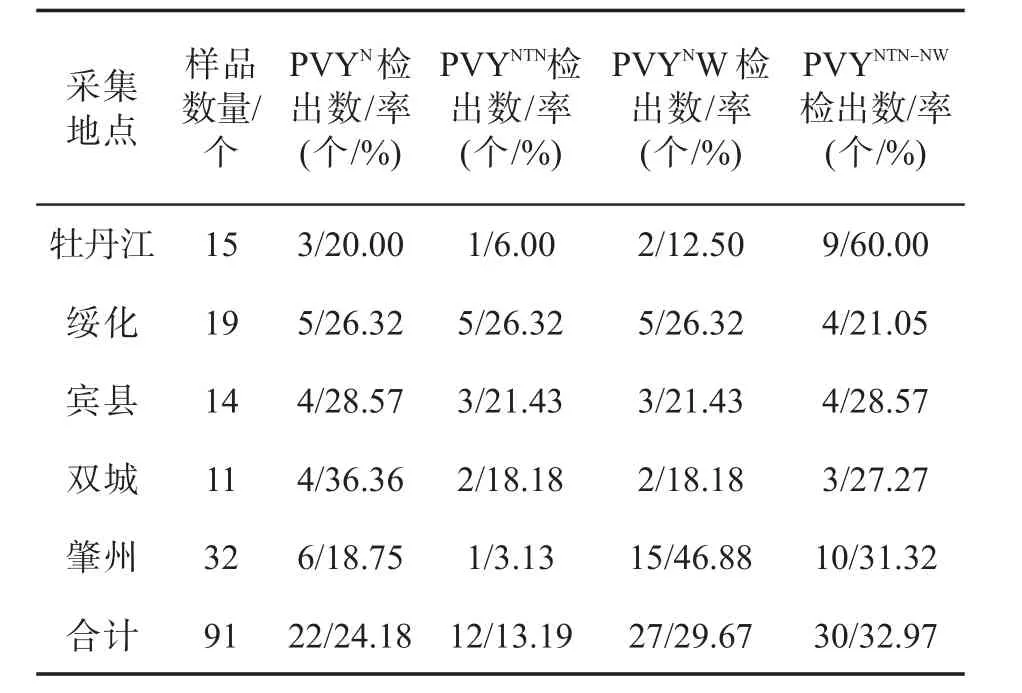
表5 黑龙江省烟草PVY株系区域分布及发生率
3 结论与讨论
黑龙江烟草种植区分离鉴定的4个分离物PVYN、PVYNTN、PVYNW和PVYNTN-NW全部为PVY的重组株系,说明马铃薯Y病毒的重组株系已经在黑龙江烟区大范围流行.值得注意的是,PVYNTN-NW株系已经成为该烟区的优势株系,这一株系是2010年叙利亚报道的新的马铃薯Y病毒株系类型,其基因组全长序列与PVYNTN高度相似.此外,在黑龙江烟草种植区进行的PVY株系鉴定与调查均没有发现PVYO与PVYC株系,也没有发现PVYNTN-NW中的SYR-Ⅱ和SYR-Ⅲ型,有待于扩大样品的采集地点及寄主范围,进一步对烟草PVY病毒株系种类进行长期检测及调查.另外,还需分别对分离的几个PVY株系材料进行接种PVY抗感品种试验,以获得不同株系在不同抗感材料上的症状差异,并将分子鉴定与生物学症状联系起来,进一步明确PVY致病型与基因型的关系.
[1]R赫尔.马修斯植物病毒学[M].北京:科学出版社,2007:39-40.
[2]Neson M R,Wheeler R E.Biological characterisation and separation of potyviruses that infect peppers[J].Phytopthology,1978,68:979-984.
[3]Sievert R C.Effect of potato virus Y on cultivars and hybrids of Burley tobacco[J].Phytopathology,1978,68:974-978.
[4]Thomas J C.Recent.Studies of virus diseases of tomato in Queensland,Australia[J].Phytoparasitica,1985,13:271-276.
[5] 张俊华,张明厚.黑龙江省烟草病毒病发生流行特征分析[J].东北农业大学学报,2002,33(3):209-212.
[6] 陈德鑫,王凤龙.山东烟草病毒病发生特点及防治对策[J].中国烟草科学,2007,28(1):25-28.
[7] 李淑君,王海涛,陈玉国,等.2000年烟草病毒病大发生概况与原因分析[J].烟草科技,2001(1):44-46.
[8] 李向东,李义强,高宝昌,等.河南省郊县襄城两地烟草病毒病大发生的原因及对策[J].中国烟草学报,2001,7(3):23-26.
[9] 钱玉梅,王凤龙,王劲波,等.山东省烟草病毒病种群发生动态及防治对策[J].烟草科技,2001(2):43-46.
[10]张秀丽.烟草马铃薯Y病毒综合防治技术[J].黑龙江农业科学,2008(3):151.
[11]彭曙光.我国烟草病毒病的发生及综合防治研究进展[J].江西农业学报,2011,23(1):115-117.
[12]杨庆东,吴兴泉,陈士华,等.PVY株系间的分子变异及分子鉴定方法[J].中国马铃薯,2011,25(3):166-169.
[13]王劲波,王凤龙,钱玉梅,等.山东烟区主要病毒的株系鉴定[J].中国烟草学报,1998,4(1):24-32.
[14]吴元华,贝纳新,韦石泉,等.辽宁烟区新分离到烟草坏死病毒及其生物学性状的初步研究[J].中国烟草科学,1992(3):1-5.
[15]陈士华,时妍,吴兴泉.马铃薯Y病毒株系分化研究进展[J].河南农业科学,2011,40(10):10-12.
[16]AliM C,MaokaT,NatsuakiK T,et al.The simultaneous differentiation of potato virus Y strains including the newly described strain PVYNTN-NWby multiplex PCR assay[J].JournalofVirological Methods,2010,165:15-20.
责任编辑 董志坚
Molecular Identification of TobaccoPotato Virus YStrains in Heilongjiang Tobacco Planting Areas
WAN Xiuqing,QIAO Chan*,ZHAO Shujuan,LI Ruo,LI Lijie,and GUO Zhennan
Mudanjiang Tobacco Research Institute,Mudanjiang 157011,Heilongjiang,China
To clarify the kinds and distribution states of tobacco Potato virus Y (PVY)strains in Heilongjiang tobacco planting areas,107 suspected PVY isolates collected from Heilongjiang tobacco planting areas were identified with multiplex polymerase chain reaction(Multiplex-PCR)and sequencing techniques.The results indicated that the full length of genomes in four representative isolates(HLJ-SH8,HLJ-SC2,HLJ-SC6 and HLJ-MDJ4)were 9 698,9 702,9 702 and 9 698 bp,respectively.All of the four isolates contained an open reading frame(ORF)of 9 186 bp in length and encoded a polyprotein of 3 061 amino acids.Phylogenetic analysis indicated that the four isolates were PVYNTN,PVYN,PVYNWand PVYNTN-NWstrains,respectively;among which,PVYNTN-NWstrain was the dominant strain in Heilongjiang tobacco planting areas.
Heilongjiang tobacco planting area;Potato virus Y;Strain identification;Multiplex-PCR;Sequencing
S432.41
A
1002-0861(2015)10-0013-07
10.16135/j.issn1002-0861.20151002
2014-11-28
2015-06-19
黑龙江省烟草专卖局资助项目quot;烟草PVY抗性相关基因功能研究quot;(HN201203).
万秀清(1972-),硕士,高级农艺师,主要从事烟草分子生物学研究.E-mail:wanxiuqing@aliyun.com.cn;*
乔婵,E-mail:qiaochan_12@163.com
万秀清,乔婵,赵淑娟,等.黑龙江烟区烟草马铃薯Y病毒株系的分子鉴定[J].烟草科技,2015,48(10):13-18,25.WAN Xiuqing,QIAO Chan,ZHAO Shujuan,et al.Molecular identification of tobacco potato virus Y strains in Heilongjiang tobacco planting areas[J].Tobacco Scienceamp;Technology,2015,48(10):13-18,25.
