上皮间充质转化对肺鳞状细胞癌侵袭和迁移能力的影响*
2015-11-23郑燕君孙保存赵秀兰郑旭李岩磊邱志强古强董学易张艳辉
郑燕君孙保存③赵秀兰③郑旭李岩磊邱志强古强③董学易③张艳辉
·基础研究·
上皮间充质转化对肺鳞状细胞癌侵袭和迁移能力的影响*
郑燕君①孙保存①②③赵秀兰①③郑旭①李岩磊①邱志强②古强①③董学易①③张艳辉②
目的:研究肺鳞状细胞癌(lung squamous cell carcinoma,LSCC)上皮间充质转化(epithelial-to-mesenchymal transition,EMT)的临床意义,并阐述EMT对肺鳞癌侵袭转移能力的影响。方法:对79例肺鳞癌组织切片进行E-cadherin、Vimentin及TGF-β1的免疫组织化学染色,分析其临床意义。将肺鳞癌细胞系SK-MES-1置于含有不同浓度转化生长因子-β1(transforming growth factor,TGF-β1)的培养基中,分别诱导培养5、10 d后,利用Western blot、RT-PCR检测E-cadherin、Vimentin的表达变化,以划痕、侵袭实验来判断不同浓度、诱导时间对SK-MES-1细胞功能的影响。结果:肺鳞癌发生淋巴转移病例中E-cadherin表达较未发生淋巴转移者低,而Vimentin表达则高于未发生淋巴转移的病例,差异具有统计学意义(P<0.05)。TGF-β1阳性表达与淋巴结转移相关,差异具有统计学意义(P<0.05)。Western blot和RT-PCR显示10 ng/mL TGF-β1诱导培养的SK-MES-1细胞中,Vimentin表达增强明显,E-cadherin表达减弱。细胞划痕和侵袭实验结果表明SK-MES-1经诱导后,迁移和体外侵袭能力增强。结论:肺鳞癌的淋巴转移与上皮间充质转化有关,TGF-β1可诱导肺鳞癌细胞发生EMT,增强其侵袭和迁移的能力。
上皮间充质转化 肺鳞状细胞癌 TGF-β1 侵袭 迁移
肺癌是人类发病率和死亡率最高的恶性肿瘤之一,临床上约80%以上的肺癌患者死于肿瘤的侵袭与转移。因此,研究肺癌侵袭转移中相关基因的表达对判断预后及指导临床治疗具有重要意义。研究发现上皮细胞间充质转化(EMT)参与多种肿瘤的浸润转移,是肿瘤侵袭转移的一个重要的分子机制[1]。本研究对肺鳞癌组织的病理切片进行免疫组织化学方法检测E-cadherin、Vimentin、TGF-β1的表达并分析其临床意义,并利用TGF-β1因子诱导肺鳞癌细胞系,观察其E-cadherin、Vimentin的变化,探讨上皮间充质转化在肺鳞状细胞癌发生侵袭、转移的影响。
1 材料与方法
1.1材料
1.1.1一般资料收集天津医科大学肿瘤医院1996年1月至2003年2月手术切除且临床资料完整的肺鳞状细胞癌标本79例,其中男性61例,女性18例;年龄35~74岁,平均年龄(60.46±9.08)岁。随访时间截至2011年12月,术后生存时间为9 d~158个月,中位生存时间为26个月。根据WHO国际癌症TNM分期标准(第6版):Ⅰ期29例,Ⅱ期33例,Ⅲ期17例,Ⅳ期0例。以上结果均经两位有丰富经验的病理医师阅片验证。本研究获患者知情同意并获天津医科大学肿瘤医院伦理委员会批准。
1.1.2主要试剂兔抗人多克隆抗体E-cadherin(1:100稀释)购于北京中杉公司;兔抗人多克隆抗体Vimentin(1:400稀释)购自美国Epitmics公司;兔抗人多克隆抗体TGF-β1(1:50稀释)购于北京中杉公司;肺鳞癌细胞株SK-MES-1购自中国医学科学院基础医学研究所细胞中心;MEM培养基购自天津BIOROC公司;胎牛血清购自美国Hyclone公司;转化生长因子-β1(transforming growth factor-β1,TGF-β1)购自美国Peprotech公司;β-actin购自美国SantaCruz公司;Matrigel基质购自美国BD公司;Transwell侵袭小室购于美国Corning公司,PCR引物购自中国广州复能基因公司,RNA提取试剂Trizol、Reverse Transcription System反转录试剂、PCR反应Taq酶试剂盒,均购于北京Tiangen公司。
1.2方法
1.2.1免疫组织化学染色步骤免疫组织化学染色采用链霉素抗生物素蛋白-过氧化物酶(SP)法,5 μm连续切片常规脱蜡水化;3%H2O2灭活;微波热修复;正常血清室温下封闭,一抗4℃冰箱过夜;次日滴加二抗,室温反应1 h;DAB显色,苏木素浅染细胞核;脱水透明,中性树胶封片。
1.2.2免疫组织化学染色结果判定采用Mattern积分法评定染色结果。每例标本随机选择10个有代表性的高倍镜视野,分别记数100个肿瘤细胞,取其平均值作为阳性细胞百分率。规定阳性细胞百分率<5%为0分,5%~25%为1分,26%~50%为2分,>50%为3分。染色强度中基本不着色、浅黄、深黄和棕色分别为0、1、2、3分。染色指数为阳性细胞百分率与染色强度之和,最小值为0,最大值为6。表达指数>3为阳性;≤3则为阴性。
1.2.3细胞培养SK-MES-1肺鳞癌细胞系在含10%FBS、100 U/mL青霉素、100 U/mL链霉素的MEM培养液中,放入37℃、5%CO2孵化箱中孵育,待细胞融合约90%时,传代以保持细胞的活力。
1.2.4TGF-β1诱导培养及细胞分组取生长旺盛的SK-MES-1细胞株,0.25%胰酶消化、离心后加入培养液(90%MEM+10%FBS、100 U/mL青霉素、100 U/mL链霉素),并将该细胞系分为5组进行实验:1)MEM完全培养基中加5 ng/mL TGF-β1,培养5 d;2)MEM完全培养基中加10 ng/mL TGF-β1,培养5 d;3)MEM完全培养基中加5 ng/mL TGF-β1,培养10 d;4)MEM完全培养基中加10 ng/mL TGF-β1,培养10 d;5)对照组:MEM完全培养基。置于37℃、5%CO2培养箱中孵育,每天观察其形态变化。
1.2.5Western blot检测使用细胞裂解液裂解,分别以5 ng/mL和10 ng/mL TGF-β1诱导5 d和10 d的肺鳞癌细胞,提取其总蛋白,在10%聚丙烯酰胺凝胶中电泳。将蛋白转移至PVDF膜上,5%脱脂奶粉封闭后,分别加入E-cadherin(1:100)、Vimentin(1:500)、β-actin(1:2 000)一抗,4℃过夜。第2天取出膜,TBST漂洗后,加入山羊抗兔IgG抗体反应,室温孵育2 h,TBST漂洗。化学发光法显影,于暗室曝光。
1.2.6RT-PCR检测按照Trizol提取试剂盒,对每组细胞分别提取总RNA,经分光光度计定量后,取2 μg总RNA逆转录成cDNA后进行PCR反应。将产物进行1%琼脂糖凝胶电泳,凝胶成像系统扫描结果,用Photoshop软件进行条带灰度分析,分别计算与内参的灰度值比。人E-cadherin的引物序列为F:5'-G TCACTGACACCAACGATAATCCT-3',R:5'-GTCAC TGACACCAACGATAATCCT-3';Vimentin的引物序列为F:5'-TGGCACGTCTTGACCTTGAA-3',R:5'-G GTCATCGTGATGCTGAGAA-3';内参GAPDH的引物序列为F:5'-CCTGGCCAAGGTCATCCATGAC-3',R:5'-TGTCATACCAGGAAATGAGCTTG-3'。
1.2.7细胞划痕实验以合适的密度将细胞接种于6孔板,于37℃孵箱中培养;待培养细胞生长至80%融合度时,用100 μL移液枪头在细胞表面造成划痕,并在倒置显微镜下观察,拍照记录划痕间初始距离(0 h);在24、48 h后,40倍镜下拍照记录划痕间的距
离,计算细胞的相对迁移率。实验重复3次。
1.2.8侵袭实验冰上操作,在Transwell小室滤膜内表面涂以无血清MEM培养液稀释的Matrigel胶35 μL(0.25 μg/μL),37℃孵育1 h使Matrigel胶在微孔滤膜上重组成为基底膜结构后备用;在24孔板内加入含0.1%胎牛血清的MEM培养液500 μL/孔;用含0.1%胎牛血清的MEM无血清培养液调整各组细胞浓度为2×106/mL,在小室内加入200 μL细胞悬液后,将小室浸入24孔板的条件培养基中,37℃、5%CO2孵箱内孵育48 h;将Transwell小室取出,用4%的冷甲醇固定3~5 min;结晶紫染色5 min,水洗;用棉签拭去微孔滤膜上的Matrigel胶和未穿过膜的细胞;于200倍相差显微镜下,应用ACT-2U软件(Nikon Corporation)捕捉图像并计数滤膜上下左右中5个不同视野下穿过膜的细胞数,计算均值。每种细胞平行设2张滤膜,实验重复3次。
1.3统计学方法
应用SPSS 17.0软件进行分析。计量资料以x±s表示。P<0.05为差异具有统计学意义。
2 结果
2.1肺鳞状细胞癌中E-cadherin、Vimentin以及TGF-β1的表达与淋巴结转移的关系
在79例的肺鳞癌病例中,E-cadherin的阳性表达为59例(74.7%),Vimentin的阳性表达为16例(20.3%)(图1A,1B)。E-cadherin及Vimentin的表达均与年龄、肿瘤大小无关(P>0.05),但与淋巴结转移有关(表1)。79例肺鳞癌病例中发现17例TGF-β1表达呈阳性(图1C),并与淋巴结转移相关,差异具有统计学意义(表1)。在后续实验中,利用TGF-β1因子在体外进行肺鳞癌细胞系诱导实验。
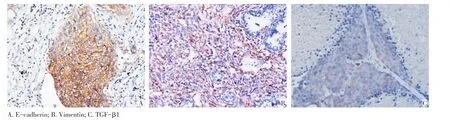
图1 免疫组织化学染色检测肺鳞癌中E-cadherin、Vimentin和TGF-β1的表达(×200)Figure 1Immunohistochemical staining of E-cadherin,Vimentin and TGF-β1 in lung squamous cell carcinoma(×200)

表1 E-cadherin、Vimentin、TGF-β1在79例肺鳞癌的表达与肿瘤临床特征的关系例Table 1Relationship between the expression levels of E-cadherin,Vimentin,and TGF-β1 in 79 LSCC patients and clinical features of the tumor
2.2TGF-β1诱导肺鳞癌细胞后E-cadherin、Vimentin的表达情况
Western blot结果显示,在TGF-β1条件培养基(浓度10 ng/mL)诱导10 d后的SK-MES-1细胞中Vimentin表达明显增强,而E-cadherin表达减弱(图2),差异具有统计学意义(P<0.05)。同样利用RT-PCR检测诱导后的SK-MES-1细胞,结果显示经不同浓度、天数诱导后,E-cadherin的表达受到了抑制,Vimentin得到了增强(图3),差异具有统计学意义(P<0.05)。

图2 Western blot检测SK-MES-1经TGF-β1诱导后E-cadherin、Vimentin的表达水平Figure2E-cadherin and Vimentin expression levels in SK-MES-1 cells after TGF-β1 induction detected via Western blot

图3 RT-PCR检测SK-MES-1经TGF-β1诱导后E-cadherin、Vimentin的表达水平Figure 3E-cadherin and Vimentin expression levels in SK-MES-1 cells after TGF-β1 induction detected via reverse transcription-polymerase chain reaction
2.3细胞划痕实验
采用经典的细胞划痕实验来评价TGF-β1诱导后肺鳞癌细胞系SK-MES-1的迁移能力。结果表明肺鳞癌细胞系经细胞因子诱导后,其迁移能力明显增强,其中5 ng/mL和10 ng/mL TGF-β1诱导10 d组的肺鳞癌细胞在48 h划痕完全愈合。两组划痕愈合速度均明显高于对照组(图4),差异具有统计学意义(P<0.05)。
2.4Transwell体外侵袭实验
肿瘤细胞侵袭基底膜是肿瘤转移过程中的重要环节,Matrigel胶铺在孔径为8.0 μm的多聚碳酸脂膜上,能在培养基中重组形成与天然基底膜极为相似的膜结构。具有侵袭能力的细胞在趋化剂的诱导下可穿过滤膜。将穿过滤膜的细胞数进行统计可检测肿瘤细胞的侵袭能力。将小室浸入24孔板的条件培养基中,37℃、5%CO2孵育48 h后,与对照组相比,经过诱导的肺鳞癌细胞侵袭至滤膜下表面的细胞数增加,其中5 ng/mL和10 ng/mL TGF-β1诱导10 d肺鳞癌SK-MES-1细胞的体外侵袭能力明显增强(图5),约是5ng/mL诱导5d组的3倍,是对照组的5倍(P<0.01)。

图4 SK-MES-1细胞经TGF-β1诱导5 d、10 d后,划痕实验测定细胞迁移能力及细胞迁移速度。实验组与对照组相比较,具有统计学意义(P<0.05)Figure 4After 5 and 10 days of culture by TGF-β1 induction,the migration and invasive abilities of SK-MES-1 cells were detected by wound scratch test.Significant differences were found between the experimental and control groups(P<0.05)
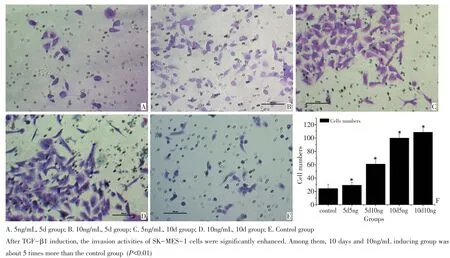
图5 SK-MES-1细胞经TGF-β1诱导5 d、10 d后的Transwell体外侵袭实验Figure 5Invasion assay,with SK-MES-1 cells at 5 or 10 days after TGF-β1 induction
3 讨论
上皮间充质转化(epithelia-mesenchymal transition,EMT)为Creighton等[2]于1982年提出,是指在某些生理、病理及环境等因素作用下,上皮细胞失去细胞极性及细胞间连接而转变为具有间质细胞形态和特性细胞的过程,从而获得浸润性和游走迁移能力的过程。因此,EMT与人体病理情况包括纤维化、肿瘤转移密切相关。上皮细胞表型的丧失和间质特性的获得是EMT发生的主要特征。第一,细胞粘附分子表达减少导致了上皮细胞失去原本细胞间的粘附作用;第二,原先的细胞骨架以角蛋白为主转变为Vimentin为主,从而形成了纺锤状细胞,但有时EMT也会发生功能改变,形态却不改变的情况。这种表型的转化就使肿瘤细胞摆脱细胞间粘附,表现得更具侵袭能力[3]。EMT也会促使一些参与细胞外基质、基底膜降解和破坏的溶解酶,从而破坏肿瘤细胞侵袭的组织学屏障,便于细胞从原发肿瘤分离脱落,从而发生侵袭转移。通常认为EMT发生在肿瘤转移的起始阶段[4]。E-cadherin主要表达于上皮细胞,是参与细胞间粘附,维持细胞完整性的一类介导细胞间粘附的钙依赖性跨膜蛋白,是EMT的关键分子。有研究发现在肝癌、结肠癌中,E-cadherin低表达与肿瘤的转移有关[5-6]。也有相关研究[7]通过对肺腺癌免疫组化染色,进行上皮标志蛋白的表达检测,发现E-cadherin表达与肺腺癌的分化程度呈正相关,并发现E-cadherin低表达的患者预后较差。Vimentin是一种重要的细胞骨架蛋白,广泛表达于各种内皮细胞等间质细胞内。研究发现,乳腺癌、肝癌中Vimentin表达增高[8-9],但Vimentin在非小细胞肺癌中表达异常[10-11]。本研究显示,在79例肺鳞癌患者中,有25.3%的病例E-cadherin表达缺失,在这些E-cadherin阴性表达的病例中,淋巴结转移的阳性率高于未发生淋巴结转移的;而Vimentin阳性表达病例中,淋巴结转移阳性率同样高于未发生的淋巴结转移组。
TGF-β是诱导肿瘤细胞发生EMT的关键因子,其通过Smad和非Smad信号通路诱导肿瘤细胞发生EMT。TGF-β具有调节细胞生长、凋亡、分化和迁移多种功能。在癌症的发展过程中,TGF-β发挥了初期的肿瘤抑制和中后期肿瘤促进的双向作用。TGF-β作为一种肿瘤促进因子,刺激组织纤维化和细胞外基质沉积,扰乱免疫功能,刺激血管生成和促进上皮间充质转化。本研究中,肺鳞癌病例中有17例TGF-β1过表达,与淋巴结转移具有相关性。从而选择TGF-β1因子在体外细胞实验中进行诱导,观察诱导后的肺鳞癌细胞系是否发生EMT。实验结果表明,诱导后的肺鳞癌细胞系Vimentin表达明显增强,E-cadherin表达减弱,证实了EMT的发生。通过侵袭实验等相关功能实验也进一步证实了发生EMT的肺鳞癌细胞系侵袭和转移能力均有提高。
EMT不仅在胚胎形成发育中起重要作用,而且
在肿瘤侵袭转移中同样也发挥重要作用。因此,EMT分子调控机制研究为预防肿瘤转移提供一个有利的平台。EMT调控因子可使肿瘤细胞发生EMT,促进肿瘤侵袭转移。有研究证实,通过上调肺腺癌细胞中Oct4和Nanog表达,可促发EMT进程,并增加癌细胞转移、侵袭[12-13]。体外经TGF-β1诱导的肺腺癌细胞系失去了上皮特性,获得了间质细胞表型,也有着较强的侵袭、迁移能力[14-15],与本研究的结果一致。一些研究也表明,E-cadherin的缺失与肺癌的进展、远处转移以及较差的预后有关。目前有研究已经通过各种方法抑制EMT而降低肿瘤的侵袭与转移,有针对TGF-β1抑制EMT的相关实验,从而逆转肿瘤侵袭,如使用TGF-β阻滞剂降低肿瘤的侵袭性[16-17]。
综上所述,本研究提示在肺鳞状细胞癌的转移、侵袭发生中,EMT调控起了关键作用。因此诱导EMT发生的调控基因,便成为进一步研究的主要内容。但目前EMT的发生所涉及的调控机制,大多数还是建立在体外实验基础上,由于体内外环境差别较大,要想更好地了解EMT在肿瘤侵袭转移中的作用,还有待进一步开展EMT在体内的相关研究。
1Agnantis NJ,Goussia AC,Batistatou A,et al.Tumor markers in cancer patients:an update of their prognostic significance.Part II.[J].InVivo,2004,18(4):481-488.
2Creighton CJ,Gibbons DL,Kurie JM,et al.The role of epithelialmesenchymal transition programming in invasion and metastasis:a clinical perspective[J].Cancer Manag Res,2013,5:187-195.
3Zeisberg M,Neilson EG.Biomarkers for epithelial-mesenchymaltransitions[J].J Clin Invest,2009,119(6):429-1437.
4Mani SA,Guo W,Liao MJ,et al.The epithelial-mesenchymal transition generates cells with properties of stem cells[J].Cell,2008,133(4):704-715.
5Che N,Zhao XL,Gu Q,et al.The expression of Twist,E-cadherin and β-catenin in hepatocellular carcinoma and its correlation with recurrence,metastasis and prognosis[J].Chin J Clinical Oncol,2010,37(6):305-308.[车娜,赵秀兰,古强,等.Twist、E-cadherin和β-catenin在肝细胞肝癌中的表达及其预后的关系[J].中国肿瘤临床,2010,37(6):305-308.]
6Gao J,Sun Y,Zhao XL,et al.The expression of NGAL,MMP-9 and E-cadherin in colon carcinoma and its correlation with recurrence,metastasis and prognosiss[J].Chin J Clin Oncol,2011,38(6):324-327.[高钧,孙燕,赵秀兰,等.NGALMMP-9和E-cadherin在结肠癌中的表达及其与预后的关系[J].中国肿瘤临床,2011,38(6):324-327.]
7Yan B,Zhang W,Jiang LY,et al.Reduced E-Cadherin expression is a prognostic biomarker of non-small cell lung cancer:a metaanalysis based on 2395 subjects[J].Int J Clin Exp Med,2014,7(11):4352-4356.
8Yao X,Wang X,Wang Z,et al.Clinicopathological and prognostic significance of epithelial mesenchymal transition-related protein expression in intrahepatic cholangiocarcinoma[J].Onco Targets Ther,2012,5(12):255-261.
9Liu T,Zhang X,Shang M,et al.Dysregulated expression of Slug,vimentin,and E-cadherin correlates with poor clinical outcome in patients with basal-like breast cancer[J].J Surg Oncol,2013,107(2):188-194.
10 Al-Saad S,Al-Shibli K,Donnem T,et al.Theprognostic impact of NF-kappaBp105,vimentin,E-cadherin and Par6 expression in epithelial and stromal compartment in non-small cell lung cancer[J]. Br J Cancer,2008,99(9):1476-1483.
11 Kong F,Qu Z,Yuan H,et al.Overexpression of FOXM1 is associated with EMT and is a predictor of poor prognosis in non-small cell lung cancer[J].Oncol Repo,2014,31(6):2660-2668.
12 Chiou SH,Wang ML,Chou YT,et al.Coexpression of Oct4 and Nanog enchances malignancy in lung adenocarcinoma by inducing cancer stem cell-like properties and epithelial mesenchymal transdifferentiation[J].Cancer Res,2010,70(24):10433-10444.
13 Lu Y,Zhu H,Shan H,et al.Knockdown of Oct4 and Nanog expression inhibits the stemness of pancreatic cancer cells[J].Cancer Lett,2013,28;340(1):113-123.
14 Kim JH,Jang YS,Eom KS,et al.Transforming growth factor beta1 induces epithelial-to-mesenchymal transition of A549 cells[J].J Korean Med Sci,2007,22(5):898-904.
15 Chen XF,Zhang HJ,Wang HB,et al.Transforming growth factorbeta 1 induces epithelial-to-mesenchymal transition in human lung cancer cells via PI3K/Akt and MEK/Erk1/2 signaling pathways[J].Mol Biol Rep,2012,39(4):3549-3556.
16 Subramanian G,Sehwarz RE,Higgins L,et al.Targeting endogenous transforming growth factor-β receptor signaling in SMAD4-deficient human pancreatic carcinoma cells in hibits their invasive phenotype1[J].Cancer Res,2004,64(15):5200-5211.
17 Sheen YY,Kim MJ,Park SA,et al.Targeting the Transforming Growth Factor-β Signaling in Cancer Therapy[J].Biomol Ther,2013,21(5):323-331.
(2014-12-09收稿)
(2015-01-08修回)
(编辑:杨红欣)
Effect of epithelial-to-mesenchymal transition on the invasion and migration abilities of lung squamous cell carcinoma
Yanjun ZHENG1,Baocun SUN1,2,3,Xiulan ZHAO1,3,Xu ZHENG1,Yanlei LI1,Zhiqiang QIU2,Qiang GU1,3,Xueyi DONG1,3,Yanhui ZHANG2
Baocun SUN;E-mail:sunbaocun@aliyun.com
Objective:To investigate the clinical significance of epithelial-to-mesenchymal(EMT)in lung squamous cell carcinoma(LSCC)and to examine the effect of EMT on the invasive and migration abilities of LSCC.Methods:Immunohistochemical staining was performed to determine the expression of E-cadherin,Vimentin,and TGF-β1 in 79 LSCC patients,and the clinical significance was explored.SK-MES-1 lung squamous carcinoma cells were cultured in conditioned medium containing various concentrations of transforming growth factor-β1(TGF-β1)for 5 and 10 days.The expression levels of E-cadherin and Vimentin were detected via Western blot and reverse transcription-polymerase chain reaction(RT-PCR).With different concentrations and induction times,invasion and wound healing assays were performed to evaluate the invasion and migration abilities.Results:E-cadherin expression was significantly lower,whereas Vimentin expression was significantly higher in LSCC with lymph node metastasis than in that without noda metastasis (P<0.05).In the tissues of 79 LSCC patients,TGF-β1 expression was significantly related to lymph node metastasis(P<0.05).Western blot showed that Vimentin expression was higher,whereas E-cadherin expression was lower in TGF-β1 inducing medium with 10 ng/ mL SK-MES-1 cells than in the other media.RT-PCR showed similar results.Scratch test and invasion assay both showed that treatment of cells with cytokines markedly enhanced the migration and invasion of the cells.Conclusion:Lymph node metastasis of LSCC correlates with EMT.SK-MES-1 cells undergo EMT via TGF-β1 induction,which enhances invasion and migration.
epithelial-to-mesenchymal transition,lung squamous cell carcinoma,TGF-β1,invasion;migration

10.3969/j.issn.1000-8179.20142037
①天津医科大学病理教研室(天津市300070);②天津医科大学肿瘤医院病理科;③天津医科大学总医院病理科
*本文课题受国家自然科学基金重点项目(编号:81230050)和国家自然科学基金面上项目(编号:81173091)资助
孙保存sunbaocun@aliyun.com
1Department of Pathology,Tianjin Medical University,Tianjin 300070,China;2Department of Pathology,Tianjin Medical University Cancer Institute and Hospital,Tianjin 300060,China;3Tianjin Medical University General Hospital,Tianjin 300052,China
This work was supported by the Key Project of the National Natural Science Foundation of China(No.81230050)and the National Natural Science Foundation of China(No.81173091)
郑燕君专业方向为肿瘤病理学。
E-mail:zhengyanjun.student@sina.com
