胃切除术对胃癌伴2型糖尿病患者血糖改善的疗效观察
2015-11-21李树峰
邓 帅,李树峰,徐 峰
(1山西医科大学第一临床医学院普外科,太原 030001;2晋煤集团总医院普外科;*通讯作者,E-mail:li1189@263.net)
胃癌是当今世界常见恶性肿瘤,我国胃癌发病率居世界第二位[1]。随着人民饮食习惯改变及社会步入老龄化,我国2型糖尿病(type 2 diabetes mellitus,T2DM)发病率呈快速上升趋势[2]。T2DM属内科顽疾,而胃癌为外科常见肿瘤,二者出现学科交叉概率大,因此临床上胃癌伴T2DM患者很常见。近年来,有文献报道胃癌伴T2DM患者行胃切除术后,部分患者T2DM得到明显改善甚至治愈[3]。本研究回顾性分析36例胃癌伴T2DM患者行不同胃切除术后T2DM缓解情况,探讨胃癌伴T2DM的手术方式选择。
1 资料与方法
1.1 一般资料
收集2011-01~2014-01有手术指征的胃癌伴T2DM患者38例。所有病例术前均经胃镜病理检查确诊胃癌;根据2010年美国糖尿病协会诊断标准确诊为T2DM。排除标准:①较多检查缺失;②T2DM晚期、胰岛素功能衰竭者(空腹或餐后2 h胰岛素低于20 mmol/L);1型糖尿病患者;③术后发生肠瘘、肾衰等严重并发症影响糖代谢;④年龄超过70岁,预计生存期小于1年,术后失访。本研究共入选36例研究对象,根据患者当时病情及癌灶部位由术者决定手术方式,按手术方式不同分3组。PG组10例,其中男5例,女5例;年龄55-64岁,平均年龄(60±4.9)岁。BI组11例,其中男6例,女5例;年龄52-63岁,平均年龄(59±3.2)岁。RY组15例,其中男8例,女7例;年龄53-69岁,平均年龄(62±6.3)岁。
1.2 手术方法
所有患者均在全麻下开腹行根治性胃癌切除D2淋巴结清扫术。PG组患者行近端胃切除食管残胃吻合术(proximal gastrectomy remnant gastric esophageal anastomosis,PG):切除近端胃大部,食管与远端残胃吻合。BI组患者行远端胃切除Billroth I吻合术(Billroth I distal gastrectomy with gastroduodenal anastomosis,BI):切除远端胃大部,近端残胃与十二指肠吻合。RY组患者行全胃切除Roux-en-Y吻合术(total gastrectomy Y-anastomosis,RY):切除全胃,闭合十二指肠残端,距屈氏韧带30-40 cm处切断空肠,远端空肠与食管吻合,距食管-空肠吻合口远端40-50 cm处行空肠-空肠吻合。
1.3 观察指标
①术前需停长效降糖药物1周或短效降糖药3 d,记录空腹血糖(fasting plasma glucose,FBG)、糖化血红蛋白(glycosylated hemoglobin,HbA1c)、体质指数(body mass index,BMI)、T2DM 病程、应用抗T2DM 药物情况。完成数据采集后根据血糖值调整用药并控制在手术耐受范围内(FBG<10.0 mmol/L)。②在术后1月、3月、6月分别记录患者 FBG、HbA1c、BMI、应用抗T2DM药物情况。
1.4 疗效判断标准
依据术后6月FBG、HbA1c和抗T2DM药物应用情况作为手术治愈、好转和无效的衡量标准[4]。治愈:FPG≤6.11 mmoL/L,HbA1c<6.5%,停用任何抗 T2DM药物。好转:FPG值下降超过1.39 mmol/L,或HbA1c值仍高于正常但HbA1c下降>1%,或抗T2DM药物种类、剂量减少。无效:FPG、HbA1c值无降低,或抗T2DM药物种类、剂量增加。将治愈与好转病例作为治疗有效病例分析。
1.5 统计学分析
2 结果
2.1 一般情况比较
三组患者术前在年龄、性别、T2DM病史及用药情况等方面的比较,差异均无统计学意义(P>0.05),见表1。
2.2 三组患者术前与术后 BMI、FBG、HbA1c指标变化
三组患者术前在BMI、FBG、HbA1c方面比较,差异均无统计学意义(P>0.05)。三组患者术前BMI分别与术后1,3,6月比较,差异有统计学意义(P<0.05);在术后 1,3,6月三组间 BMI相同时间点比较,差异无统计学意义(P>0.05,见表2)。表明三种手术均可降低胃癌伴T2DM患者BMI,但三种手术对患者BMI降低程度无差异。三组患者术后1,3,6月 FBG、HbA1c分别与术前比较,差异有统计学意义(P<0.05);三组间FBG、HbA1c在术后1,3,6月相同时间点比较,差异有统计学意义(P<0.05,见表3,4)。表明RY可降低胃癌伴T2DM 患者的 FBG、HbA1c,且随时间变化,FBG、HbA1c逐渐下降。
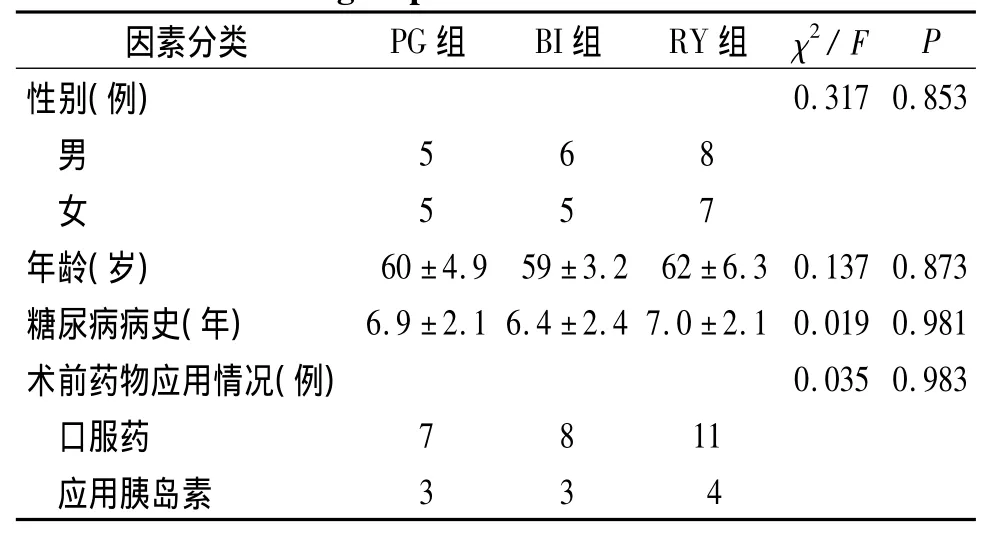
表1 三组患者术前一般资料比较Table 1 Comparison of general clinical data among three groups
表2 三组患者BMI变化比较(±s,kg/m2)Table 2 Comparison of BMI before and after surgery among three groups(±s,kg/m2)

表2 三组患者BMI变化比较(±s,kg/m2)Table 2 Comparison of BMI before and after surgery among three groups(±s,kg/m2)
与术前比较,*P<0.05
?
表3 三组患者FPG变化的比较(±s,mmol/L)Table 3 Comparison of FPG before and after surgery among three groups(±s,mmol/L)
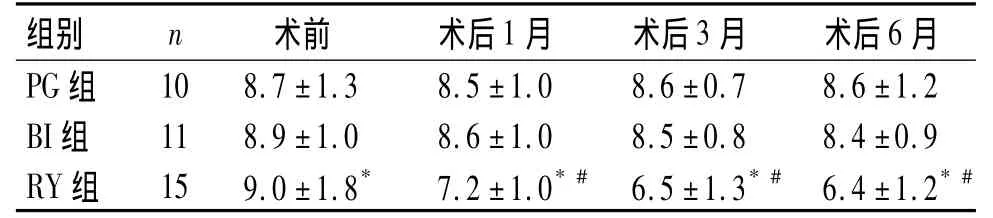
表3 三组患者FPG变化的比较(±s,mmol/L)Table 3 Comparison of FPG before and after surgery among three groups(±s,mmol/L)
与术前比较,*P<0.05;与其他两组比较,#P<0.05
?
表4 三组患者HbA1c变化比较(±s,%)Table 4 Comparison of HbA1c before and after surgery among three groups(±s,%)

表4 三组患者HbA1c变化比较(±s,%)Table 4 Comparison of HbA1c before and after surgery among three groups(±s,%)
与术前比较,*P<0.05;与其他两组比较,#P<0.05
?
2.3 手术前后T2DM改善情况
36例患者术后均康复出院,在超过6月随访期,未发现肿瘤复发,并完成数据采集。从术后T2DM改善情况来分析,PG组2例患者T2DM好转,有效率20.0%;BI组2例患者T2DM好转,有效率18.2%;而RY组患者4例治愈、8例好转,有效率80.0%。RY与 PG、BI相比,其对胃癌伴 T2DM患者的血糖改善差异有统计学意义(χ2=10.67,P<0.05),RY 优于PG 和 BI。
3 讨论
T2DM不仅增加胃癌发病风险,还增加围手术期并发症及死亡率,此外对胃癌患者术后预后、肿瘤复发和转移都有不利作用[5,6]。目前,治疗 T2DM传统方法如调节饮食、口服降糖药和注射胰岛素等,均不能治愈T2DM,也无法避免病情进展。当前胃癌治疗以根治性手术为主,已有文献报道胃癌伴T2DM患者在胃切除术后部分患者T2DM可得到治愈[3]。因此对胃癌伴T2DM患者我们有必要探索一种手术方式,在根治性切除胃癌的同时又治愈T2DM。目前胃癌切除手术方式以PG、BI、RY多见。本研究严格遵循医学伦理学,保证患者获得根治性切除胃恶性肿瘤,观察三种手术对胃癌伴T2DM患者血糖改善情况。
本研究三组患者术前在一般情况比较差异均无统计学意义(P>0.05),组间具有可比性。研究结果表明不同胃切除术对胃癌伴T2DM患者血糖改善的疗效不同,RY优于B I和PG,这与其他相关文献报道一致[3,7]。目前RY治疗T2DM 机制尚未完全阐明,曾有学者认为术后限制膳食热量摄入及体重下降是其治疗T2DM主要机制,但越来越多研究表明限制膳食热量及体重下降不是治疗T2DM全部原因[8]。本研究对象为胃癌患者,部分患者就诊前已有纳差、消瘦、甚至营养不良的情况发生。术后随着癌灶被切除,消化道症状缓解,随访中大多数患者膳食量超过术前,而FPG、HbA1c在正常范围,因本研究无膳食热量的相关研究指标,所以关于限制膳食热量摄入引起T2DM缓解,本研究尚无法找到支持该机制的证据。三组患者术后BMI均出现下降,但3种手术对患者BMI降低程度无差异,而仅RY组患者的血糖得到很好控制。因此本研究支持RY治疗T2DM机制并不能完全由体重减轻来解释。
目前学术界对RY治疗T2DM机制多倾向“肠-胰岛轴”学说。该学说认为肠道在食物刺激下,可调节一些胃肠激素分泌来促进胰岛素释放,称“肠-胰岛轴”[9]。这些胃肠激素分两类:一是抑制胰岛素分泌的激素,如生长激素释放肽(ghrelin);二是刺激胰岛素分泌的激素,如胰高血糖素样肽-1(gluca-gons-like peptide-1,GLP-1)、抑胃肽(gastric inhibitory peptides,GIP)。RY术后患者解剖和生理学改变如下:全胃被切除;十二指肠、近段空肠被旷置,食物不再经过十二指肠和近段空肠;远端空肠相当于被上提,食物能快速与远端空肠接触。其治疗T2DM是通过影响上述胃肠激素变化来实现的[9]。第一,食物经过十二指肠与近端空肠时,可刺激肠壁K细胞分泌 GIP(其分泌过多可导致胰岛素抵抗及T2DM[10])。RY后,食物不再经过十二指肠和近段空肠,GIP分泌减少,有利于缓解T2DM。第二,RY后食物快速与远端空肠接触,刺激小肠上皮L细胞分泌GLP-1[11]。GLP-1不仅改善胰岛素抵抗,还促进胰岛B细胞增殖抑制其凋亡[12]。第三,Ghrelin是食物刺激胃肠道后主要由胃底黏膜X/A样细胞分泌的[13],生理浓度下可促进胰岛素分泌,但浓度过高时则限制外周组织对葡萄糖利用,在T2DM发生、发展过程中起一定的作用。RY后Ghrelin分泌大大减少,血浆浓度降低,从而缓解 T2DM[14]。本研究中,术后食物仍经过十二指肠和近端空肠的PG和BI对T2DM疗效不如RY,在一定程度上支持该学说。
PG与BI均属限制胃容积手术,术后食物仍通过十二指肠、近端空肠。目前学术界认为该类手术治疗T2DM的机制主要是术后患者体重减轻,体重下降越多其治疗T2DM效果越好。本研究PG、BI两组患者同RY组相似,术前也出现营养不良及消化道症状,尽管术后短期BMI下降,但随着恶性肿瘤被切除,患者BMI并无继续下降。因此从相反角度说明,术后体重无明显下降影响了PG与BI对T2DM疗效。另外,由于PG切除胃底,与BI相比可减少Ghrelin分泌。因Ghrelin有抑制胃排空作用,Ghrelin减少有助于食物快速达远端小肠,刺激GLP-1分泌[15]。根据此理论解释,PG对T2DM疗效应比BI好,但本研究PG与BI对T2DM疗效无差异,可能由于研究病例数少,尚需更多研究对象予证实。
综上分析,对胃癌伴T2DM患者治疗,不仅要根治恶性肿瘤,对T2DM同样不可轻视,RY可同时完成对胃癌及T2DM治疗。由于本研究为回顾性研究,研究对象少、随访时间短、没有做到完全随机分组,在以后临床研究中需大样本长期随机对照研究来验证RY是否可有效改善胃癌伴T2DM的血糖水平。
[1]Silano M,Volta U,Mecchia AM,etal.Delayed diagnosis of coeliac disease increases cancer risk[J].BMC Gastroenterol,2007,7:8.
[2]赵林,杨勇.2型糖尿病患者及高危人群社区综合干预效果分析[J].中国预防医学杂志,2008,9(7):632-634.
[3]裴明毓,王震,陈俊强.三种消化道重建方式治疗胃癌合并2型糖尿病的研究进展[J].世界华人消化杂志,2012,20(35):3515-3520.
[4]Schauer PR,Burguera B,Ikramuddin S,etal.Effect of laparoscopic Roux-en-Y gastric bypass gastric bypass on type 2 diabetes mellitus[J].Ann Surg,2003,238(4):467-485.
[5]Yeh HC,Platz EA,Wang NY,etal.A prospective study of the associations between treated diabetes and cancer outcomes[J].Diabetes Care,2012,35(1):113-118.
[6]Tseng CH.Diabetes conveys a higher risk of gastric cancer mortality despite an age-standardised decreas-ing trend in the general population in Taiwan[J].Gut,2011,60(6):774-779.
[7]魏炜明.前瞻性临床随机对照研究胃旁路手术对2型糖尿病的影响[D].上海:第二军医大学,2010.
[8]Rubino F,Forgione A,Cummings DE,etal.The mechanism of diabetes control after gastrointestinal bypass surgery reveals a role of the proximal small intestine in the pathophysiology of type2 diabetes[J].Ann Surg,2006,244:741-749.
[9]李峰.胃肠道重组对非肥胖2型糖尿病治疗作用及机制的动物实验研究[D].济南:山东大学,2010.
[10]Rublno F.Is type2 diabetes an operable intestinal disease?A prospective reasonable hypothesis[J].Diabetes Care,2008,3l(l2):290-296.
[11]Salehi M,Prigeon RL,D’AleAlessio DA.Gastric bypass surgery enhances glucagon-like peptide 1-stimulated postprandial insulin secretion in humans[J].Diabetes,2011,60(9):2308-2314.
[12]Pournaras DJ,Glicksman C,Vincent RP,etal.The role of bile after Roux-en-Y gastric bypass in promoting weight loss and improving glycemic control[J].Endocrinology,2012,153(8):3613-3619.
[13]Kageyama H,Funahashi H,Hirayama M,etal.Morphological analysis of ghrelin and its receptor distribution in the rat pancreas[J].Regul Pept,2005,126(2):67-71.
[14]Koshy AA,Bobe AM,Brady MJ.Potential mechanisms by which bariatric surgery improves systemic metabolism[J].Transl Res,2013,161(2):63-72.
[15]Scopinaro N,Papadia F,Marinari G,etal.Long-term control of type 2 diabetes mellitus and the other major components of the metabolic syndrome after biliopancreatic diversion in patiens with<35 kg/m2[J].Obes Surg,2007,17(2):185-192.
