不同正极材料锂离子电池烤箱热滥用数值模拟研究
2015-11-21孙忆琼蒋方明
孙忆琼,彭 鹏,蒋方明
(1.中国科学院可再生能源重点实验室,广东广州510640;
2.中国科学院广州能源研究所先进能源系统实验室,广东广州510640)
锂离子电池的安全性问题在其推广应用的过程中备受关注。为提高其安全性,现有大量利用实验方法分析电池材料,特别是正极材料的热稳定性的研究。Veluchamy等[1]通过热重分析仪(TGA)和差式扫描量热仪(DSC)研究指出,LixCoO2与电解液的反应在60~125℃存在微弱的放热反应峰;MacNeil等[2]采用绝热加速量热仪(ARC)和X射线衍射(XRD)方法研究LixMn2O4的热稳定性,λ-Mn2O4在高浓度LiPF6环境中因HF含量增加其热稳定性会降低;Belharouak等[3]比较了Li0.53Ni0.8Co0.15Al0.05O2与两种不同电解液的反应,测定了反应的起始温度、峰值温度与反应焓;Jiang等采用ARC研究了不同粒径、满充的LiFePO4与电解液LiPF6/(EC+DEC)或LiBOB/ (EC+DEC)的反应,发现粒径对于热稳定性无影响;Xiang等较系统地比较了包括LixNi1/3Co1/3/Mn1/3O2、LixFePO4等不同正极材料与电解液1 mol/L LiPF6/(EC+DMC)的反应,结果表明各充电态正极材料在高温下释氧程度是影响其安全性的主要因素。美国Sandia国家实验室利用ARC测得五种不同正极材料的锂离子电池在烤箱热滥用中的放热曲线。
数值模拟是研究锂离子电池热滥用的重要手段。Kim等[4]通过构建锂离子电池的三维热滥用模型,研究电池内部化学反应的扩散过程,得出电池尺寸是影响烤箱实验中电池热行为的一个重要因素;Lai等[5]建立了锂离子电池的三维非稳态热滥用模型,并对三种不同荷电状态电池进行烤箱实验模拟,提出了判别电池热安全性的临近曲线分析方法。
以上研究没有利用数值模拟方法对不同正极材料的锂电池在烤箱实验中的热行为进行综合系统的预测和分析。基于此,本文利用本实验室开发的锂离子电池的三维热滥用模型[6]模拟LiCoO2、LiNi0.8Co0.15Al0.05O2、Li1.1(Ni1/3Co1/3/Mn1/3)0.9O2、Li-Mn2O4、LiFePO4五种不同正极材料的电池在不同烤箱实验温度下的热行为,比较分析五种不同正极材料电池的热稳定性和安全性。
1 计算模型
1.1 物理模型
针对方形锂离子电池的单层电芯,建立热模型,如图1所示,单层电芯厚度为196 μm,尺寸为196 μm×0.065 m×0.1 m,其中厚度方向上从左到右依次是负极集流体(Cu)、负极、隔膜、正极以及正极集流体(Al),各层厚度分别为9、59、20、92和16 μm。
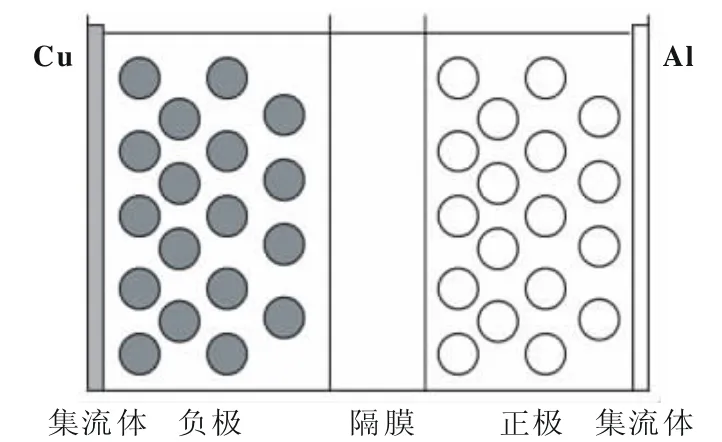
图1 锂离子电池单层电芯物理模型
1.2 能量守恒方程
能量守恒方程为:
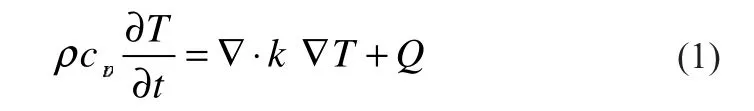
式中:ρ为电池材料密度,kg/m;cp为比热容,J/(kg·K);T为温度,K;t为时间,s;k为导热系数,W/(m·K);Q为滥用过程中电池内部各项放热反应的单位体积热生成速率,W/m3。复合电极(包括隔膜)的热物性根据各组分容积份额进行加权求和确定。表1~表2汇总了电池各部分材料的热物性[7]。表3列出了电极和隔膜各组分的容积份额。
锂离子电池不同电芯位置的散热条件不同。其中,最外层电芯与外界进行对流和辐射换热,内部电芯只能与紧邻位置电芯相互导热。将以上各种散热方式等效为对流换热,电池内部的电芯取较小的等效换热系数,靠近电池表面电芯取较大的等效换热系数,则统一的换热边界条件为:
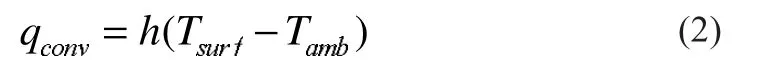
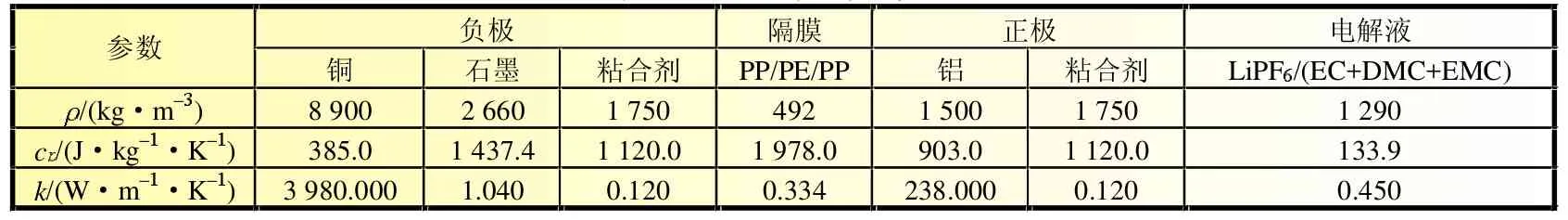
表1 电池材料热物性

表2 电池正极材料热物性

表3 电极和隔膜各组分的容积份额
式中:h为等效换热系数;qconv为单位面积散热量,W/m2;Tsurf为电芯外表面温度,K;Tamb为烤箱温度或近邻电芯温度,K。本计算中取等效换热系数h=1.5 W/(m2·K),对应于电池(多层电芯组成)中位置较内部电芯的散热条件。
1.3 热滥用反应模型
不考虑燃烧反应,在锂离子电池烤箱热滥用过程中,存在四种可能的放热反应,分别为固液膜分解反应、负极材料与电解液反应、正极材料与电解液反应以及电解液的分解反应。式(1)中Q的计算如下:
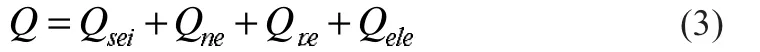
式中:Qsei为滥用过程中电池内部固液膜分解反应的单位体积热生成速率,W/m3;Qne为负极与电解液反应的单位体积热生成速率,W/m3;Qpe为正极与电解液反应的单位体积热生成速率,W/m3;Qele为电解液分解反应的单位体积热生成速率,W/m3。表4汇总了不同反应控制方程。
锂离子电池在滥用条件下发生的热失控现象可能与正极-电解液反应放热密切相关,正极与电解液的反应是影响锂离子电池安全性的重要一环。本文考虑了多种不同正极材料的电池,正极与电解液的反应可用相同控制方程描述,只是控制方程中参数的取值不同。计算中主要参数取值如表5~表6所示。
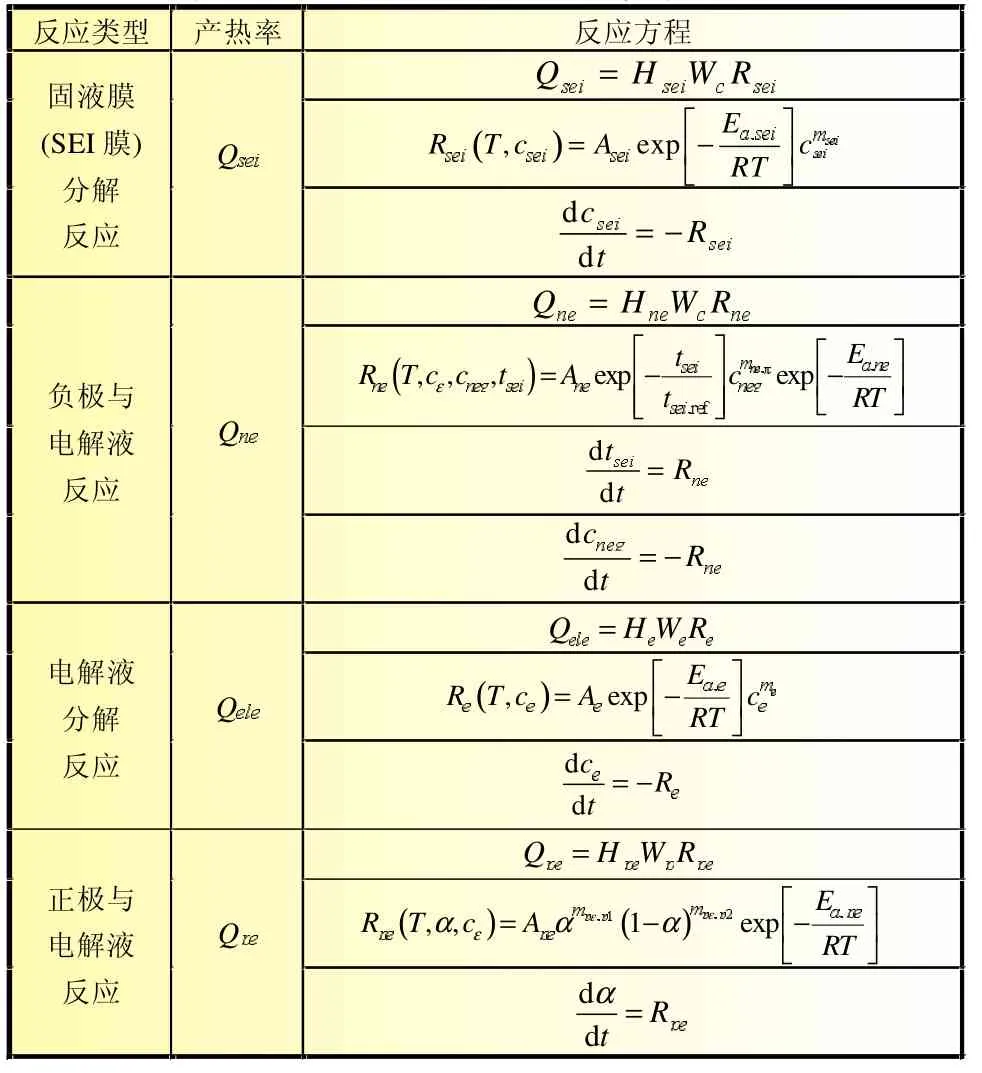
表4 不同放热反应的反应控制方程
2 结果与讨论
通过模拟LiCoO2、LiNi0.8Co0.15Al0.05O2、Li1.1(Ni1/3Co1/3/Mn1/3)0.9-O2、LiMn2O4、LiFePO4五种不同正极与电解液反应时反应程度和热生成速率随温度的演化,研究并揭示材料的热稳定性及热安全性差异。另外,还对五种不同正极材料锂离子电池进行烤箱热滥用过程数值模拟,模拟其单层电芯在不同烤箱温度下的热量生成和传输,探讨和分析不同正极材料电池热失控机制。
2.1 不同正极材料与电解液的反应
借助于锂离子电池烤箱热滥用模型,只考虑正极与电解液的反应,模拟其反应程度与热生成速率的变化,如图2所示,不同正极与电解液发生完全反应的起始温度不同,LiCoO2、LiNi0.8Co0.15Al0.05O2、Li1.1(Ni1/3Co1/3/Mn1/3)0.9O2、LiMn2O4、Li-FePO4反应的起始温度分别为175、200、255、270和260℃。反应起始温度不同表明其热稳定性存在差异,LiMn2O4的热稳定性最高。反应完全时,不同材料的温升也不一样,LiNi0.8Co0.15-Al0.05O2的温升最大,LiFePO4的温升最小,分别为210和15℃,这是由于不同正极与电解液完全反应的热生成量不同。
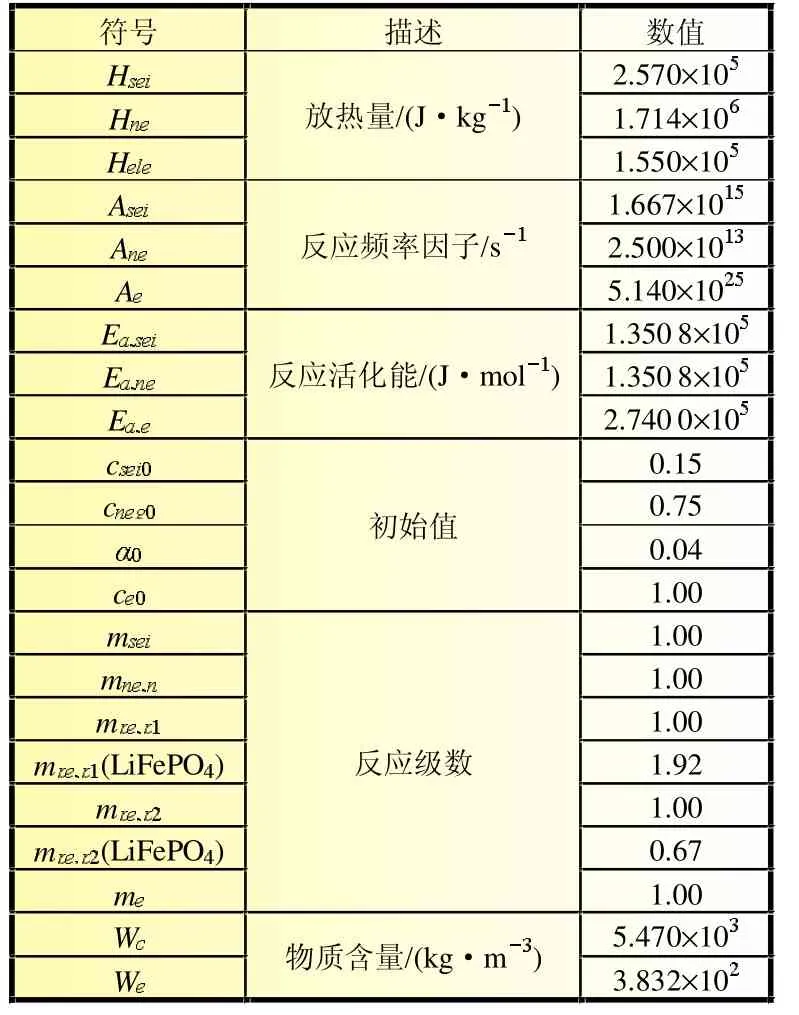
表5 计算参数[4]
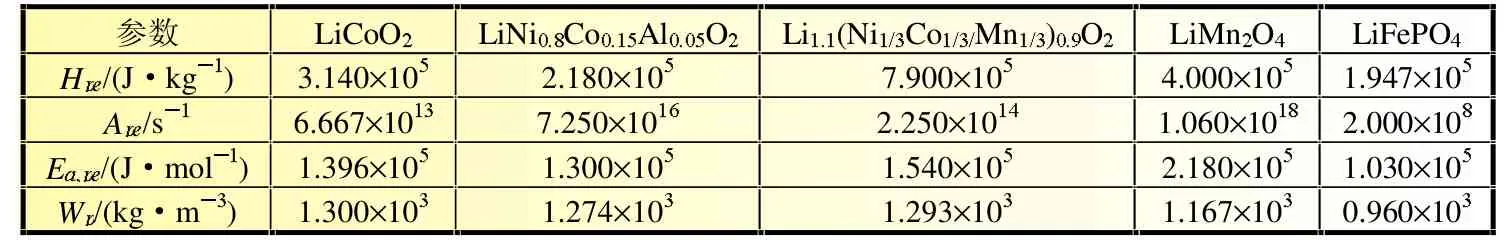
表6 正极材料与电解液反应的计算参数[9-10]
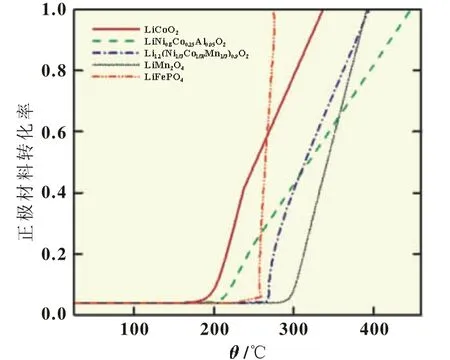
图2 不同正极材料与电解液反应的进行程度
如图 3所示 ,LiCoO2、LiNi0.8Co0.15Al0.05O2、Li1.1(Ni1/3Co1/3-Mn1/3)0.9O2、LiMn2O4、LiFePO4的最大热生成速率分别为7、53、80、50、1.6 W。各材料的热生成速率不同导致其温升的差异,进而影响其安全性。LiFePO4与电解液反应的起始温度为260℃左右,小于LiMn2O4反应的起始温度,但由于其反应的热生成速率远远小于其它材料,热安全性最好。
2.2 热滥用过程电芯温度变化
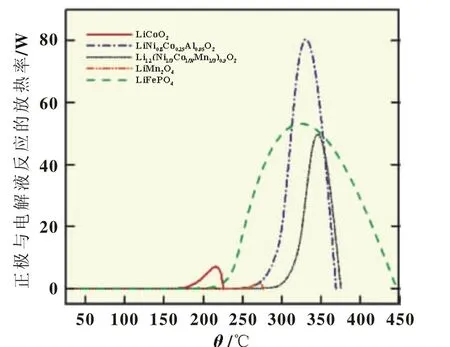
图3 不同正极材料与电解液反应的热生成速率
取等效对流换热系数h=1.5 W/(m2·K),电芯的初始温度为25℃,分析比较不同烤箱温度所导致电芯表面温度的变化。如图4(a)所示,烤箱环境温度较高时,LiCoO2电芯被加热到环境温度后,内部化学反应迅速释放的热量因无法及时散失到临近电芯或周围环境中而大量堆积,引起温度急剧升高的热失控现象。在175、195和215℃的烤箱温度下,LiCoO2电芯出现急剧升温,随后下降到与烤箱温度一致。其中,215℃的烤箱温度下的温升达115℃。
烤箱温度越低,内部放热反应越慢,热量能及时的向临近电芯或周围环境散失,而不易堆积,热失控的最大温升越小。当环境温度低于某一值时,电芯温度将不会突然升高而造成热失控。如图4(a)所示,当烤箱温度为155和135℃时,电芯表面温度加热到烤箱温度后保持不变,不会出现热失控。

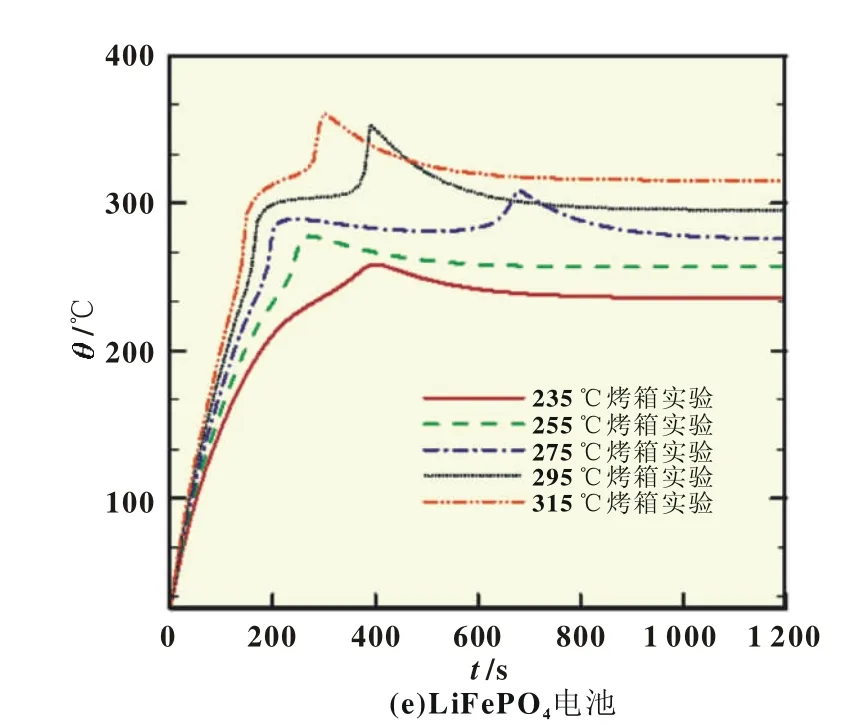
图4 不同烤箱温度下不同正极材料锂电池电芯表面温度变化
如图4所示,不同正极材料锂电池发生热失控的临界条件 不 同 ,LiCoO2、LiNi0.8Co0.15Al0.05O2、Li1.1(Ni1/3Co1/3/Mn1/3)0.9O2、LiMn2O4四种材料发生热失控的可能温度分别为175、195、255和275℃,LiFePO4在不同温度的烤箱实验中,最大温升为275℃的烤箱温度实验中的温升约40℃,出现热失控的可能性不大。LiFePO4电池的热安全性优于其他四种电池。
2.3 热滥用过程放热反应及热源分析
通过比较不同反应的反应程度及热生成速率,可以辨识出热滥用过程中放热量最大的热源。温度对反应速率有决定性的影响。以下分析主要针对LiMn2O4电池275和255℃烤箱热滥用过程。
如图5(a)所示,在255和275℃的烤箱模拟中,固液膜的分解反应开始时间均为50 s左右。前者反应完成的时间为100 s,后者为70 s。因此,在较高温度下,固液膜分解反应完全所需时间差别不大。
如图5(b)所示,在100 s附近,负极与电解液的反应在电芯被加热到一定程度时被触发,负极中嵌锂的无量纲含量开始下降。275℃烤箱温度下,cneg的下降速度大于255℃时的下降速度,表明烤箱温度越高,分解反应越剧烈。如图4(d)所示,800 s左右时,275℃烤箱模拟中电芯表面温度达到峰值,随后下降,导致反应剧烈进行,cneg急剧下降约50 s,之后基本保持不变。
如图5(c)所示,因正极的金属氧化物在270℃以上才容易分解释放氧,与电解液发生反应,255℃的烤箱模拟中正极材料与电解液反应的α增加较慢。而在275℃的模拟烤箱中,在初始阶段的缓慢反应之后,电芯温度的升高导致反应剧烈进行,其转化率在800 s左右达到1,反应结束。
如图5(d)所示,在255和275℃的烤箱模拟中,200 s左右时,电芯温度达到电解液分解反应的触发温度,反应随即剧烈发生,ce迅速减小。255℃烤箱温度中反应完全所需时间为150 s,高于275℃烤箱温度下的50 s,两者相差较大。
由图5可知,烤箱温度为255℃时,放热反应均不剧烈,热生成速率慢、产生的少量热量可以通过散热及时释放到环境中,因此,电芯表面温度到达环境温度后保持不变;烤箱温度为275℃时,负极和电解液的反应、电解液的分解反应均在200 s附近出现放热过程,电芯出现小幅快速升温;800 s附近,正极与电解液的反应开始进行,放出大量的热,热生成速率很大,热量在短时间内无法释放到环境中,电芯温度急剧升高,最终可能导致热失控。
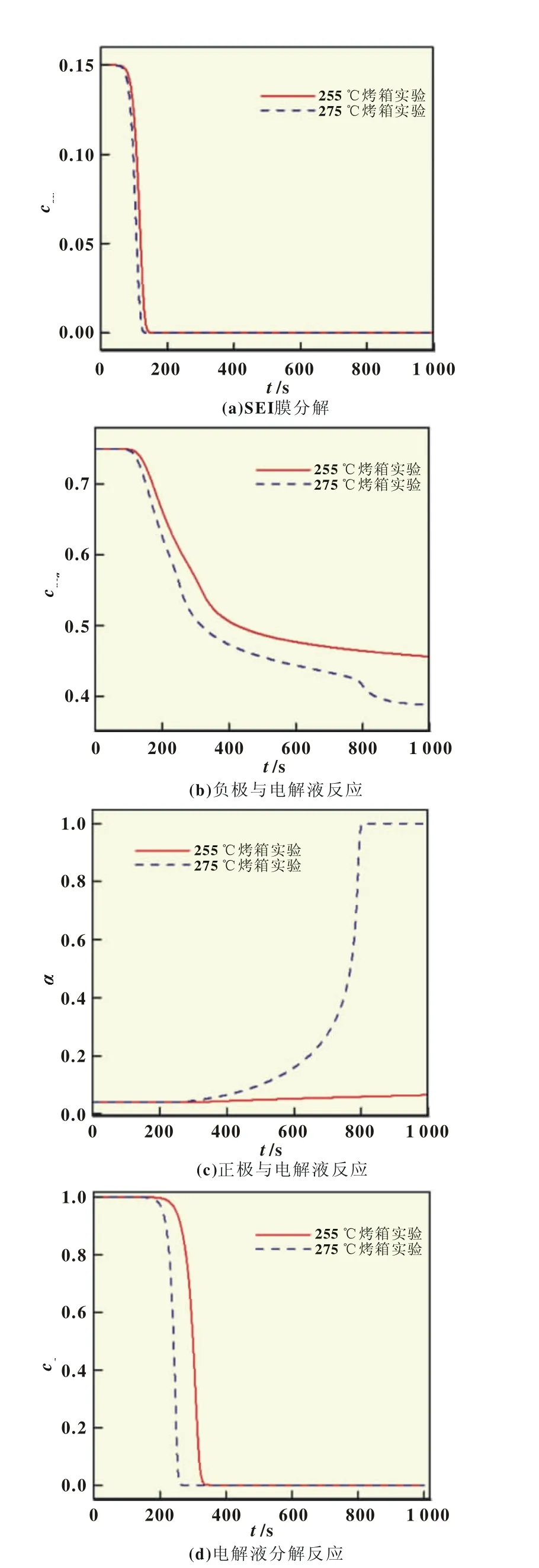
图5 255和275℃烤箱中电芯内部反应进行程度比较
进一步对比上述两过程中不同反应的热生成速率,如图6 (a)所示,在烤箱温度为255℃时,正极与电解液未发生反应;固液膜分解反应在80 s附近开始发生,热生成速率峰值在110 s附近,放热量在反应结束时减小到0;电解液分解反应在200 s附近开始,在300 s左右达到峰值,随后急剧下降;负极与电解液的反应较平缓,分别在180和310 s附近出现峰值。其中,放热量最大的反应是电解液的分解反应,最大热生成速率达1.8 W。如图6(b)所示,除正极与电解液反应的放热量在800 s左右出现峰值外,275℃烤箱实验的各反应的变化趋势与255℃烤箱温度下的一致。放热量最大的反应是正极和电解液的反应,最大值可达到8.7 W。因此,正极与电解液的反应是造成热失控的主要热量来源。
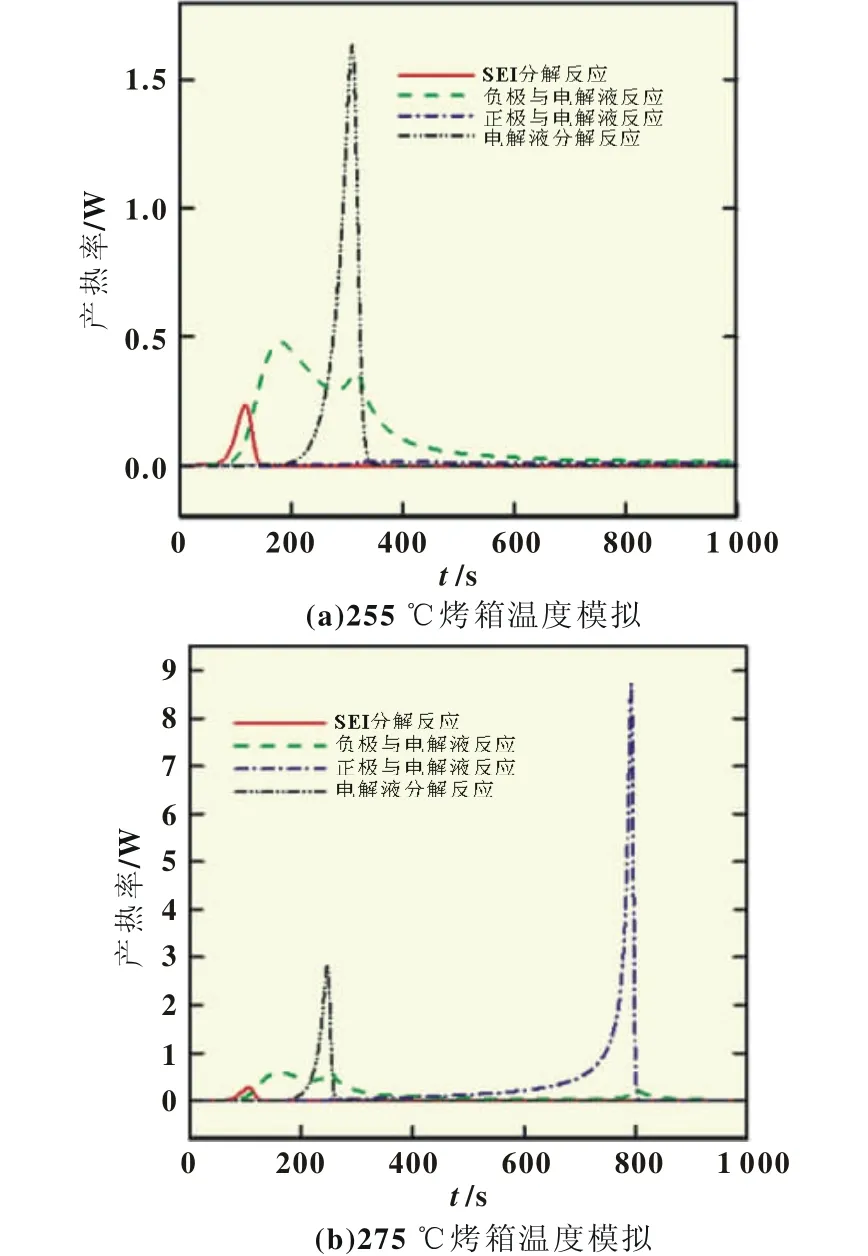
图6 LiMn2O4电池电芯在255和275℃烤箱温度下不同热源的热生成速率
3 结论
本文借助锂离子电池烤箱热滥用的热模型,模拟五种不同正极材料与电解液反应时的反应程度变化与热生成速率的变化。在此基础上,对五种不同正极材料对应的锂离子电池进行烤箱热滥用数值模拟,模拟单层电芯在不同烤箱温度下的温度变化。
模拟结果显示,LiCoO2、LiNi0.8Co0.15Al0.05O2、Li1.1(Ni1/3Co1/3-Mn1/3)0.9O2、LiMn2O4、LiFePO4五种不同正极材料与电解液发生完全反应的临界温度分别为:175、200、255、270和260℃,完全反应的放热速率分别为:7、53、80、50、1.6 W。与电解液完全反应的临界温度越高,材料的热稳定性越好;完全反应的放热速率越小,材料的热安全性越高。因此,LiMn2O4的热稳定性最高,而LiFePO4的热安全性最好。
通过对LiMn2O4电池烤箱热滥用模拟中不同反应的反应程度和热源分析发现,温度升高时,反应程度的加剧导致热生成速率升高,当热量无法及时散发到环境中时就可能会发生热失控。热生成速率最大的反应是正极和电解液的反应,并且放热量远远大于另外三个反应。由此推断,正极与电解液的反应是造成热失控的主要热量来源。
正极材料的热稳定性和热安全性差异是造成不同正极材料锂电池在热滥用模拟中温度变化不同的主要原因。采用热稳定性好、热安全性高的正极材料能够有效阻止锂电池热失控的发生。
[1] VELUCHAMY A,DOH C H,KIM D H,et al.Thermal analysis of LixCoO2cathode material of lithium ion battery[J].J Power Sources, 2009,189:855-858.
[2] MACNEIL D D,DAHN J R.The reaction of charged cathodes with nonaqueous solvents and electrolytes:II LiMn2O4charged to 4.2 V [J].J Electrochem Soc,2001,148(11):A1211-A1215.
[3]BELHAROUAK I,VISSERS D,AMINE K.Thermal stability of the Li(Ni0.8Co0.15Al0.05)O2cathode in the presence of cell components[J]. J Electrochem Soc,2006,153(11):A2030-A2035.
[4] KIM G,PESARAN A,SPOTNITZ R.A three-dimensional thermal abuse model for lithium-ion cells[J].J Power Sources,2007,170: 476-489.
[5] LAI P F,YE Q,QU B,et al.Thermal abuse model of lithium ion cells and experimental validation[J].Chinese Journal of Power Sources,2012,36:71-74.
[6]彭鹏,孙忆琼,蒋方明.钴酸锂电池烤箱热滥用模拟及热行为分析[J].化工学报,2014,65(2):647-657.
[7] GUO G F,LONG B,CHENG B,et al.Three-dimensional thermal finite element modeling of lithium-ion battery in thermal abuse application[J].J Power Sources,2010,195:2393-2398.
[8]LAMPE-ONNERUD C,SHI J,CHAMBERLAIN R,et al.Benchmark study on high performing carbon anode materials[C]//Proceedings of the 16th Annual Battery Conference on Applications and Advances.Long Beach,CA:IEEE,2001:133-136.
[9]VENKATACHALAPATHY R,LEE C W,LU W,et al.Thermal investigations of transitional metal oxide cathodes in Li-ion cells[J]. Electrochem Commun,2000(2):104-107.
[10] LU W,LEE C W,VENKATACHALAPATHY R,et al.Electrochemical and thermal behaviour of LiNi0.8Co0.2O2cathode in sealed 18650 Li-ion cells[J].J Appl Electrochem,2000(30):1119.
