退火处理与小麦淀粉酶解机理的相关性*
2015-11-20于鲲霍晓慧许阳杜先锋
于鲲,霍晓慧,许阳,杜先锋
(安徽农业大学茶与食品科技学院,安徽合肥,230036)
退火处理是指一定水分含量(40%~90%)的淀粉在高于其玻璃化温度且低于其糊化温度环境下,经加热处理后而引起其结构及性质改变的物理修饰过程[1]。退火处理增强了无定形区直链淀粉分子链段的流动,进而引起分子的重排[2],形成直链-直链淀粉分子和直链-支链淀粉分子局部双螺旋结构[3]。可见退火改变了淀粉的原结晶结构,必引起其物理化学特性的改变。
谷物淀粉颗粒由交替的半结晶区和无定形区组成,而结晶区主要由支链淀粉的双螺旋形成,而不是直链淀粉[4]。淀粉颗粒的通道主要分布在半结晶区和无定形区,这些通道与淀粉糊化时直链淀粉的释放有密切关系,而且孔洞可能很容易被酶侵蚀,影响淀粉颗粒的酶解特性[5-7]。谷物淀粉中小麦淀粉最为常见,其酶解特性的研究为谷物食品在人体内消化特性的研究提供了依据。
退火处理除了可以改善淀粉类食品的品质如面包的抗老化性、面团的筋力外[8],对淀粉颗粒的酶解作用也会产生影响。本研究通过退火处理,对淀粉颗粒结构进行物理修饰,采用差示量热扫描仪(DSC)[9]、电子扫描显微镜(SEM)、X-衍 射(XRD)[10]对其结构和性质进行表征,建立基于淀粉的酶解机理与淀粉颗粒结构的对应关系,探究退火处理与小麦淀粉酶解机理的相关性提供理论指导。
1 材料与方法
1.1 材料与仪器
小麦淀粉:Sigma公司;葡萄糖淀粉酶:酶活力为120 U/mg,来源于黑曲霉;α-淀粉酶:酶活力为50 U/mg,来源于猪胰腺;其他试剂均为分析纯。
DSC 8000,美国 PE公司;UV-5500紫外可见分光光度计,上海元析仪器有限公司;MS-2000激光粒度分析仪,英国Malvern仪器;TTR-ⅢX射线衍射仪,日本Rigaku理学公司;JSM-6490LV扫描电子显微镜,日本电子公司。
1.2 实验方法
1.2.1 退火小麦淀粉样品的制备
将小麦淀粉配制成60%水分含量的淀粉乳分别放置在 35、40、45、50 ℃ 条件下分别退火 0.5、4、12、24、48 h后取出冷却,室温干燥至接近原淀粉水分含量,研磨过 200 目筛后密封保存[8,11]。
1.2.2 原小麦淀粉与退火小麦淀粉的酶解[7]
酶解研究选用葡萄糖淀粉酶和α-淀粉酶2种酶分别对处理样品进行酶解,称取1~2 g的原淀粉、退火处理样品于磨口三角瓶中加入95 mL的缓冲溶液在40℃以1 500 r/min的转速搅拌保温10 min后加入两种酶反应。葡萄糖淀粉酶酶解中使用的缓冲液是20 mmol/L pH 4.5的双乙酸钠缓冲溶液,α-淀粉酶酶解中使用的缓冲液是20 mmoL/L pH 6.9的磷酸盐缓冲溶液。酶解过程中的加酶量均为200 U。每隔一定时间取出5 mL的酶解液加20%NaOH 0.1 mL灭酶并立即冷却离心,利用3,5-二硝基水杨酸法测定其中还原糖的含量。酶解后剩余的淀粉在室温下烘干后研磨过200目筛回收待测。
1.2.3 酶解小麦淀粉颗粒的热力学特性[9]
利用差示量热扫描仪(DSC)测定退火处理淀粉酶解后的热力学特性。用铟和锌校正仪器,测量时以空的铝坩埚为参照。准确称量25%的待测淀粉乳7.0~10.0 mg于铝坩埚内密封,4℃静置过夜。扫描程序是从20℃到120℃以10℃/min的速度升温。利用仪器配备的软件自动计算出淀粉的糊化起始温度(T0)、峰值温度(TP)、终止温度(TC)及糊化焓(△H)。
1.2.4 酶解小麦淀粉的颗粒形貌
利用扫描电子显微镜(SEM)观察原淀粉、退火淀粉和不同退火处理样品酶解后的颗粒形貌变化。将所有待测样品研磨后过200目筛,轻轻敷在专用的双面胶上,用洗耳球吹散使其均匀分布,将固定好的样品放入镀金器中喷金2次,每次50 s。测定时选用3 kV电子枪加速,选定合适的放大倍数拍照[10]。
1.2.5 酶解小麦淀粉颗粒结晶性质分析[13]
使用Rigaku TTR-III X射线衍射装置测定原淀粉、退火淀粉和不同处理样品酶解后的结晶型及结晶度。将处理样品均研磨过200目筛,将样品倒于样品板上至稍有堆起,在其上用玻璃板紧压。衍射条件选择X-衍射管为铜对阴极,Ni过滤器,电压40 kV,电流200 mA,扫描速率为8°/min,测量范围为2θ=3°~50°。根据所得X射线衍射图谱,划分结晶区和非晶区并进行面积积分后进行结晶度的计算:
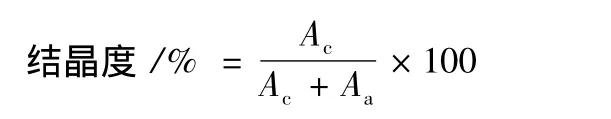
式中:Ac,X射线衍射图上结晶区面;Aa,X射线衍射图上非晶区面积。
2 结果与分析
2.1 不同退火时间处理的小麦淀粉经两种酶酶解后生成还原糖的速率对比
由图1和图2可以看出,经过退火处理小麦淀粉的酶解速率明显高于原小麦淀粉,且随着退火处理时间的变化,酶解速率也有所不同。退火时间4 h时小麦淀粉的酶解速率最高,WANG等在研究葡萄糖淀粉酶和α-淀粉酶对西米淀粉颗粒的酶解过程的影响中表明退火之后淀粉的酶解变得更加容易,原因是由退火处理破坏了结晶区和无定形区之间的氢键且使其无定形区轻微的膨胀[14]。Nakazawa等研究表明退火使得淀粉的水解率变快且使得淀粉形成了一种更易被渗透的结构,这种结构可能导致其酶解速率的加快[15]。低于4 h退火的小麦淀粉的酶解速率与原小麦淀粉无明显区别,淀粉是大分子聚合物,其内部结构的改变是通过链段运动形成的,链段之间的聚合与时间的关系服从 Avrami方程[16],可以解释0.5 h退火小麦淀粉的酶解率与原小麦淀粉的无明显区别。而退火时间高于4 h时小麦淀粉的酶解速率会随时间的增加而降低并逐渐趋近于原小麦淀粉。淀粉分子在水分子的作用下发生重排,而随退火时间增加直链淀粉与支链淀粉的排布更加紧密,形成更加坚固的直链-直链与直链-支链的双螺旋结构,使得淀粉颗粒的酶解通道较少,酶解变得缓慢。
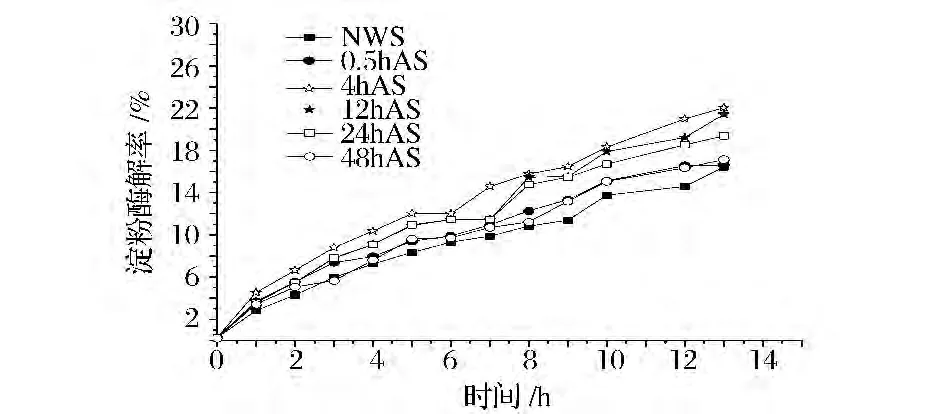
图1 退火时间变化对葡萄糖淀粉酶酶解小麦淀粉速率的影响Fig.1 Effects of annealing time on EHRs of wheat starches by glucoamylase
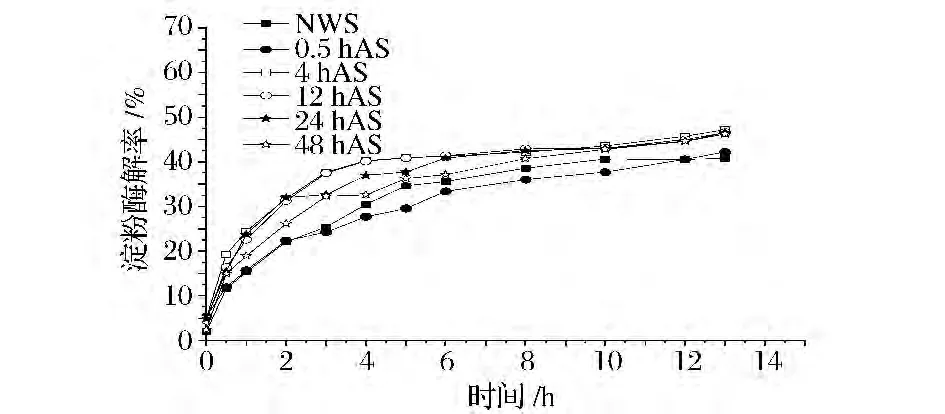
图2 退火时间变化对α-淀粉酶酶解小麦淀粉速率的影响Fig.2 Effects of annealing time on EHRs of wheat starches by α-amylase
2.1 不同退火温度处理的小麦淀粉经两种酶酶解后生成还原糖的速率对比
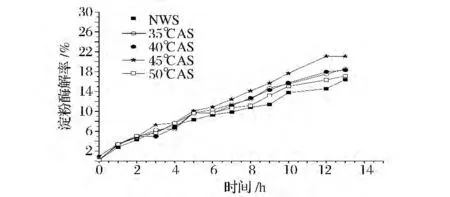
图3 退火温度变化对葡萄糖淀粉酶酶解小麦淀粉速率的影响Fig.3 Effects of annealing temperature on EHRs of wheat starches by glucoamylase
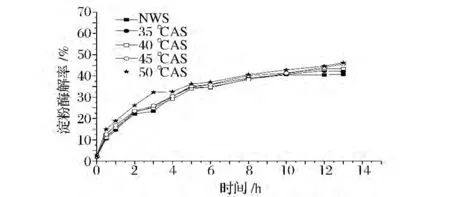
图4 退火温度变化对α-淀粉酶酶解小麦淀粉速率的影响Fig.4 Effects of annealing temperature on EHRs of wheat starches by α-amylase
图3和图4是不同退火温度处理的淀粉与原淀粉的酶解速率对比。经过退火处理淀粉的酶解速率明显高于原淀粉,且不同退火温度淀粉的酶解速率之间也存在一定的差异。Tester和Debon研究表明,淀粉经退火之后虽无定形区和结晶区变得更加完善,但可能经退火之后淀粉颗粒酶解通道被打开使其更易受到酶的攻击[1]。退火处理的温度越高淀粉的酶解速率越高,35、40℃退火处理淀粉基本无差别,对于淀粉这样的大分子温度在其分子的运动中起关键的作用,温度越高分子运动越剧烈[17]。也就是在退火处理过程中温度的升高加剧了无定形区直链淀粉分子的链段运动[18],使得淀粉充分溶胀,淀粉的酶解通道被扩大酶攻击位点暴露,使淀粉的酶解速率加快。相反,温度低则淀粉分子在相同的时间内不能够充分溶胀,无定形区直链淀粉的链段运动受限[18],导致低温处理的退火淀粉的酶解速率相对于高温的低。
2.3 酶解淀粉颗粒的热力学特性结果
表1是利用DSC测定的原淀粉和不同退火条件处理的淀粉酶解前后的糊化特性。原淀粉和退火淀粉经酶解后的糊化峰值温度均有所升高,且酶解后淀粉的糊化焓与未酶解淀粉相比大体呈现降低趋势。随着退火处理的持续,较弱或不完善的结晶会逐渐消失,余下的结晶由于重结晶和熔融而变得更加完善[18]。在淀粉糊化的特征参数中,糊化起始温度(T0)代表淀粉颗粒内部有序性最微弱微小结晶熔融温度,退火增强微晶的有序性,引起其糊化起始温度(T0)和糊化峰值温度(TP)均有升高。酶解后淀粉的TP升高代表酶解促进了淀粉结晶区的熔融,酶解后的淀粉颗粒的熔融是无定形区和结晶区同时进行的。而随退火时间的延长和退火温度的升高,酶解后淀粉颗粒的糊化峰值温度与酶解前的差距越来越小,说明经过退火处理的淀粉的熔融开始主要是在无定形区。退火处理提高了TP及使得淀粉的糊化温程变窄,而酶解的原淀粉和退火淀粉颗粒仍保持着这样的热学特性。研究发现酶解后的淀粉颗粒的糊化焓明显降低是因为淀粉的结晶结构和双螺旋-结构在酶解过程中被破坏[7,14]。而退火淀粉酶解后的糊化焓会因其退火条件的不同而有不同程度的升高或降低,说明退火处理淀粉在酶解过程中仍保持其退火后的特性。α-淀粉酶与葡萄糖淀粉酶相比在相同时间内对淀粉颗粒的作用效果更明显。
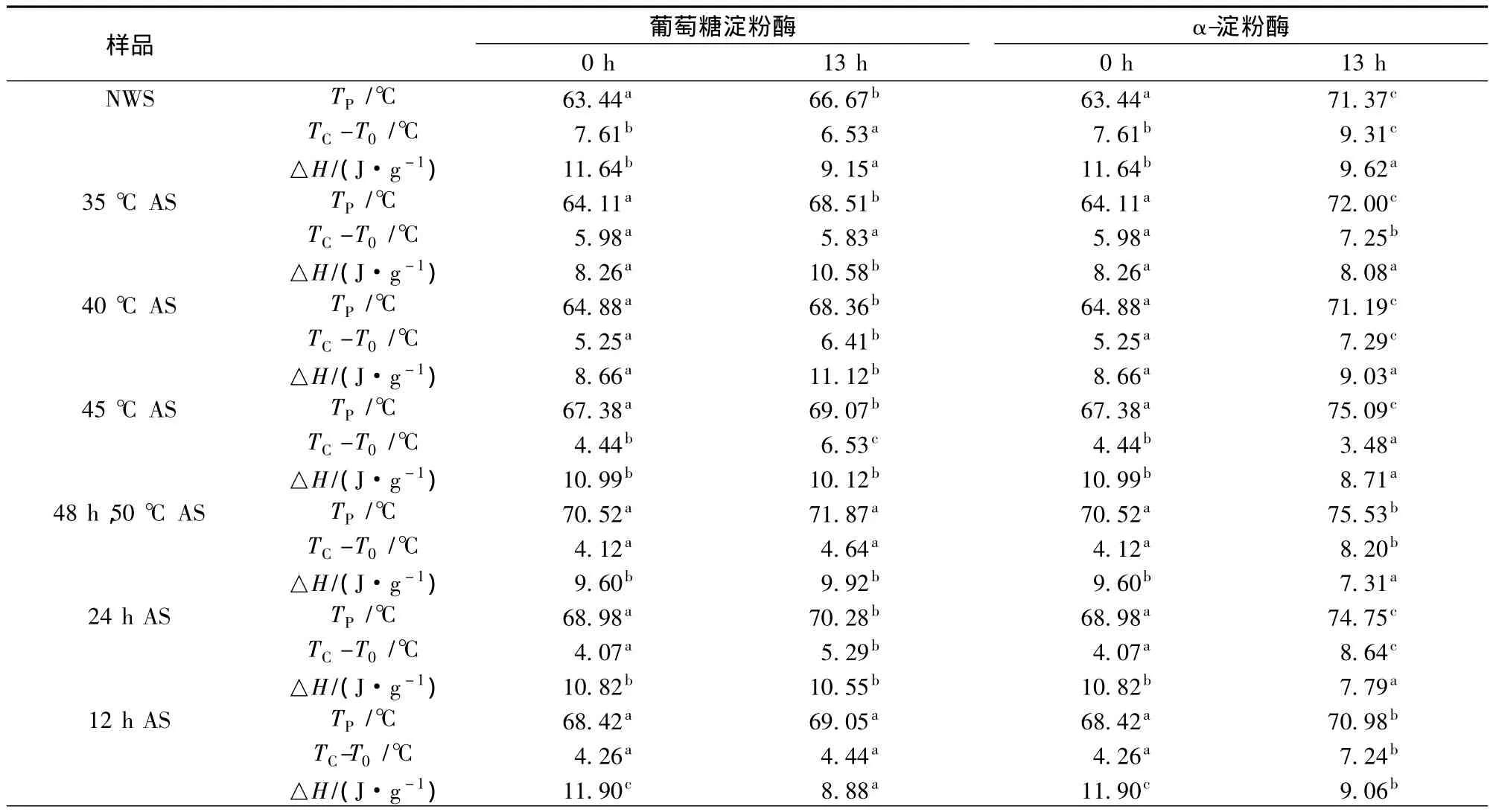
表1 原淀粉和退火淀粉水解后的糊化特性Table 1 Gelatinization properties of hydrolyzed native and annealed starches by glucoamylase and α-amylase
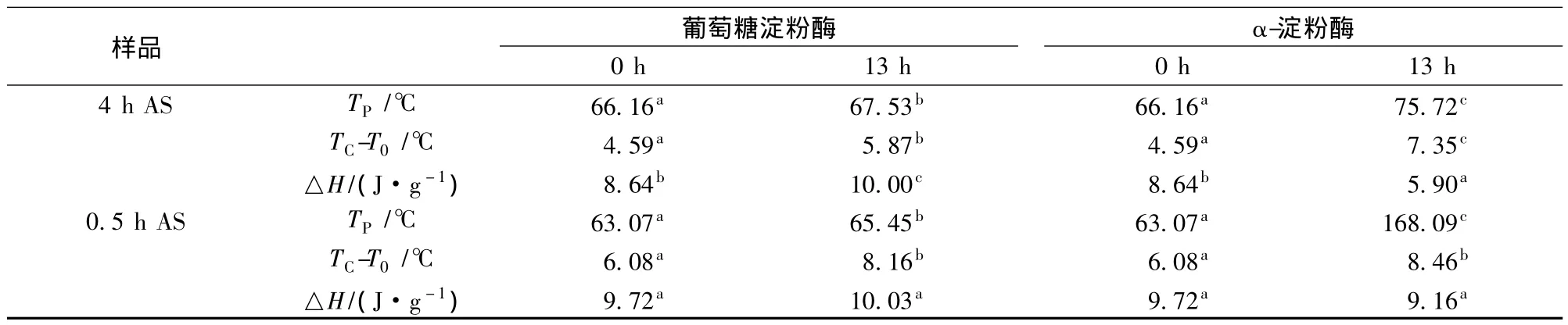
续表1
2.4 酶解后淀粉颗粒的形貌图
图5和图6分别是经葡萄糖淀粉酶和α-淀粉酶酶解13 h后的不同淀粉样品的电镜图。退火后的淀粉颗粒形貌与原淀粉相比基本无变化,且各酶解淀粉样品的电镜图也无明显区别。通过电镜图可以得出α-淀粉酶对淀粉酶解的效果更加明显,且两种酶对原淀粉和退火淀粉的酶解作用位点并无改变。两种酶均是从淀粉颗粒赤道沟附近的特殊区域开始水解并以点状开始很快下陷,并逐渐扩大,形成一个通道进入淀粉颗粒内部,导致小麦淀粉颗粒由椭球形变成扁球形。
2.5 酶解前后淀粉颗粒的结晶结构

图5 葡萄糖淀粉酶酶解原淀粉与不同退火条件处理淀粉的13 h后电镜图原淀粉(a,b),35 ℃退火48 h的淀粉(c,d),45 ℃退火48 h 的淀粉(e,f),50 ℃退火48 h的淀粉(g,h),50 ℃退火4 h的淀粉(m,n);放大倍数为1 500 ×(a,c,e,g,m)和5 000 ×(b,d,f,h,n)Fig.5 SEM photographs of native and annealed wheat starches hydrolyzed by glucoamylase for 13 h

图6 α-淀粉酶酶解原淀粉与不同退火条件处理淀粉的13 h后电镜图原淀粉 (a,b),35℃退火48 h的淀粉 (c,d),45℃退火48 h的淀粉(e,f),50℃退火48 h的淀粉(g,h),50℃退火4 h的淀粉(m,n);放大倍数为1 500×(a,c,e,g,m)和 5 000 × (b,d,f,h,n)Fig.6 SEM photographs of native and annealed wheat starches hydrolyzed by α-amylase for 13 h
核磁共振研究表明[20-21],淀粉颗粒内的结晶片层是由支链淀粉的双螺旋形成的,支链淀粉的支点位于无定形区。X-衍射的结果表明经过退火的小麦淀粉的相对结晶度高于原淀粉,退火处理促进无定形区直链淀粉分子的流动,并使其与支链淀粉形成双螺旋结构,导致淀粉的相对结晶度的升高(图7)。酶解之后的淀粉的X-衍射图的峰强度明显降低,且经过退火之后的淀粉酶解颗粒与原淀粉酶解颗粒相对结晶度有明显的差别(图7和表2)。退火处理淀粉酶解颗粒的结晶度明显高于原淀粉酶解颗粒的无论是葡萄糖淀粉酶酶解还是α-淀粉酶酶解(表2),可能的原因是经过退火后的淀粉颗粒的半结晶片层中的无定形区直链-直链或直链-支链双螺旋结构的形成阻碍了结晶片层酶解,使得无定形区大部分酶解,导致相对结晶度的升高。而原淀粉则可能是结晶层与无定形层同时酶解,相对结晶度升高的速率相对较慢。这个结果与前面退火之后淀粉的酶解速率高于原淀粉的结果和DSC测的热学特性结果均基本一致。
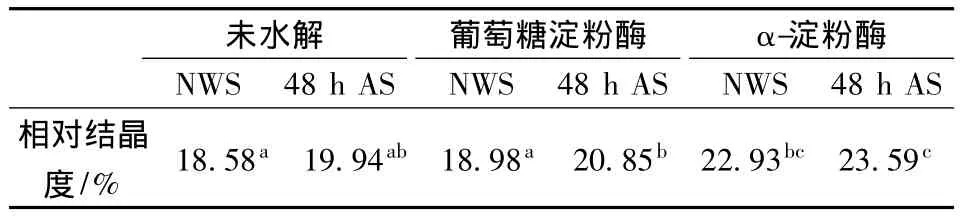
表2 原淀粉与48 h退火淀粉酶解前后结晶度对比Table 2 Relative crystallinity of native and annealed wheat starches after glucoamylase and α-amylase for 13 h
3 结论
试验表明,退火处理小麦淀粉的酶解速率比原淀粉的更快,且不同退火条件处理的小麦淀粉的酶解速率也有差异。退火时间的变化对淀粉颗粒的酶解速率的影响较为显著,退火4 h的淀粉颗粒的酶解速率明显高于原淀粉。而温度变化时高温退火处理的淀粉酶解速率较低温处理淀粉的高。退火处理降低了淀粉酶解前后的糊化峰值温度差距,且退火淀粉酶解颗粒的熔融开始主要在无定形区。退火处理前后的小麦淀粉颗粒酶解电镜图无明显差异,只是相同酶解时间α-淀粉酶的作用效果高于葡萄糖淀粉酶。退火提高了原淀粉的相对结晶度,且退火淀粉酶解颗粒的相对结晶度高于原淀粉酶解颗粒的相对结晶度。
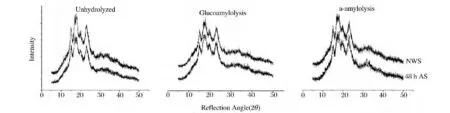
图7 原淀粉与48 h退火淀粉酶解前后的X-衍射图Fig.7 X-ray diffraction patterns of unhydrolyzed and hydrolyzed native and annealed wheat starches
[1]R.F.Tester SJ,J Debon,Sommerville M D.Annealing of maize starch[J].Carbohydrate Polymers,2000,42(3):287 -299.
[2]Varatharajan Vamadevan,Eric Bertoft,Dmitriy V.Soldatov,et al.Impact on molecular organization of amylopectin in starch granules upon annealing[J].Carbohydrate Polymers,2013,98(1):1 045 -1 055.
[3]Jayakody L,Hoover R.Effect of annealing on the molecular structure and physicochemical properties of starches from different botanical origins-A review[J].Carbohydrate Polymers,2008,74(3):691 -703.
[4]二国二郎.淀粉科学手册[M].北京:轻工业出版社,1997:31-54.
[5]Fuwa H,SugimotoY,Nikuni T.Scanning electron microscopy of starch granules,with or without amylases attack[J].Carbohydr Res,1979,70(2):233 -238.
[6]Thais S,Rocha,Verena A G.Structural characterization of peruvian carrot(Arracacia xanthorrhiza)starch and the effect of annealing on its semicrystalline structure[J].Journal of Agriculture and Food Chemistry,2011,59:4 208 - 4216.
[7]Stephen O’Brien,Ya-Jane Wang.Susceptibility of annealed starches to hydrolysis by α-amylase and glucoamylase[J].Carbohydrate Polymers,2008,72:597 -607.
[8]王一见,杜先锋,许阳,等.小麦淀粉的退火改性及其性质表征[J].中国农业科学,2013,46(12):2 526 -2 533.
[9]Krueger B R,Knutson C A,Inglett G E,et al.A differential scanning calorimetry study on the effect of annealing on gelatinization behavior of corn starch[J].Journal of food science,1987,52(3):695 -698.
[10]Valentina I K ,Alexei V K ,Jozef F,et al.Annealing of normal and mutant wheat starches LM,SEM,DSC,and SAXS studies[J].Carbohydrate Research,2005,340(1):75 -83.
[11]Shi Yong-cheng.Two-,multi-step annealing of cereal starches in relation to gelatinization[J].Journal of Agriculature and Food Chemistry,2008,56(3):1 097 -1 104.
[12]Rudi Vermeylen,Bart Goderis,Jan A D.An X-ray study of hydrothermally treated potato starch[J].Carbohydrate Polymers,2006,64(2):364 -375.
[13]Bruna K,Vânia Z P,Nathan L V,et al.Effect of single and dual heat– moisture treatments on properties ofrice,cassava,and pinhao starches[J].Carbohydrate Polymers,2013,98:1 578 -1 584.
[14]Wang W J,Powell A D,Oates C G.Effect of annealing on the hydrolysis of sago starch granules[J].Carbohydrate Polymers,1997,33(2):195 -202.
[15]Jakazawa Y,Wang Y.Acid hydrolysis of native and annealed starches and branch-structure of their Naegeli dextrins[J].Carbohydrate Research,2003,338(24):2 871 -2 882.
[16]杜先锋,宛晓春,许时婴,等.葛根淀粉老化动力学的研究[J].中国农业科学,2002,35(9):1 145-1 149.
[17]何曼君,张红东,陈维孝,等.高分子物理[M].上海:复旦大学出版社,2007:130-136.
[18]Waduge R.,Hoover R.,Vasanthan T.et al.Effect of annealing on the structure and physicochemical properties of barley starches of varying amylose content[J].Food Research International,2006,39(1):59 -77.
[19]Ambigaipalan P,R Hoover E,Donner Q L.Starch chain interactions within the amorphous and crystalline domains of pulse starches during heat-moisture treatment at different temperatures and their impact on physicochemical properties[J].Food Chemistry,2014,143:175 -184.
[20]Moru Y,Keiji K,Dexter F.Electron Microscopic Observations of Waxy Maize Starch[J].Journal of Ultrastructure Research,1979,69(2):249 -310.
[21]Athene M,Donald K,Lisa Kato,et al.Scattering studies of the internal structure of starch granules[J].Starch/Starke,2001,53(10):504 -512.
