牛奶β-乳球蛋白质实时荧光定量PCR检测方法的建立
2015-11-20贾敏张银志张亦凡孙秀兰
贾敏,张银志,张亦凡,孙秀兰*,
(1.江南大学食品学院,江苏无锡 214122;2.食品科学与技术国家重点实验室,江南大学,江苏无锡 214122;3.汉中市产品质量监督检验所,陕西汉中 723000)
牛奶β-乳球蛋白质实时荧光定量PCR检测方法的建立
贾敏1,张银志2,张亦凡3,孙秀兰*1,2
(1.江南大学食品学院,江苏无锡 214122;2.食品科学与技术国家重点实验室,江南大学,江苏无锡 214122;3.汉中市产品质量监督检验所,陕西汉中 723000)
建立一种快速、特异、灵敏的Taqman实时荧光定量PCR(real-time PCR)方法,用于牛奶主要过敏原β-乳球蛋白质的检测。根据GenBank登录的牛β-乳球蛋白质的DNA序列设计,合成一对特异性引物和探针。将扩增产物连接到pMD19-T载体上,制备质粒标准品并测序鉴定,10倍梯度稀释含有β-乳球蛋白质基因的重组质粒,进行实时荧光定量PCR扩增,绘制标准曲线,检测该方法的特异性、稳定性、灵敏性,同时将建立的方法用于10种市售食品的检测。成功建立了β-乳球蛋白质的实时荧光定量PCR检测方法,标准曲线的Ct值与模板浓度在3.18× 103~3.18×107copies范围内线性关系良好,R2值为0.997 8;检测灵敏度高(318 copies/μL);特异性强,对羊奶、豆浆DNA均无扩增反应;稳定性好,组内、组间的变异系数均在5%以内。对10种食品牛奶过敏原的检测结果与标签相符。表明所建立的实时荧光定量PCR方法可应用于食品中牛奶过敏原β-乳球蛋白质的检测并可推广到其它过敏原的检测。
牛奶过敏原质;β-乳球蛋白质;Taqman实时荧光定量PCR法;检测
牛乳及乳制品是常见的八大食物过敏原之一,牛乳过敏(CMA)是由于摄入乳或含有乳制品的食物而引起的异常免疫反应,尤其影响婴幼儿及儿童(3岁以内)的身体健康,其发病率高达7.5%[1-4]。牛乳致敏蛋白质主要有酪蛋白质、β-乳球蛋白质、α-乳白蛋白质以及牛血清蛋白质等,其中β-乳球蛋白质被认为是其中重要的致敏蛋白质之一[5]。β-乳球蛋白质是一种重要的乳清蛋白质,约占牛乳总蛋白质的十分之一,其一级结构含有162个氨基酸残基,分子量约为18.4 kDa,存在两种基本形式,分别为变异体A和B[6]。β-乳球蛋白质不存在于母乳中,且不能被胃蛋白酶消化水解,因此可通过胃肠道进入血液循环[7]。因而被认为是牛乳中最主要的过敏原,刺激婴儿免疫系统发生超敏反应。研究表明:约82%的牛乳过敏病人都对β-乳球蛋白质过敏[8]。
目前,β-乳球蛋白质检测方法主要有两种:直接检测致敏性蛋白质的免疫学方法,如放射性变应原吸附试验(RAST)[9],酶标记过敏原吸附抑制(EAST)[10],火箭免疫电泳法(RIE)[11],酶联免疫法(ELISA)[12];间接指示过敏原组分存在的特异性DNA片段,主要是PCR[13-14]。酶联免疫法(ELISA)可直接检测出致敏性蛋白质,具有快速、灵敏、可商业化等优点,是目前应用最广泛的过敏原检测法[15-17]。但逐渐发现ELISA存在以下缺点:特异性抗体难获得,复杂的生物基质容易导致假阳性,加工过程酶、温度、压力破坏蛋白质的结构。而近年来发展起来的实时荧光定量PCR技术以其定量准确、灵敏度高、特异性强、重复性好等优点,逐渐应用于食品安全检测。DNA比较稳定,食品加工对其影响较小,因而基于DNA的常规PCR和实时荧光定量PCR可以作为蛋白质检测的补充方法。目前许庆金[18]等人建立了基于β-乳球蛋白质基因的常规PCR定性检测方法,但还未见β-乳球蛋白质基因的Taqman探针实时荧光PCR检测方法的相关报道。因此,本试验针对牛奶β-乳球蛋白质的基因序列,设计特异性引物和探针,首次建立牛奶β-乳球蛋白质过敏原的Taqman探针实时荧光定量PCR检测方法,特异性检测食物中牛奶主要过敏原β-乳球蛋白质,并应用于市售食物中牛奶过敏原组分的快速检测,确保该方法的可靠性和准确性。
1 材料与方法
1.1 材料与试剂
鲜牛奶、饼干、蛋糕、饮料等食品,购于无锡欧尚超市。pMD19T-Vector Cloning Kit,PCR胶回收试剂盒,质粒DNA小量纯化试剂盒,2X PCR Master Mix,大连Takara公司提供;引物及探针(HPLC纯化),由上海生工生物工程有限公司合成;溴化乙锭(EB),TBE缓冲液,琼脂糖,上海生工生物工程有限公司产品;Tris-饱和酚、氯仿、乙醇及异戊醇等其它常规分析纯试剂,购自国药集团化学试剂有限公司;感受态菌,氨苄青霉素,LB培养基,由上海博仕生物医学服务中心(水源生物)提供。
1.2 仪器与设备
伯乐C1000TM型PCR仪,凝胶成像仪,美国Bio-rad(伯乐)公司制造;SLAN®全自动实时荧光定量PCR仪,上海宏石医疗科技有限公司制造;DYY-8C琼脂糖凝胶电泳仪,北京六一制造厂制造;TU-1900型双光束紫外可见分光光度计,北京普析通用仪器有限责任公司制造。
1.3 DNA的提取
参照田雨[19]、徐仙[20]等提取方法并稍加改动,提取市售鲜牛奶中的DNA:
1)取50 mL鲜牛奶置于4个100 mL的离心管中,4℃,12 000 r/min离心15 min,弃上清液,用棉球去除上层乳蛋白质和乳脂;
2)加入10 mmol/L PBS,溶解沉淀,4℃,12 000 r/ min离心10 min;
3)加入880 μL TEN(1 mL l mol/L Tris+0.2 mL 0.5mol/LEDTA+58gNaCl定容至100mL)和0.2moI/L NaOH溶液120 μL,悬浮沉淀并震荡混匀30 s,95℃条件下水浴8 min,期间颠倒混匀几次,4℃、12 000 r/ min离心10 min;
4)取上清液至灭菌离心管中,加入等体积的酚-氯仿-异戊醇(体积比25:24:1),剧烈震荡2~3 min,4℃,12 000 r/min离心10 min;
5)取上清液,加入等体积的氯仿,混匀,12 000 r/min离心10 min;
6)上清液移入灭菌离心管,加入等体积预冷异丙醇,慢慢上下颠倒30s,-20℃条件放置30min;12000r/ min离心2 min,管底部有可见的白色DNA沉淀;
7)白色沉淀以体积分数70%乙醇洗涤2次,用N2气吹干至无乙醇味;
8)加50 μL TE缓冲液溶解,测其浓度;
9)用CTAB[21-22]法进行牛奶饮料及饼干样品的DNA提取。
1.4 引物和探针
根据NCBI上已公布的牛奶过敏原,将β-乳球蛋白质(β-Lg)基因的核酸序列,充分考虑检测引物和探针的退火温度的一致性、GC含量的相似性等因素,采用Primer select软件设计合成检测牛奶β-乳球蛋白质成分的引物和Taqman-BHQ探针,PCR目标扩增片段长度为226 bp。通过GenBank的Blast功能寻找该引物和探针的同源性,结果显示该基因具有很高的特异性,其他基因与该基因的同源性较小。引物和探针的序列见下表1。
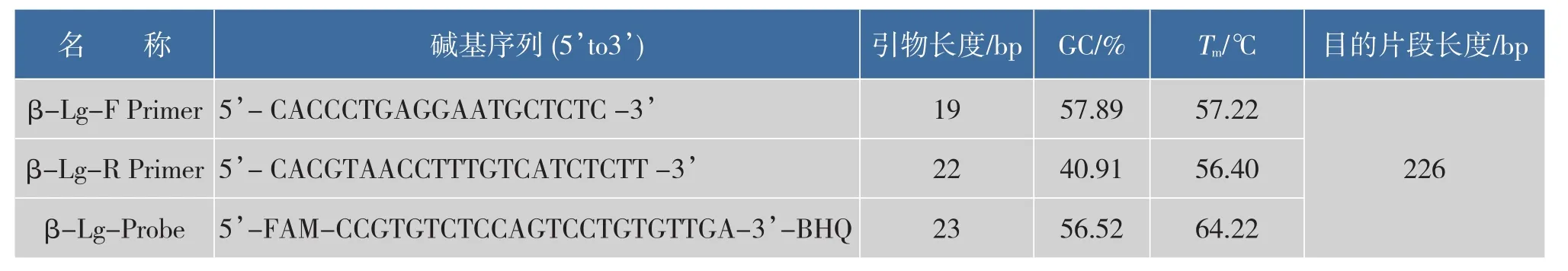
表1 扩增β-乳球蛋白质的引物和探针Table 1Primers and Probe sequence for PCR detection of β-lactoglobulin
1.5 牛奶定性PCR扩增和电泳检测
用上述引物对3种市售鲜牛奶DNA进行扩增,每种样品都设置了3种退火温度(50,55,60℃),PCR扩增总体系30 μL:PCR Mixture 2×Mix 15 μL,上下游引物各0.5 μL(10 μmol/L),DNA模板2 μL,余下体积用灭菌超纯水补足至30 μL。同时设置空白对照,即在30 μL PCR体系中用等量超纯水代替DNA模板。PCR反应条件为起始模板预变性95℃,3 min;循环体:变性95℃30 s,退火(50、55、60℃)30 s,延伸72℃30 s,30个循环;72℃延伸10 min。
将上述PCR产物利用琼脂糖凝胶电泳进行检测:将3 μL 6×Loading Buffer与6 μL PCR产物混合,加入质量分数1.5%琼脂糖凝胶点样孔中,在TBE电泳缓冲液中进行电泳,以DNA Maker 1000作为分子质量标准,100 V电泳45 min,凝胶成像仪观察结果。
1.6 目的基因与载体的连接、转化及鉴定
1.6.1 连接按试剂盒说明进行PCR胶回收纯化,以TaKara的pMD19-T vector作为载体进行连接,10 μL连接体系为:PCR回收片段4 μL,pMD19-T vector 1 μL,T4ligase 1 μL,10×T4ligase buffer 1 μL, dH2O 3 μL。16℃1 h,然后4℃过夜,第2天转化。
1.6.2 转化用氯化钙法将连接产物(10 μL)转入E.coli Top10感受态细胞中,冰浴30 min。42℃静止水浴45 s,再冰浴1 min。加入1 mL无抗性的LB,37℃,150r/min,复苏40min。12000r/min离心1min,去掉1 μL上清液,剩下的混匀涂于带有蓝白斑筛选氨苄抗性的培养板。培养板置培养箱,37℃过夜。
1.6.3 菌落PCR和测序鉴定以单菌落为模板进行阳性克隆菌落PCR扩增,反应条件同荧光定量PCR。琼脂糖电泳验证PCR扩增结果。将初步鉴定为阳性的菌落接种LBA液体培养基,37℃培养过夜,第2天抽提并纯化质粒DNA。重组质粒测序,验证重组质粒是否构建成功。其同源性比较采用Gene Bank中的BLAST进行分析。
1.7 实时荧光定量PCR
将重组质粒pMD19T-Lg用HindIII单酶切成线性化的标准模板质粒并定量,线性化质粒转化为相应的拷贝数为3.18×109,按10倍梯度稀释,选择3.18×103~3.18×107拷贝数标准品进行Taqman探针法实时荧光定量PCR扩增反应。定量PCR反应体系为:总体积30 μL,其中含2×qPCR mix 15 μL,上下游引物各0.5μL(10μmol/L),探针1μL(10μmol/L),模板DNA 2 μL,灭菌超纯水11 μL。实时荧光定量PCR运行条件同定性PCR优化好的条件:95℃3 min;94℃30 s;55℃30 s,72℃30 s检测荧光信号,30个循环,72℃保温10 min。以初始模板量对数值为横坐标,以循环阈值(Ct)为纵坐标绘制标准曲线。
1.8 实际样品检测
为对本研究中建立的Taqman探针实时荧光定量PCR方法的实用性进行考察,对10种食品牛奶过敏原β-乳球蛋白质进行检测。利用CTAB法对牛奶饮料及饼干基因组DNA进行提取,以提取的基因组DNA为模板进行实时荧光定量PCR扩增。利用标准曲线计算其β-乳球蛋白质过敏原基因拷贝数,利用检测限来判断实际样品是否含有牛奶β-乳球蛋白质过敏原。
2 结果与分析
2.1 牛奶基因组DNA的提取
经测定提取的DNA基因组的OD260/OD280在1.7左右,DNA纯度较好,浓度较高,可用于后续PCR扩增试验。见表2。
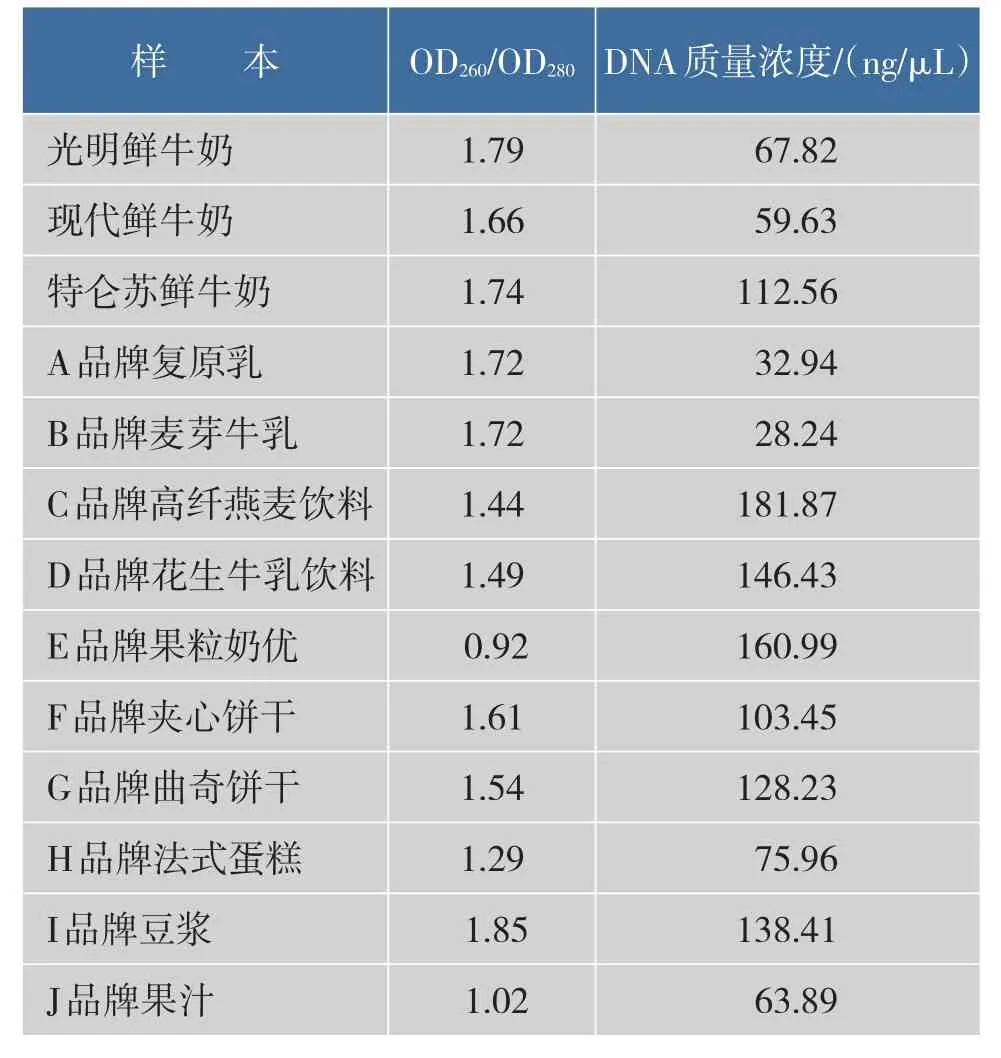
表2 样本基因组DNA测定值Table 2Detection results of DNA obtained from food samples
2.2 PCR定性分析
分别以提取的光明、现代、特仑苏鲜牛奶基因组DNA为模板进行定性PCR检测,PCR的电泳结果(图1)表明,通过本研究中设计的引物可从商业牛奶基因组DNA中扩增出牛的β-乳球蛋白质的预期条带,且退火温度为55℃时条带较亮,扩增效率较高,因此选用55℃进行后续定量的扩增实验。根据此结果将扩增得到的PCR条带进行割胶回收做T/A克隆,构建pMD19T-Lg载体。
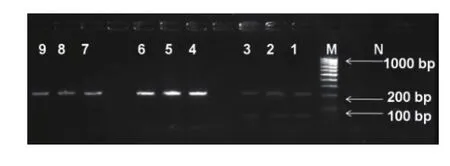
图1 不同牛奶基因组DNA及退火温度的定性PCR产物Fig.1PCR products from extracted genomic DNA of three commercial milk with different annealing temperature.
2.3 重组质粒的鉴定
连接产物转化后挑取5个单菌落进行菌落PCR鉴定,PCR产物经质量分数2%琼脂糖电泳。图2为菌落PCR扩增电泳结果,在226 bp处出现条带,与目的片段大小一致,初步判断为阳性克隆。

图2 重组质粒菌落PCR结果Fig.2Colony PCR analysis of the recombinant plasmid
选取亮度最大的1、2号菌落接种培养,提取质粒进行DNA序列测定,测序结果通过NCBI上的blast进行同源性比对分析。结果表明,克隆的序列与GenBank中已登录的牛的β-乳球蛋白质基因序列完全一致,同源性达到100%。说明插入的外源基因即为目的片段,即重组质粒构建成功。标准模板测序结果如图3所示。
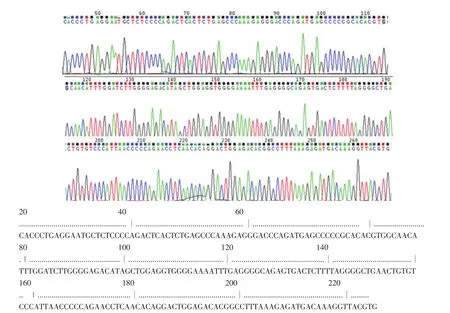
图3 标准模板β-乳球蛋白质基因片段DNA测序结果Fig.3DNA sequence analysis of β-Lg allergen gene fragment as a standard template
2.4 实时荧光定量PCR标准曲线
将重组质粒pMD19T-Lg用HindIII进行单酶切,回收线性化的质粒作为标准品。将质粒标准品10倍稀释作为扩增模板,每个梯度重复3次测定。实验结果表明,在3.18×107~3.18×103拷贝数范围内,Ct值与模板DNA分子的起始拷贝数的对数值呈良好的线性关系(见图4),以基因拷贝数的对数值为横坐标,以相应的Ct值为纵坐标作图,制作标准曲线,R2为0.997 8,标准曲线回归方程为
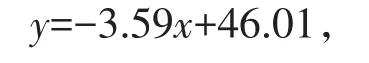
式中:y为循环阈值(Cycle Threshold,Ct);x为质粒DNA拷贝数对数值(见图5)。通过标准曲线方程和样品的Ct值便可计算出样品中所测组分DNA的含量。
2.5 方法学评价
2.5.1 灵敏度分析取β-Lg重组质粒标准品10倍梯度稀释(3,31,3.18×102,3.18×103,3.18×104,3.18× 105copies/μL),以其为模板进行实时荧光定量PCR扩增。结果显示,最小检测拷贝数属318 copies/μL的β-Lg样品。见图6。
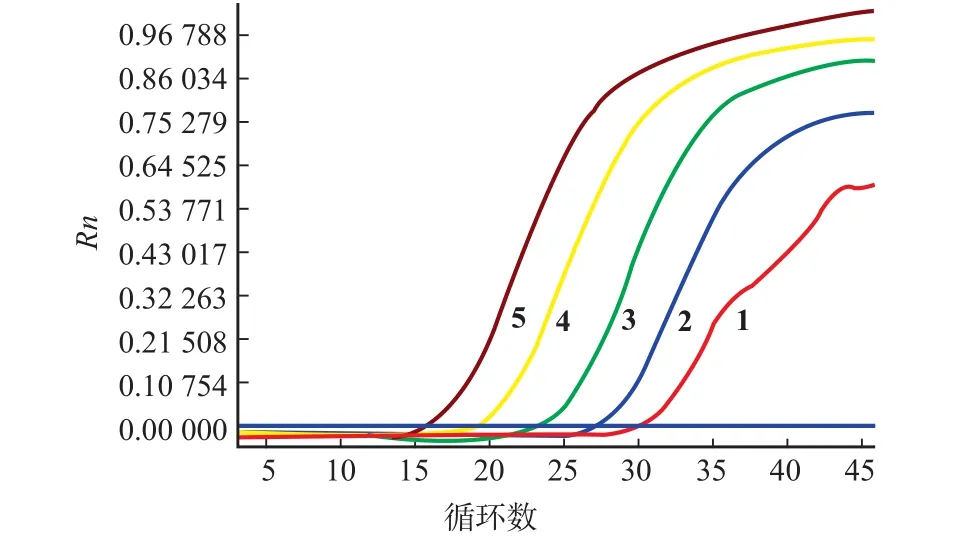
图4 标准模板质粒pMD19T-Lg DNA系列梯度的扩增曲线Fig.4Establishment of amplification curve for detection of α-La DNA template by Real-time PCR
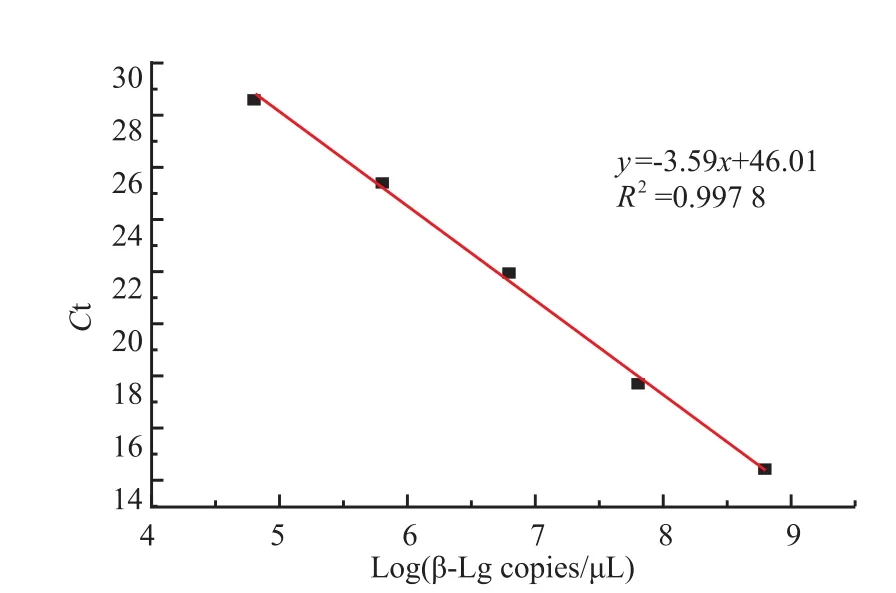
图5 牛奶β-乳球蛋白质Taqman实时荧光定量PCR标准曲线Fig 5Standard curve for detection of milk β-La gene by real-time PCR
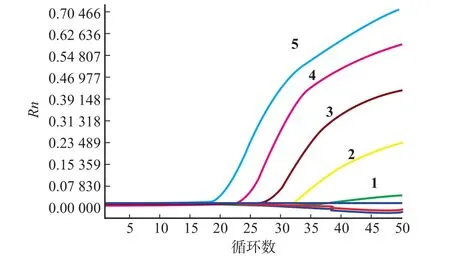
图6 荧光定量PCR灵敏度试验Fig 6Sensitivity tests of real-time PCR
2.5.2 特异性分析为考察所建立的Taqman探针荧光定量PCR检测法是否能特异性针对牛奶β-乳球蛋白质基因,以鲜牛奶基因组DNA为阳性对照,提取羊奶、豆浆,牛奶饮料、牛奶饼干食物基因组DNA,PCR扩增后进行质量分数2%琼脂糖凝胶电泳。见图7。结果显示,仅牛奶及奶制品食物基因组DNA扩增出目的片段,羊奶及豆浆基因组DNA扩增均成阴性。说明建立的实时荧光定量PCR具有较好的特异性。

图7 荧光定量PCR特异性试验Fig.7 Specificity tests of real-time PCR
2.5.3 重复性分析选择浓度为3.18×103、3.18× 105、3.18×107copies/μL的质粒标准品进行重复性实验。组内:同一时间同一反应条件下,对3个浓度的质粒标准品进行3次试验,分析组内重复性。组间:6 d内对3个浓度的标准品分别单独进行3次Taqman实时荧光定量PCR测定,分析组间重复性。结果如表3所示,变异系数CV均在5%以内,说明建立Taqman实时荧光定量PCR方法重复性较好。
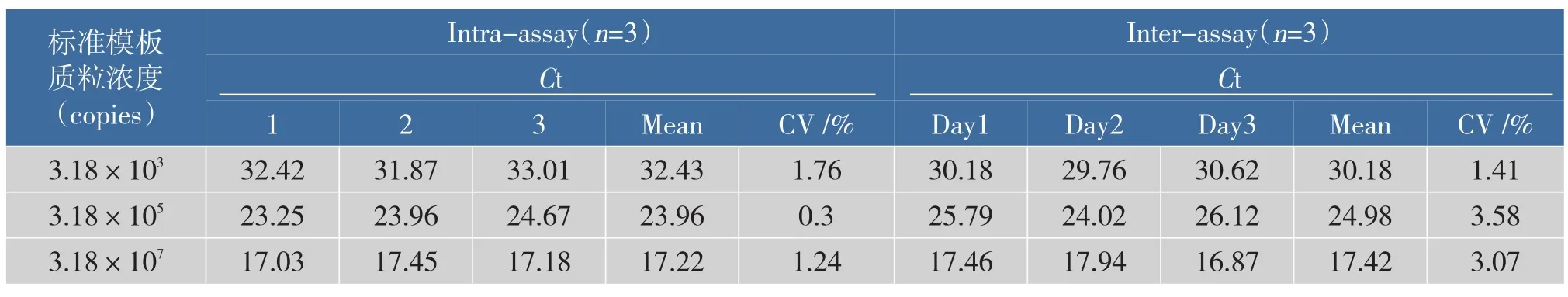
表3 荧光定量PCR的重复性结果Table 3Reproducibility test of the real-time PCR
2.6 实际样品检测
利用建立的荧光定量PCR方法对10种食品中的牛奶主要过敏原β-乳球蛋白质基因进行检测,以复原乳为阳性对照,ddH2O为阴性对照。利用田雨提取牛奶DNA法[19],对液体样品进行基因组DNA提取,利用改进的CTAB法对饼干等固体食品的基因组DNA进行提取,进行实时PCR扩增。根据本研究的灵敏度318 copies/μL来考察食品是否含有牛奶β-乳球蛋白质过敏原。表4为检测结果,8种标签标示牛奶过敏原的食品中7种β-乳球蛋白质检测呈阳性,其中果粒奶优虽然标示有牛奶,但是重复3次检测结果均为阴性,推断可能原因为果粒奶优饮料含有牛奶量较少或食品加工过程对DNA破坏较大,影响实时荧光定量PCR检测结果。豆浆及果汁检测结果均为阴性,与标示一致。检测结果表明,建立的荧光定量PCR法用于食品检测具有较高的准确性和可靠性,符合率达90%,可用于市售食品的牛奶过敏原检测。
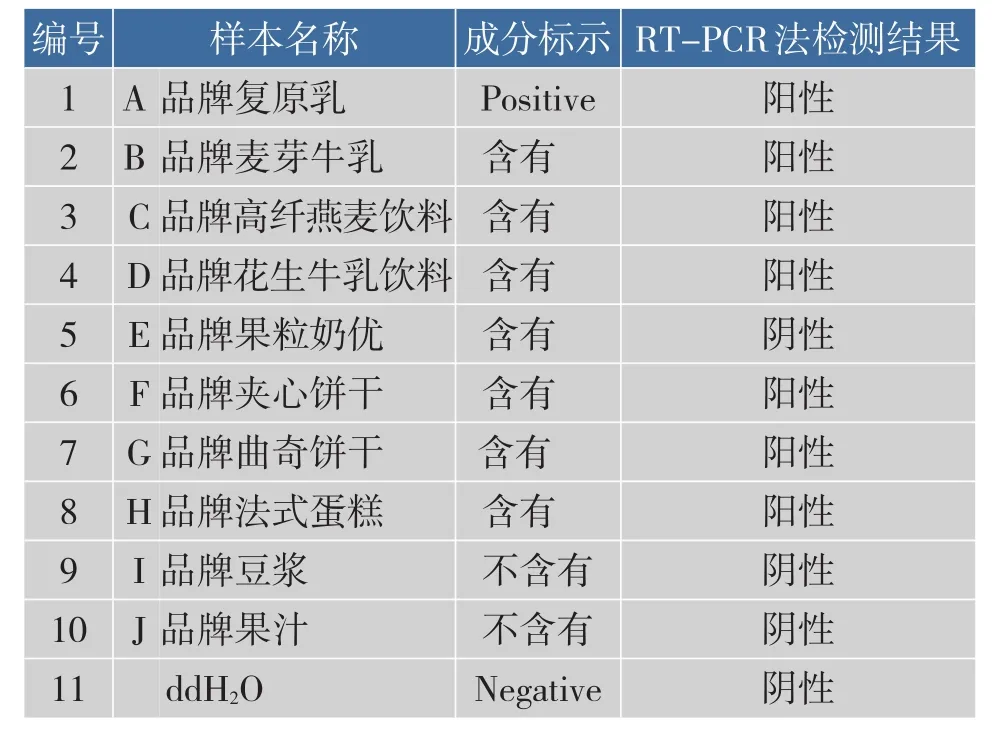
表4 市售食品中牛奶过敏原β-乳球蛋白质的检测结果Table 4Detection results of commercial food
3 讨论
为避免消费者误食过敏原导致严重的过敏反应,提供消费者清晰准确的食物过敏原信息至关重要。因此,美国(USA)和欧盟(EU)近来都制定了规范食品过敏原标签的法律法规。2010年我国修订国家标准《GB/T23779—2009预包装食品中的致敏原成分》,要求食品标签增加牛奶等其他过敏原的标识。因此,迫切需要建立快速、灵敏、特别的牛奶过敏原检测方法,以为食品过敏原的标识提供支持保障。
本研究中根据NCBI登录的β-乳球蛋白质核酸序列,设计了一对特异性引物和探针,对目标基因β-乳球蛋白质的一段DNA序列进行荧光定量PCR扩增,构建重组质粒标准品,建立标准曲线。结果表明,该质粒作为标准模板建立的标准曲线线性关系良好,在3.18×107~3.18×103拷贝数范围内,Ct值与质粒拷贝数的对数值呈线性关系,通过标准曲线,可对目的基因浓度进行准确定量。与许庆金等人建立的β-乳球蛋白质常规PCR检测方法相比,Taqman探针实时荧光定量PCR可省去电泳步骤、简便安全、灵敏度高、特异性强,并且实现了定性PCR到定量PCR的飞跃。用本研究中设计的引物和探针对羊奶、豆浆及饼干、饮料进行扩增,结果显示该检测方法特异性针对牛奶β-乳球蛋白质,灵敏度达到318 copies/μL。根据建立的灵敏度对10种食品进行检测,除果粒奶优饮料检测结果与标签不符,推测该饮料DNA破坏严重或含量较低影响检测,其他食品检测结果与标签过敏原标识一致,说明该方法具有较高的可靠性和准确性。
4 结语
作者建立的Taqman探针实时荧光定量PCR方法,用于食品中牛奶主要过敏原β-乳球蛋白质基因的检测,为食品致敏原的标签管理和检测提供了可靠的技术支持。Taqman实时荧光定量法可定量分析食品中β-乳球蛋白质含量,与常规PCR方法相比具有灵敏、快速、特异、简单、安全等优点。与直接检测致敏性蛋白质的免疫分析方法相比,可大大降低复杂生物基质中交叉反应导致的假阳性结果,避免对大量抗体的需求,而DNA比蛋白质稳定,受食品加工条件影响较小,因此可通过对过敏原DNA片段的检测间接指示食物过敏原组分的存在。基于以上优点,本试验中建立的实时荧光定量PCR检测方法可作为目前常用的免疫检测的有效补充,为食物牛奶过敏原的检测提供可靠的保障,可推广到食品中牛奶过敏原实际的检测。
[1]Arjon J van Hengel.Food allergen detection methods and the challenge to protect food-allergic consumers[J].Analytical and Bioanalytical Chemistry,2007,389(1):111-118.
[2]Linda Monaci,Virginie Tregoat,Arjon J van Hengel,et al.Milk allergens,their characteristics and their detection in food:a review[J].European Food Research and Technology,2006,223(2):149-179.
[3]张海英,刘旸,吴冬雪,等.食品中β-乳球蛋白质过敏原检测方法的比较[J].食品安全质量检测学报,2012,3(4):295-298
ZHANG Haiying,LIU Yang,WU Dongxue,et al.Comparison of two detection methods of β-lactoglobulin allergens in food[J].Journal of Food Safety and Quality,2012,3(4):295-298.(in Chinese)
[4]Zsuzsanna Bugyi,Judit Nagy,Kitti Török,et al.Towards development of incurred materials for quality assurance purposes in the analysis of food allergens[J].Analytica Chimica Acta,2010,672(1):25-29.
[5]Massimo Natale,Carolina Bisson,Giovanna Monti,et al.Cow's milk allergens identification by two-dimensional immunoblotting and mass spectrometry[J].Molecular Nutrition&Food Research,2004,48(5):363-369.
[6]Michael Zeece,Thom Huppertz,Alan Kelly.Effect of high-pressure treatment on in-vitro digestibility of β-lactoglobulin[J]. Innovative Food Science&Emerging Technologies,2008,9(1):62-69.
[7]Jean-Michel Wal.Cow's milk proteins/allergens[J].Annals of Allergy,Asthma&Immunology,2002,89(6):3-10.
[8]Makoto Hattori,Ken-ichi Numamoto,Kazuo Kobayashi,et al.Functional changes in β-lactoglobulin by conjugation with cationic saccharides[J].Journal of Agricultural and Food Chemistry,2000,48(6):2050-2056.
[9]Sampson H A.Food allergy-accurately identifying clinical reactivity[J].Allergy,2005,60(s79):19-24.
[10]Hill D J,Hosking C S,Reyes-Benito L V.Reducing the need for food allergen challenges in young children:a comparison of in vitro with in vivo tests[J].Clinical&Experimental Allergy,2001,31(7):1031-1035.
[11]Holzhauser T,Dehne L I,Hoffmann A,et al.Rocket immunoelectrophoresis(RIE)for determination of potentially allergenic peanut proteins in processed foods as a simple means for quality assurance and food safety[J].Zeitschrift Für Lebensmitteluntersuchung Und-Forschung A,1998,206(1):1-8.
[12]Dominique Godfrin,Hélène Sénéchal,Jean-Pierre Sutra,et al.A modified enzyme-linked immunosorbent assay adapted for immunodetection of low amounts of water-insoluble proteins[J].Journal of Immunological Methods,2007,326(1):83-92.
[13]Mustorp S,Engdahl-Axelsson C,Svensson U,et al.Detection of celery(Apium graveolens),mustard(Sinapis alba,Brassica juncea,Brassica nigra)and sesame(Sesamum indicum)in food by real-time PCR[J].European Food Research and Technology,2008,226(4):771-778.
[14]René Köppel,Veronika Dvorak,Franziska Zimmerli,et al.Two tetraplex real-time PCR for the detection and quantification of DNA from eight allergens in food[J].European Food Research and Technology,2010,230(3):367-374.
[15]布冠好,郑喆,郑海,等.牛乳过敏原β-乳球蛋白间接竞争ELISA检测方法的建立[J].中国农业大学学报,2008,13(6):71-76.
BU Guanhao,ZHENG Zhe,ZHENG Hai,et al.A method for detecting β-lactoglobulin in cow milk allergens by indirect competitive enzyme-linked munosorbent assay[J].Journal of China Agricultural University,2008,13(6):71-76.(in Chinese)
[16]张忠华.牛乳α-乳白蛋白和β-乳球蛋白间接竞争ELISA检测方法的建立[D].昆明:昆明医学院,2009.
[17]赵金龙.β-乳球蛋白两种酶联免疫检测方法的建立和比较[D].天津:天津科技大学,2010.
[18]许庆金,邓志瑞,张文举,等.牛奶过敏原PCR监测方法的建立[J].食品工业科技,2012,33(6):104-107.
XU Qingjin,DENG Zhirui,ZHANG Wenju,et al.PCR method for the detection of allergen in milk[J].Science and Technology of Food Industry,2012,33(6):104-107.(in Chinese)
[19]田雨.从牛奶中分离DNA方法的建立[J].乳业科学与技术,2006(3):112-113.
TIAN Yu.Establishment of method of separating DNA from milk[J].Journal of Dairy Science and Technology,2006,(3):112-113.(in Chinese)
[20]徐仙,陈沁,雍克岚,等.PCR方法在区分牛奶牧场来源中的应用[J].食品科技,2008,33(12):258-261.
XU Xian,CHEN Qin,YONG Kelan,et al.Application of PCR in analyzing farm sources[J].Food Science and Technology,2008,33(12):258-261.(in Chinese)
[21]张舒亚,于翠,宋青,等.食品过敏原大豆P34蛋白基因的实时荧光PCR检测[J].中国油料作物学报,2012,34(6):661-665.
ZHANG Shuya,YU Cui,SONG Qing,et al.Detection allergen soybean in food using real-time PCR[J].Chinese Journal of Oil Crop Sciences,2012,34(6):661-665.(in Chinese)
[22]Thomas H Tai,Steven D Tanksley.A rapid and inexpensive method for isolation of total DNA from dehydrated plant tissue[J]. Plant Molecular Biology Reporter,1990,8(4):297-303.
[23]Linda Monaci,Jørgen V Nørgaard,Arjon J van Hengel.Feasibility of a capillary LC/ESI-Q-TOF MS method for the detection of milk allergens in an incurred model food matrix[J].Analytical Methods,2010,2(7):967-972.
Establishment of a Taqman Real-Time Quantitative PCR for the Detection of β-Lactoglobulin Gene
JIA Min1,ZHANG Yinzhi2,ZHANG Yifan3,SUN Xiulan*1,2
(1.School of Food Science,Jiangnan University,Wuxi 214122,China;2.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China;3.Hanzhong Products Quality Supervision and Inspection Institute,Hanzhong 723000,China)
The research aimed to establish a Taqman real-time fluorescence quantitative assay for the rapid detection of milk allergen β-lactoglobulin in food.Specific primers and Taqman probe were first designed based on the gene sequence of β-lactoglobulin for real-time PCR.The purified DNA product was linked with the pMDl9-T vector to construct recombined plasmids as a standard PCR template.Plasmids were then identified with colony PCR and subjected to sequencing.Real-time fluorescence PCR assay was performed with plasmids and the standard curve was constructed with DNA copies and Ct.Sensitivity,specificity,reproducibility and application of the real-time method were also evaluated.Results showed that the β-lactoglobulin DNA fragment was successfully clonedand the standard curve had a good linear relationship ranging from 3.18×103to 3.18×107copies.The detection sensitivity reached up to 318 copies/μL.Furthermore,specificity and stability of the method were good.Ten foods were detected with the β-Lg DNA residue and the results were consistent well with their allergen labels.Therefore,the method may become a complementary tool for milk allergen detection and it is applicable for other food allergens.
milk allergen,β-lactoglobulin,Taqman real-time quantitative PCR,detection
52.1;TS252.7
A
1673—1689(2015)06—0605—08
2014-06-30
国家“十二五”科技支撑计划项目(2011BAK10B03)
*通信作者:孙秀兰(1976-),女,山东聊城人,工学博士,教授,主要从事食品安全检测研究。E-mail:sxlzzz@yahoo.com.cn
