酶联适体分析法检测葡萄酒中的赭曲霉素A
2015-11-20赵秋伶史素青
赵秋伶,史素青
(1.辽宁工程技术大学矿业技术学院,辽宁葫芦岛 125105;2.西北大学化学与材料学院,陕西西安 710069)
酶联适体分析法检测葡萄酒中的赭曲霉素A
赵秋伶1,史素青2
(1.辽宁工程技术大学矿业技术学院,辽宁葫芦岛 125105;2.西北大学化学与材料学院,陕西西安 710069)
建立了竞争取代酶联适体分析方法,检测葡萄酒中的赭曲霉素A(OTA)。核酸适体和OTA特异性结合导致与核酸适体杂交的短链DNA解链,解离的DNA作为捕获元素,进一步特异性结合辣根过氧化物酶(HRP),HRP催化四甲基二苯胺(TMB)底物显色,测定A450nm与浓度的线性关系,确定OTA的检出限。考察了DNA包被浓度、杂交温度和封闭液等因素对检测的影响。结果表明,在优化的条件下,所建立的竞争取代酶联适体分析法对OTA检测有高灵敏度,检测限0.88 μg/L,线性范围1~100 μg/L在葡萄酒中添加时,加标回收率为92.03%~106.6%,相对标准偏差RSD(n=5)小于2.1%,此方法可用于葡萄酒中OTA的快速测定。
赭曲霉素A;竞争取代;酶联适体分析;葡萄酒
赭曲霉素A(Ochratoxin A),简称OTA,是赭曲霉、炭黑曲霉和青霉菌等的次级代谢产物[1],广泛存在于谷类、咖啡和葡萄等农作物及相关产品中[2],可经食物链进入人体,对人类健康造成巨大威胁。OTA毒性很大,可损伤人类的肝脏、肾脏、神经系统及免疫系统[3],并有致畸、致突变和致癌作用[4]。2006年,欧盟调查显示,人类从葡萄酒中摄取的OTA含量占总量的13%,仅次于谷类[5]。至此,葡萄酒中OTA的检测成为各国食品安全分析的新热点。欧盟规定[6]葡萄酒中OTA的最大限量为2 μg/ L,我国尚未制定限量标准。目前葡萄酒中OTA检测主要有高效液相法(HPLC)和酶联免疫吸附法(ELISA)[7-8]。HPLC法所用仪器昂贵、对样品的预处理步骤复杂、检测成本高、耗时长。ELISA弥补了HPLC的不足,可满足大批量样品和现场快速检测等要求,但抗体易受外界条件的影响,检测结果假阳性率高,只能作为仪器分析前的排查方法。
核酸适体(Aptamer)是高亲和性和高特异性结合目标分子的单链寡核苷酸(DNA或RNA)[9]。与抗体相比,核酸适体容易合成和标记,具有良好的稳定性,且成本低[10]。用核酸适体代替抗体发展ELISA,可以降低ELISA的成本,同时降低假阳性率。OTA的核酸适体已被成功筛选[11-12],用核酸适体做识别元素的直接竞争和间接竞争酶联分析法已被成功建立[12],检测原理和抗体做识别元素的检测完全相同,且都是显色浅者为阳性。关于具有新型检测机理的酶联适体分析方法研究甚少,因此作者旨在通过用双链核酸适体作识别元素,建立显色深者为阳性的竞争取代酶联适体分析方法,检测葡萄酒中的OTA。显色深者为阳性,显色结果更容易被裸眼观察。该方法丰富了核酸适体免疫分析法的实际应用,为保障酒类质量安全提供了一种有效的技术手段。
1 材料与方法
1.1 材料与仪器
赭曲霉素A(OTA)、N-乙酰-L-苯丙氨酸(NAP)、华法林(Warfarin)、赭曲霉素B(OTB)和黄曲霉素B1(AFB1):购自美国Sigma公司。生物素(biotin)标记的OTA核酸适体序列:5′-biotin-GAT CGG GTG TGG GTG GCG TAA AGG GAG CAT CGG ACA-3′(DNA1);和DNA1部分互补的异硫氰酸荧光素(FITC)标记的核酸序列:5′-FITC-CGC CAC CCA CAC CCG CAG-3′(DNA2);和DNA2完全互补的核酸序列:5′-biotin-CTG CGG GTG TGG GTG GCG-3′(DNA3);无标记的其它核酸序列(见表1);均购自上海生工生物工程有限公司。所有核酸在使用前都用超纯水配成100 μmol/L的储备液。链霉亲和素包衣的酶标板和四甲基联苯胺(TMB)底物显色液:购自美国ThermoScientific公司;Anti-FITC-HRP:购自美国Millipore公司;实验用水为超纯水,其它试剂均为分析纯。

表1 实验中用到的其它核酸序列Table 1Other DNA sequences used in the experiment
包被核酸适体用PBS缓冲液(0.1 mol/L,pH= 7.4);洗涤用PBST缓冲液(0.1 mol/L,pH=7.4,含2 mmol/L MgCl2和质量分数0.12%Tween 20);结合缓冲液:10 mmol/L Tris-HCl,120 mmol/L NaCl,20 mmol/L CaCl2,质量分数0.02%Tween 20,pH= 8.5。2 g/L OTA及相关物质的标准储备液,用甲醇自行配制,4℃冰箱保存使用。葡萄酒样品,购自西安超市,乙醇体积分数11%。
Milli-Q超纯水系统,美国Millipore公司制造;冷冻离心机、微量可调移液器:德国Eppendorf公司制造;SpectraMax Paradigm多功能酶标仪:美国Molecular Devices公司制造;摇床:德国IKA公司制造。
1.2 实验方法
1.2.1 双链核酸适体的优化向OTA结合缓冲液中加入10 nmol/L核酸适体序列(DNA1)及它的互补序列(a或b或c),于37℃孵育20 min以确保完全杂交形成双链DNA(dsDNA);然后加入适量的核酸染料SYBR Green I(SG),室温下孵育10 min,确保SG插入双链DNA小沟区域;最后滴加100 μg/L的OTA,室温下孵育30 min,测定和OTA反应前后的溶液的荧光光谱,SG的最大激发波长为497 nm,收集500~650 nm的发射光谱,激发和发射狭缝均设为5 nm,计算荧光降低率。

1.2.2 核酸适体在酶标板上的包被首先向包被缓冲液PBS中加入DNA1和DNA2配成溶液(DNA2的浓度是DNA1的1.05倍),于37℃孵育20 min,DNA1和DNA2杂交形成部分互补的dsDNA。链霉亲和素标记的酶标板用200 μL洗涤缓冲液洗涤3次,每次5 min。洗涤完毕,酶标板的每口加入100 μL dsDNA溶液,置于37℃摇床反应1 h,通过生物素和链霉亲和素的特异相互作用dsDNA包被到酶标板凹槽,移去反应液,凹槽用洗涤缓冲液洗3次,保留待用。采用相同的方法将DNA3包被到在另一链霉亲和素标记的酶标板的凹槽,DNA3的浓度为DNA1浓度的2倍。包被完毕,加质量分数1%乳粉做封闭反应,反应时间1 h,反应完毕洗涤3次,保留备用。
1.2.3 竞争取代酶联适体分析的检测步骤OTA标准溶液用结合缓冲液稀释成系列浓度,分别加入到包被了dsDNA的酶标板的凹槽中,每槽100 μL,室温下孵育反应30 min,反应完毕用移液器吸出反应液,转移至包被了DNA3的酶标板的凹槽中,于37℃摇床孵育反应30 min,然后移去反应液,用200 μL洗涤缓冲液洗涤3次,每次5 min。接着,每槽加100 μL按体积比1:5 000稀释的Anti-FITC-HRP抗体,于37℃孵育30 min,移去反应液,洗涤3次,最后加入TMB-H2O2底物显色液,反应30 min,蓝色结果拍照。然后,用2 mol/L的H2SO4终止反应,蓝色产物变黄,黄色产物用酶标仪测定其在450 nm处的吸光度值。根据测量得到的吸光度,绘制吸光度与OTA浓度的曲线。
1.2.4 方法特异性评价比较了与OTA结构类似的两种物质:N-乙酰-L-苯丙氨酸(NAP)和华法林(Warfarin)的检测结果。同时也考察了赭曲霉素B(OTB)和黄曲霉素B1(AFB1)对检测的影响。以结合缓冲液作为阴性对照,用双链核酸适体作为识别元素,用建立的竞争取代酶联核酸适体法检测。交叉反应物的吸光度值为P,阴性孔吸光度值为N,计算P/N值。
1.2.5 实际样品中OTA的添加回收实验选择超市中2种葡萄酒,取1g上述样品,添加3个不同质量浓度(1、5、10 μg/L)的OTA。用建立的竞争取代酶联适体分析法和酶联免疫吸附分析试剂盒(北京康源泰博生物科技有限公司提供)检测,计算得出样品中OTA的实际检测质量浓度,并按照以下公式(2)计算加标回收率

2 结果与分析
2.1 双链核酸适体的优化
竞争取代酶联适体分析方法是由作者所在实验室提出的,已成功用于ATP的检测[13],它的检测原理是:核酸适体和靶标的特异性结合导致和核酸适体杂交的另一短链DNA自双链上解离,解离的DNA通过互补杂交被另一酶标板上的DNA捕获,进一步捕获辣根过氧化物酶,从而催化TMB底物显色,颜色深浅和靶标浓度成正比。竞争取代酶联适体分析方法成功的关键在于核酸适体通过竞争反应能发生结构转换,从dsDNA转变成靶标/aptamer复合物,即和核酸适体杂交的短链DNA在加入靶标时发生解链。
为了得到结构转换效率最高的dsDNA,优化了不同位置互补的dsDNA序列。表1中核酸序列a、b、c和核酸适体DNA1杂交后形成双链DNA,分别称为dsDNA1、dsDNA2和dsDNA3。图1示出了不同dsDNA/SG体系与OTA反应前后溶液的荧光光谱,在522 nm处有最大发射。荧光降低率数据显示dsDNA1和OTA反应后,荧光降低率值最大达58.1%,这说明dsDNA1和OTA发生反应时结构转换效率最高,因此选择dsDNA1作为OTA的识别元素。
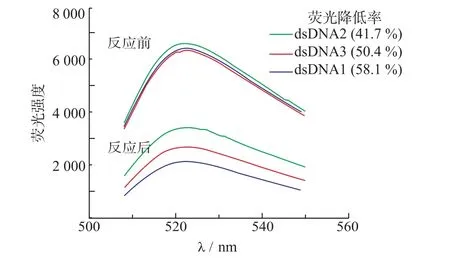
图1 dsDNA/SG体系和OTA反应前后的荧光光谱及荧光降低率Fig.1Fluorescence spectra and fluorescence decrease percentage of dsDNA/SG system before and after reaction with OTA
2.2 实验条件的优化
当DNA2浓度为DNA1浓度的2倍时,对DNA1浓度进行了优化,考察了25、50、75、100、125、150 nmol/L的DNA1包被时,检测1 000 μg/L的OTA实验结果(见图2):DNA1浓度为100 nmol/L时,A450(450 nm处的紫外吸光度)值最大,表明此时微孔板已被DNA1饱和。所以,实验中DNA1包被浓度采用100 nmol/L。当DNA1用量为100 nmol/L时,对DNA2包被浓度进行了优化,考察了DNA2为100、105、110、120、130 nmol/L时,检测1 μg/L OTA的实验结果,以相对吸光度值差值(A-A0)为考察对像(见图3):DNA2浓度为105 nmol/L时,(A-A0)最大,检测效果最理想。所以,实验中DNA2包被浓度采用105 nmol/L。当DNA1和DNA2用量一定时,对杂交温度进行优化,考察了25、37℃和45℃下杂交对检测结果的影响,结果表明37℃时杂交效率最高,检测结果最理想。洗涤缓冲液用文献[13]报道的优化的体系。
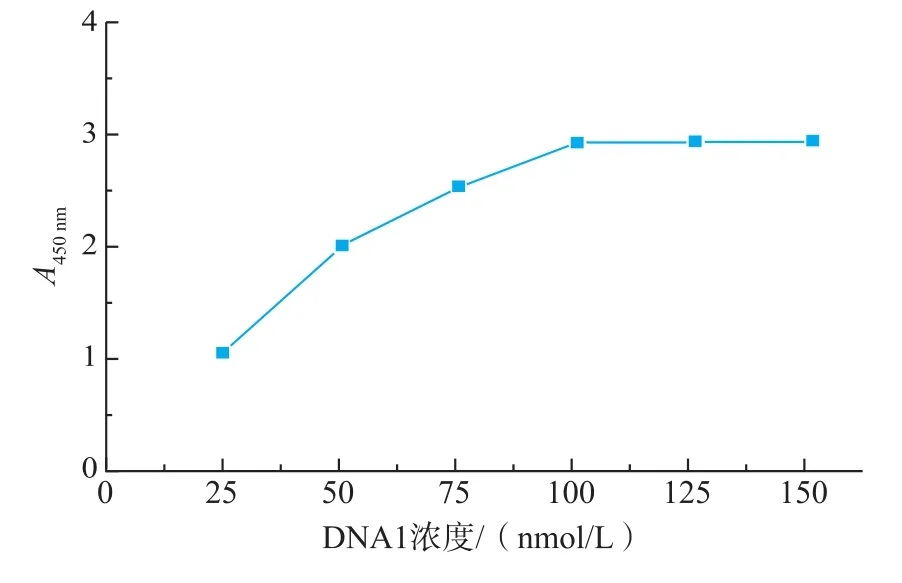
图2 不同浓度DNA1包被酶标板对吸光度值的影响Fig.2Influences of DNA1 concentration coating onto micro plate wells on absorbance change
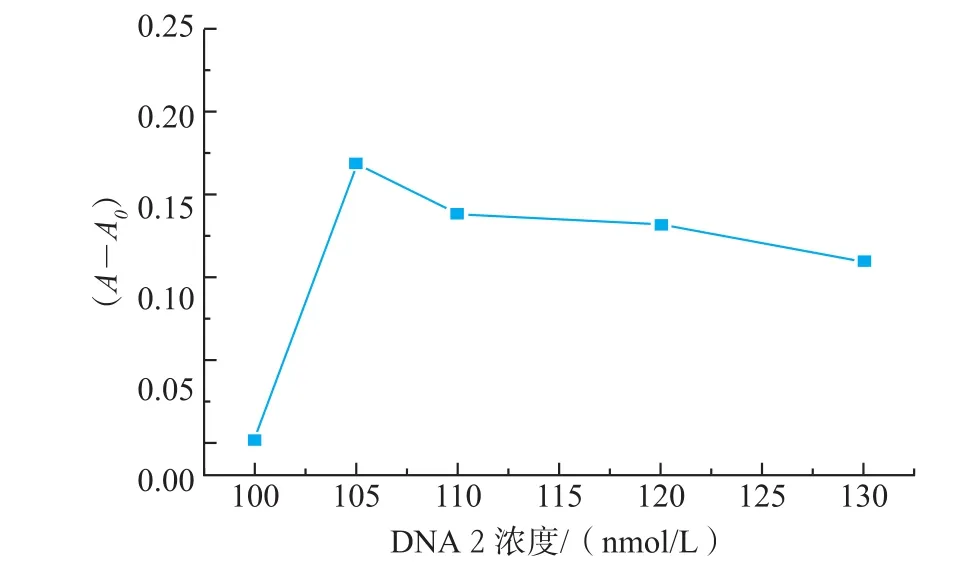
图3 不同浓度DNA2包被酶标板对相对吸光度值的影响Fig.3Influences of DNA2 concentration coating onto micro plate wells on the relative absorbance value
封闭液的选择:非特异性吸附引起的背景颜色较深,同时由于检测限的定义与空白值的大小紧密相关,因此试图通过封闭液的优化来降低空白值。实验中考察了核酸适体在最优包被量的条件下,BSA、明胶、乳粉、酪蛋白质等封闭液对空白值的影响,实验结果表明(见图4):质量分数1%乳粉做封闭液时,空白检测值最小(A450=0.154),因此选择质量分数1%乳粉作为封闭液。
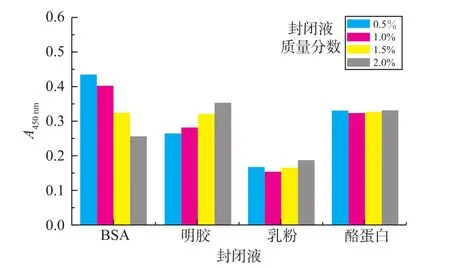
图4 封闭液对空白测定值的影响Fig.4Influences of blocking solution on determination of blank value
2.3 检测结果及标准曲线的绘制
在优化的实验条件下,考察了此显色体系对梯度稀释的OTA的响应。随着OTA质量浓度的增加,溶液颜色逐渐加深(见图5(a),用裸眼观察时,蓝色产物比黄色产物更显眼,所以图5列出的是蓝色显色结果),450 nm处的紫外吸收值逐渐增大(见图5(b),蓝色产物加酸后,反应被终止,蓝色产物变成黄色,在450 nm处有最大吸收)。OTA与核酸适体序列发生特异性结合,导致越来越多的dsDNA分解成单链,随着OTA质量浓度的增加,解离并被另一DNA捕获的FITC-DNA越来越多,从而使溶液颜色加深,吸光度值增大。在1~100 μg/L范围内,450 nm紫外吸收变化值,即相对吸光度值差值(A-A0)与OTA质量浓度呈良好的线性关系,见图5(c),标准曲线方程为
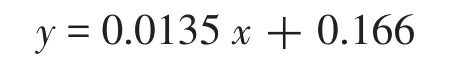
相关系数R2=0.995。检出限(LOD)定义为空白加3倍标准偏差对应的OTA质量浓度,依据定义计算得该方法的LOD值为0.88 μg/L(空白值的标准偏差为0.044)。该竞争取代酶联适体分析法的灵敏度低于欧盟规定的限量标准,即能满足欧盟的检测要求。
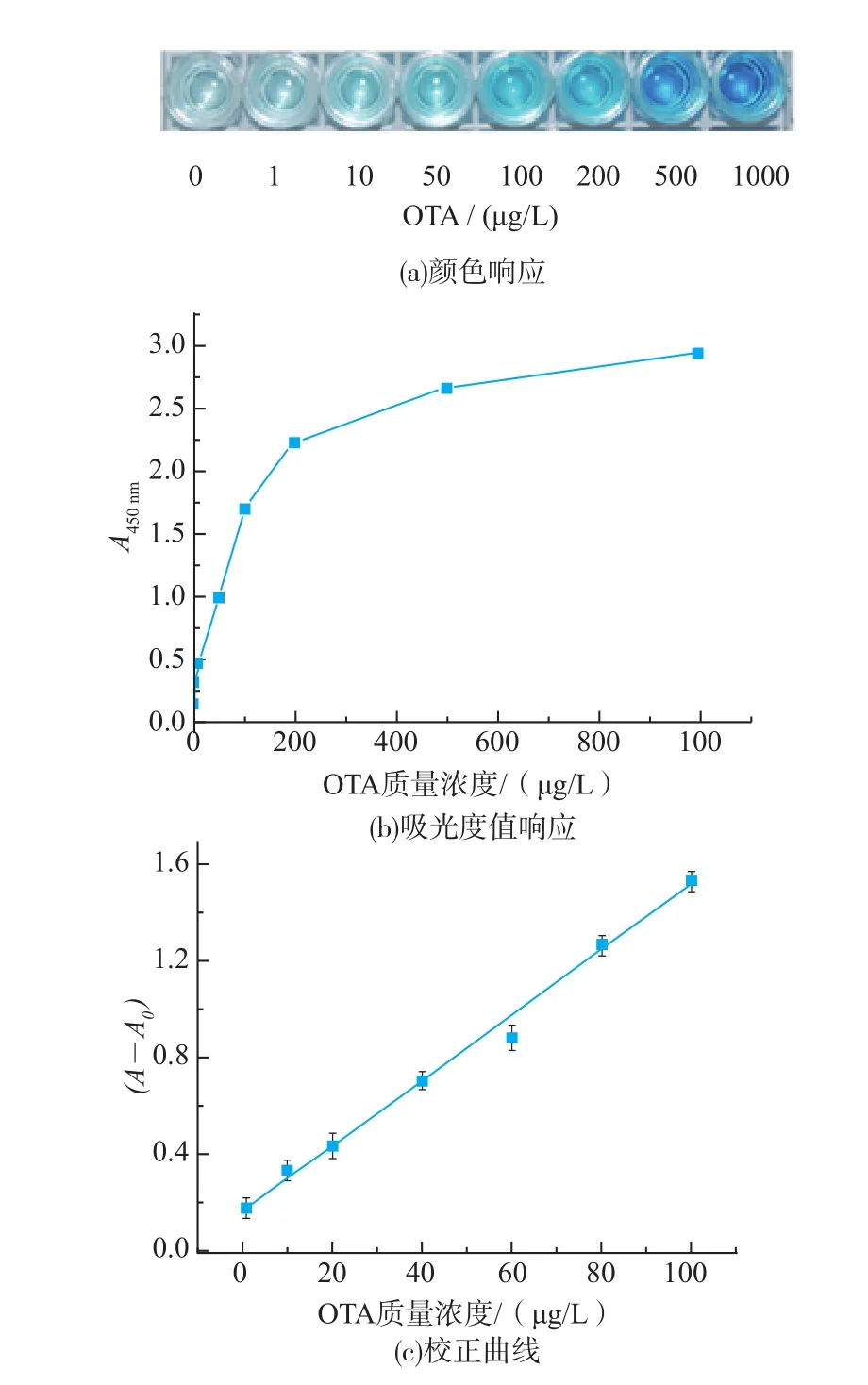
图5 TMB底物显色体系对不同浓度OTA的颜色响应、吸光度响应及校正曲线(n=5)Fig.5Photograph of color,response of absorbance change at 450 nm and calibration curve(n=5)of TMB substrate system upon analyzing different concentrations of OTA
2.4 方法的特异性
选择与OTA结构类似的物质N-乙酰-L-苯丙氨酸和华法林及赭曲霉素B和黄曲霉素B1作交叉反应实验,结合缓冲溶液作为阴性对照,用建立的竞争取代酶联适体分析法测定10、5、1 μg/L的OTA,结果见表2。在交叉反应物质量浓度高达10 μg/L时,P/N值仍然均小于2,即无交叉反应发生,说明所建立的检测方法特异性良好。
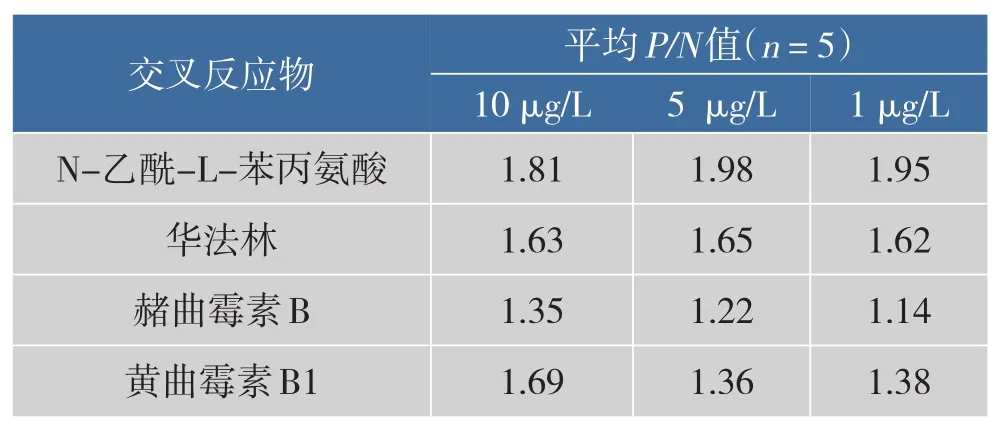
表2 交叉反应的实验结果Table 2Experimental results of cross reaction
2.5 样品的测定及添加回收实验
准备两份葡萄酒样品,用作者建立的方法(ELAA)和购买的ELISA试剂盒同时测定,确定OTA的本底值,实验结果见表3,两种检测方法的检测结果一致,表明该方法能应用于实际样品葡萄酒中OTA检测,准确性良好。
在两份葡萄酒样品中分别添加不同质量浓度的OTA标准品,在实验选定最佳条件下,进行OTA标准物质的加标回收实验,以验证该方法应用于实际样品检测的准确度,同时采用ELISA方法进行对照实验。结果(表3)显示:ELAA法葡萄酒样品中标准OTA回收率为92.03%~106.6%,添加回收的相对标准偏差均低于2.01%;且检测结果与ELISA方法的一致。进一步说明作者所建立的方法能够用于实际样品葡萄酒中OTA的有效检测。
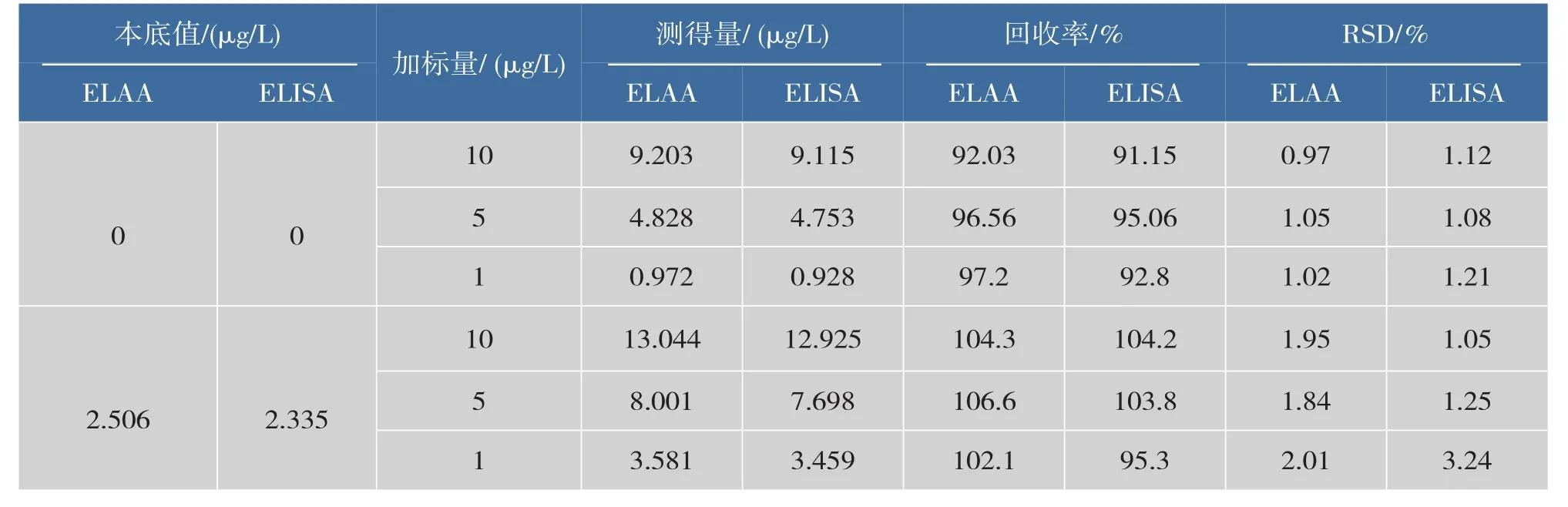
表3 回收率实验(n=5)Table 3Experiment results of recovery(n=5)
3 结语
以dsDNA作为识别核酸适体,建立了检测OTA的竞争取代酶联核酸适体分析方法。在优化的实验条件下,在1~100 μg/L范围内,相对吸光度值差值(A-A0)与OTA质量浓度呈良好线性关系,检测限为0.88 μg/L。在实际样品葡萄酒中添加适量的OTA后,添加回收率在92.03%~106.6%之间,相对标准偏差低于2.01%,该方法能用于葡萄酒中OTA含量的检测,且方法简单,结果准确,无需样品前处理,检测时间短,可满足大批量样品和现场快速检测等的要求。
[1]杨学威,段雪荣,卢新军,等.关于葡萄酒中赭曲霉素A的研究进展[J].中国酿造,2012,31(11):12-14.
YANG Xuewei,DUAN Xuerong,LU Xinjun,et al.Research progress of ochratoxin A in wine[J].China Brewing,2012,31(11):12 -14.(in Chinese)
[2]Varga J,Kozakiewicz Z.Ochratoxin A in grapes and grape derived products[J].Trends Food Sci Tech,2006,17:72-81.
[3]Battilani P,Magan N,Logrieco A.European research on ochratoxin A in grapes and wine[J].Int J Food Microbiol,2006,111:S2-S4.
[4]Roland A,Bros P,Bouisseau A.Analysis of ochratoxin A in grapes,musts and wines by LC-MS/MS:First comparison of stable isotope dilution assay and diastereomeric dilution assay methods[J].Analytica Chimica Acta,2014,818:39-45.
[5]康健,钟其顶,张辉,等.葡萄酒中赭曲霉素A的研究进展[J].酿酒,2009(3):14-18.
KANG Jian,ZHONG Qiding,ZHANG Hui,et al.Research advance in ochratoxin A in grape wine[J].Liquor Making,2009(3):14 -18.(in Chinese)
[6]Chen J,Fang Z,Liu J.A simple and rapid biosensor for ochratoxin A based on a structure-switching signaling aptamer[J].Food Control,2012,25:555-560.
[7]Anfossi L,Giovannoli C,Giraudi G,et al.A lateral flow immunoassay for the rapid detection of ochratoxin A in wine and grape must[J].J Agric Food Chem,2012,60:11491-11497.
[8]王颖,张妮娜,雒丽娜,等.赭曲霉毒素A检测方法的研究进展[J].中国卫生检验杂志,2014,(5):757-760.
WANG Ying,ZHANG Nina,LUO Li-na,et al.Research progress of ochratoxin A detection methods[J].Chin J Health Lab Tec,2014,(5):757-760.(in Chinese)
[9]Fang X,Tan W.Aptamers generated from Cell-SELEX for molecular medicine:A chemical biology approach[J].Acc Chem Res,2010,43(1):48-57.
[10]Tan X,Chen T,Xiong X,et al.Semiquantification of ATP in live cells using nonspecific desorption of DNA from graphene oxide as the internal reference[J].Anal Chem,2012,84(20):8622-8627.
[11]Kuang H,Chen W,Xu D,et al.Fabricated aptamer-based electrochemical“signal-off”sensor of ochratoxin A[J].Biosens bioelectron,2010,26:710-716.
[12]Cruz-Aguado J A,Penner G.Determination of ochratoxin A with a DNA aptamer[J].J Agric Food Chem,2008,56:10456-10461.
[13]赵秋伶,刘玲玲,杨丽娜.基于核酸适体检测ATP的酶联分析新方法[J].高等学校化学学报,2014,35(6):1161-1165.
ZHAO Qiuling,LIU Lingling,YANG Lina.Novel aptamer-based enzyme-linked assay for the detection of ATP[J].Chemical Journal of Chinese Universities,2014,35(6):1161-1165.(in Chinese)
Enzyme-Linked Aptamer Assay for Detection of Ochratoxin A in Wine
ZHAO Qiuling1,SHI Suqing2
(1.College of Mining Industry Technology,Liaoning Technical University,Huludao 125105,China;2.College of Chemistry&Materials Science,Northwest University,Xi’an 710069,China)
ompetitive enzyme-linked aptamer assay for Ochratoxin A(OTA)detection in wine was investigated in this study.The binding of aptamer to the target OTA resulted in the dissociation of the DNA short chain from the aptamer,which was further captured by horseradish peroxidase(HRP).HRP catalyzed 3,3',5,5'.-Tetramethylbenzidine(TMB)substrate and finally leaded to a characteristic change that was detectable by the absorption of ultraviolet at 450 nm.The detection limit of OTA was determined by the linear relationship between OTA concentration and the absorbance.The factors influenced the effect of detection were investigated,including DNA concentration,temperature of hybridization,and blocking buffer solution.This work described the high performance of the competitive enzyme-linked aptamer assay(ELAA)for the determination of OTA.Under the optimal condition,the limit of detection attained was 0.88 μg/L and the linearity was in the range 1 to 100 μg/L.For the OTA detection in wine,the recovery rate was between 92.03%and 106.6%,and the relative standard deviation(RSD,n=5)was within 2.1%.This study validates the competitive ELAA is a useful tool for a rapid detection of OTA in wine.
ochratoxin A,competitive displacement,enzyme-linked aptamer assay,wine
O657.1
A
1673—1689(2015)04—0396—06
2014-11-17
国家自然科学基金项目(21004047);陕西省青年科技新星人才项目(2014KJXX-62)。
赵秋伶(1979-),女,辽宁北镇人,理学博士,讲师,主要从事生物化学与食品安全研究。E-mail:flyzhql@iccas.ac.cn
