Tween60和SDS强化白腐真菌修复DDT污染土壤
2015-11-20肖鹏飞李玉文KONDORyuichiro东北林业大学林学院黑龙江哈尔滨50040FacultyofAgricultureKyushuUniversityFukuoka858Japan
肖鹏飞,李玉文,KONDO Ryuichiro(.东北林业大学林学院,黑龙江 哈尔滨 50040;.Faculty of Agriculture, Kyushu University, Fukuoka 8-858, Japan)
Tween60和SDS强化白腐真菌修复DDT污染土壤
肖鹏飞1*,李玉文1,KONDO Ryuichiro2(1.东北林业大学林学院,黑龙江 哈尔滨 150040;2.Faculty of Agriculture, Kyushu University, Fukuoka 812-8581, Japan)
为了提高DDT污染土壤的修复效果,研究了非离子表面活性剂Tween60及阴离子表面活性剂SDS在单一和组合两种方式对人工污染黑土中白腐真菌Phlebia lindtneri GB1027降解去除DDT的强化作用.结果表明,Tween60和SDS均能不同程度地促进土壤中DDT的生物降解,尤其在两种表面活性剂浓度为1.0mg/g干土时,土壤中DDT的降解率分别达到最高的62.9%和53.9%.相同浓度下,Tween60比SDS更有利于提高DDT污染土壤的生物修复效果,去除率提高接近10%.将Tween60与SDS以不同质量比例组合处理后的DDT去除率大小为:Tween60-SDS(3:1)>Tween60-SDS(2:1)>Tween60-SDS(1:1),尤其在质量比为3:1和2:1时的DDT去除率甚至高于Tween60单独处理时的去除率,表明将两种类型的表面活性剂组合后对提高DDT的生物可利用性产生了协同效果.研究还发现,菌株接种量越高,土壤中DDT的降解去除率越高,当接菌量达到1.0mL/g干土时,DDT的30d去除率达到最高的70.9%.在土壤含水率为10%~50%范围内,白腐真菌对DDT的降解去除效果随着土壤含水率的升高而增加,当土壤含水率达到50%时,土壤中有约70%的DDT被降解去除.本研究结果进一步证实了利用表面活性剂强化白腐真菌修复有机污染土壤的可行性.
DDT;表面活性剂;白腐真菌;生物降解;土壤修复
我国于20世纪80年代初停止了DDT的大规模生产和使用,但由于该化合物性质稳定,在自然界中难以分解,在我国土壤环境中仍有较高的残留[1-2].同时,为了履行《斯德哥尔摩公约》,我国关闭了大批DDT等有机氯农药的生产企业,而企业原址在二次开发过程中,企业生产遗留下的污染场地的处理则成为了亟待解决的难题[3].近十几年来,国内陆续开展了对于污染土壤的修复研究,其中生物修复技术因其成本低、无二次污染、环境友好等特点,成为有机污染土壤修复的关键技术.目前DDT污染土壤的生物修复研究包括植物修复[4]、酶修复[5]、堆肥修复[6]及微生物修复[7]等.微生物的降解转化是自然界有机污染物消除的重要途径,也是有机污染物控制与修复的有效方法.白腐真菌作为能有效降解木素的丝状真菌,降解酶特异性低,能降解多种难降解有机污染物.前期研究发现,白腐真菌及其酶系能在液相体系中高效降解DDT,显示出一定的生物修复潜力[8].然而,DDT疏水性强,一旦进入土壤,极易被土壤固相牢固吸附,从而限制了DDT的生物可利用性.可见,能否将DDT从土壤上解吸下来,增加其生物利用性,成为提高污染土壤生物修复效率的关键因素.而表面活性剂能利用产生的胶束提高疏水性有机物的水溶解度,并将其从土壤颗粒上洗脱下来,促进其向液相释放. 如非离子表面活性剂Tween60和阴离子表面活性剂十二烷基硫酸钠(SDS)已被报道用于DDT污染土壤的洗脱修复[9-10]及植物修复[11]的研究中,但鲜见其应用于强化污染土壤的微生物修复研究.如果将表面活性剂与白腐真菌共同处理污染土壤,可通过表面活性剂的增溶作用提高DDT的溶解性和生物可利用性,有望达到提高污染土壤生物修复效率的目标.
因此,本文针对国内对DDT等有机污染土壤修复技术的需求,在前期研究的基础上,选择已经证明对DDT具有较好洗脱效果的Tween60和SDS,考察其在单一和组合条件下对白腐真菌修复DDT污染黑土的强化效果,以及菌株接种量和土壤含水率对土壤修复效果的影响,探讨将表面活性剂用于强化白腐真菌修复DDT污染土壤的可行性,为完善污染土壤的修复技术提供理论依据.
1 材料与方法
1.1 土壤样品采集
供试土壤采自东北林业大学试验林场,采用多点混合法采取0~15cm表层土壤,去除根茎、败叶、碎石等杂物,混匀后于室内自然风干、研磨,过筛后备用.经测定,土壤样品基本理化性质如下:有机质含量为37.4mg/g,pH值为6.5,黏粒、粉粒和砂粒所占比例分别为61.2%,33.3%和5.5%,阳离子交换量为28.6cmol/kg.
1.2 实验方法
1.2.1 菌株培养 将在4℃斜面保存的白腐真菌Phlebia lindtneri GB1027接种于含有
15mLPDA固体培养基的平板培养皿中,30℃扩增培养5d,待长出的白色菌丝长满整个PDA培养基表面,将菌丝体刮下接种到无菌水中,轻轻振荡分散形成乳白色的孢子悬浮液并于4℃保存待用.取孢子悬浮液2mL接种于300mL的PDB液体培养基中,30℃、150r/min下活化培养.定期用平板计数法测定孢子数,达到106个/mL时即可进行降解试验.
1.2.2 土壤修复试验 称取20g土壤装入
200mL锥形瓶,经过高温(121℃,60min)灭菌后在无菌室内用喷雾法加入一定量配制好的4,4'-DDT的二氯甲烷溶液,使各土壤样品中DDT的浓度为60mg/kg,用无菌玻璃棒充分搅匀后制成人工模拟污染土壤.将锥形瓶置于通风橱中间歇搅拌2周使溶剂风干,经二氯甲烷提取并测定各土壤处理中DDT浓度作为土壤初始DDT浓度.土壤中菌悬液接种量为0.6mL/g干土,并均匀添加3g灭菌木屑作为菌株生长的碳源和载体.将配制好的表面活性剂溶液均匀添加进锥形瓶.向锥形瓶通氧30s后密封,30℃条件下避光静置培养30d,定时补充水分以保持土壤含水率一定.定时取样测定土壤中DDT浓度.接种经过高温灭菌处理(121℃、20min) 的菌悬液作为对照.实验结束后将土壤风干,4℃保存,待测.每个处理做3个重复.
1.2.3 影响因素试验 考察了各影响因素对土壤修复效率的影响,具体试验方案设计如下:表面活性剂浓度为0,0.1,0.25,0.5,1.0和1.5mg/g干土;Tween60和SDS质量配比为3:1,2:1和1:1;菌株接种量为0.2,0.4,0.6,0.8和1.0mL/g干土;含水率为10%,20%,30%,40%和50%.
1.2.4 样品处理与测定 将土壤样品置于索氏提取器中,用200mL的二氯甲烷在恒温水浴锅上连续提取12h.将提取液在旋转蒸发仪上浓缩至近干,加入10mL正己烷后浓缩至2mL左右.通过硅胶/氧化铝层析柱进行分离净化,层析柱规格为25cm ×1cm内径的玻璃柱,柱上层加有无水硫酸钠用以除水.样品上柱后,依次用15mL正己烷和70mL二氯甲烷/正己烷(3:2,体积比)淋洗,将淋洗液混合后进一步浓缩,用氮吹仪定容至0.5mL左右.
采用HP6890-HP5973气相色谱-质谱联用仪对DDT进行定量测定.气相色谱柱为DB-5MS(30m×0.25mm×0.25μm).载气为高纯氦气,流量为1mL/min.进样口温度250℃,不分流进样,进样量1μL.升温程序为:起始温度80℃,保持2min后以15℃/min升至220℃,再以10℃/min升至300℃,保持2min.采用内标准法定量,DDT在实验过程中的回收率为92.1%~99.0%.DDT的去除率%=(灭菌对照土壤中DDT的浓度-白腐真菌处理后土壤中DDT的浓度)×100/土壤中DDT的初始浓度.
2 结果与讨论
2.1 Tween60对土壤中白腐真菌降解DDT的影响
考察了不同浓度的Tween60存在下白腐真菌对土壤中DDT的降解情况.在灭菌对照处理中,避光、封闭处理条件尽可能避免了DDT的光解、挥发等其它损失,DDT回收率为91.2%~99.6%.如图1所示,在白腐真菌处理体系中,当没有添加Tween60时,处理前10d去除率较低,仅为5.4%,从第10d开始去除率开始迅速增加,第30d时去除率已经达到了48.1%,可见菌株在土壤中对DDT具有一定的降解能力,但需要一段时期通过自身调整来适应土壤环境和污染物的胁迫.而在添加Tween60处理时,DDT的去除率随处理浓度的不同而呈现出一定的差异.如在处理10d后,高浓度Tween60(0.5~1.5mg/g干土)存在时DDT的去除率显著高于对照及低浓度Tween60(0.1和0.25mg/g干土)处理(P<0.05).在处理30d时,添加了浓度为0.1,0.25,0.5,1.0和1.5mg/g干土的Tween60的土壤中,DDT的去除率分别为52.9%,57.8%,62.0%,62.9%和62.1%,相比于未添加表面活性剂处理时的去除率分别提高了4.8%,9.7%,13.9%,14.8%和14.0%.该结果表明Tween60能促进土壤中DDT的生物降解率,且在一定浓度范围内去除效果随着Tween60浓度的提高而增加.
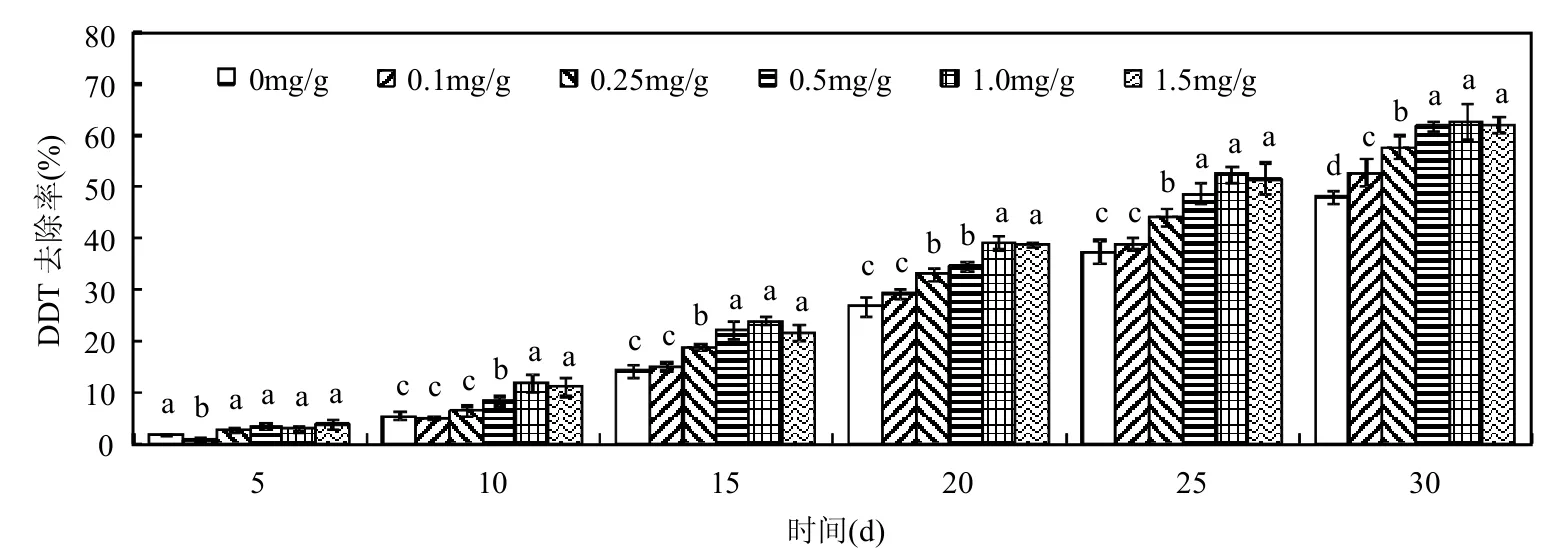
图1 Tween60对土壤中DDT生物降解的影响Fig.1 Effect of Tween 60 on biodegradation of DDT in soil不同字母表示各处理间在0.05水平上的显著差异,下同
在污染土壤的生物修复技术中,有机污染物的生物可利用性成为制约生物修复效率的关键因素之一.Tween60的临界胶束浓度(CMC值)很低,在较低浓度时即可通过形成胶束提高DDT的溶解度,促使其从土壤颗粒上解吸下来[9].章瑞英等[10]同样发现Tween60可通过增溶作用将土壤中的DDT洗脱下来,且随着Tween60质量浓度的逐渐升高,土壤中DDT的总洗脱效率逐渐增大.当DDT被Tween60从土壤中洗脱出来,其生物利用性和生物可降解性也必将随之大幅增加,并通过白腐真菌降解而去除.Zheng等[12]利用非离子表面活性剂Tween80洗脱PAHs污染土壤后,利用白腐真菌降解洗脱液中的PAHs,去除率达到90%以上.此外,在一定的浓度范围内,Tween60可作为白腐真菌生长所需碳源促进菌株的生长活性,从而提高降解菌的降解活性,这也是Tween60能促进土壤中DDT生物降解的原因之一[13].但同时,高浓度的Tween60可能不利于该菌株的生长甚至产生毒性,从而导致去除率在浓度升至1.5mg/g干土时不但没有进一步增加,反而略有下降.该结果表明土壤中添加1.0g/L左右的Tween60是有利于提高土壤修复效果的.
2.2 SDS对土壤中白腐真菌降解DDT的影响不同处理时间内,白腐真菌在含有不同浓度SDS土壤中对DDT的降解效果见图2.在低浓度时,SDS对DDT生物降解的促进效果不明显,如在浓度为0.1,0.25和0.5mg/g干土的SDS土壤溶液中,DDT的去除率与不添加SDS相比变化不大.而随着SDS浓度的进一步升高至1.0mg/g干土时,土壤中DDT在20d后的去除率均显著高于对照及低浓度处理(P<0.05),30d去除率提高至最高的53.9%.这是由于SDS的浓度低于CMC值时,胶束尚未形成,绝大多数被土壤颗粒吸附的DDT仍然难以解吸下来,使得降解菌难以利用,因此对降解的促进效果也就不明显.而当浓度增加至CMC值以上的1.0mg/g干土时,胶束开始形成并逐渐增加,致使DDT从土壤中开始解吸出来[9],并被降解菌利用,此时去除率才开始呈现增加的趋势.然而,同Tween60相似,随着SDS浓度提高至1.5mg/g干土,去除率并没有进一步增加,这可能是由于高浓度的SDS对菌株生长繁殖产生抑制作用所致.
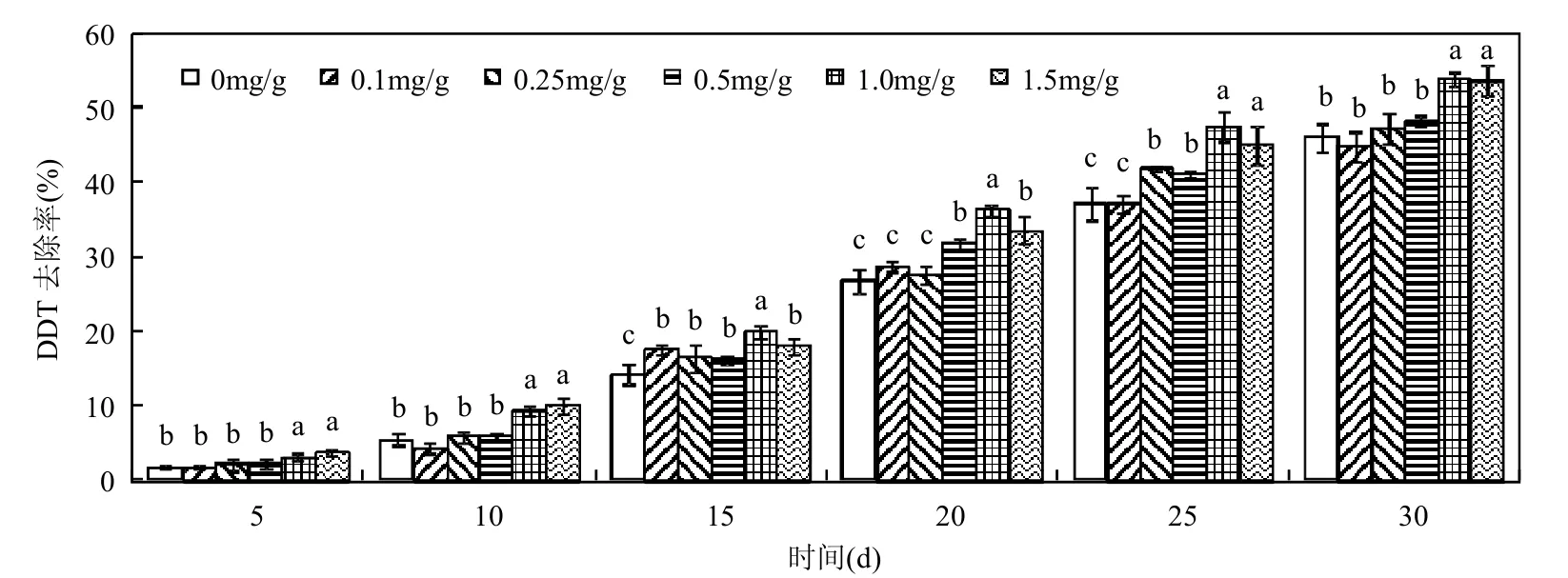
图2 SDS对土壤中DDT生物降解的影响Fig.2 Effect of SDS on biodegradation of DDT in soil
比较SDS与Tween60对白腐真菌修复DDT污染土壤的强化效果发现,相同浓度条件下,非离子表面活性剂Tween60要明显好于阴离子表面活性剂SDS.这主要是由于两表面活性剂在CMC值以及对DDT解吸能力的不同所致. Tween60的CMC值比SDS要低得多,具有更大的增溶容量,能将更多的DDT从土壤中解吸下来而被降解.还有研究表明,不同类型的表面活性剂被土壤吸附程度不同.被土壤强烈吸附的表面活性剂由于损失大,有效浓度越低,进而导致在强化土壤生物修复效率上呈现出差异[9].
2.3 Tween60-SDS对土壤中白腐真菌降解DDT的影响
为了探索阴-非离子混合表面活性剂对白腐真菌修复DDT污染土壤的强化效果,本文研究了土壤修复体系中总浓度为1.0mg/g干土时的Tween60和SDS组合在不同质量配比处理下DDT的降解去除效果.如图3所示,Tween60和SDS以不同质量配比后,各处理间的DDT降解去除效率呈现出一定的差异.尤其在处理20d后,Tween60和SDS的质量比在2:1以上时的DDT去除率开始呈现出显著高于质量比为1:1时去除率的情况(P<0.05).以处理第30d为例,当Tween60和SDS的质量比为3:1,2:1和1:1时,DDT的去除率分别为67.4%,65.1%和57.1%,即呈现出随着Tween60和SDS的质量比的增加,DDT去除率越高的趋势.此外,比较表面活性剂在单独和组合处理下DDT污染土壤的生物修复效果发现,当Tween60和SDS的质量比为3:1和 2:1时的去除率均要高于两表面活性剂单独处理;而二者质量比为1:1时的去除率低于Tween60单独处理,但仍高于SDS单独处理.从结果可见,将Tween60与SDS复配后可一定程度上改变白腐真菌对土壤中DDT的降解去除效果,在本研究中, 提高混合表面活性剂中Tween60的比例有利于DDT污染土壤的修复效果.

图3 Tween60-SDS对土壤中DDT生物降解的影响Fig.3 Effect of Tween60-SDS on biodegradation of DDT in soil
有研究表明,当非离子表面活性剂和阴离子表面活性剂共存时可形成混合胶束和混合吸附层,减弱阴离子表面活性剂离子间的排斥作用,从而产生协同增溶的效果[14].而且阴离子表面活性剂还能通过减少非离子表面活性剂单体的浓度,从而减轻土壤中非离子表面活性剂的吸附损失[15].万卷敏等[16]研究发现,在土壤中将SDS与Tween80混合后,二者吸附量均下降,尤其Tween80吸附量降低的幅度最大.据此推测,本研究中SDS在单独存在时对DDT的降解去除效果虽然低于Tween60,但在表面活性剂共存体系中,一方面SDS的加入改善了Tween60被土壤颗粒的吸附损失,提高其在溶液中的有效浓度;另一方面,二者共存后通过协同增溶作用促进了DDT从土壤固相进入土壤液相,进而提高了DDT的生物可利用性和微生物降解效率.但需要指出的是,作为阴离子表面活性剂,SDS虽然可一定程度上提高土壤生物修复效果,但被指出具有一定的生物毒性,并能引起土壤质地结构的变化[17],因此在大规模应用于土壤修复时需要注意.
2.4 接菌量对DDT污染土壤修复效率的影响
合适的投菌量可保证足够的存活率和一定的种群水平,建立起降解菌数量上的优势,对污染土壤起到快速、高效的修复效果.本文研究了在表面活性剂浓度为1.0mg/g干土时,不同接菌量条件下土壤中DDT降解情况,以考察白腐真菌接种量对土壤修复效率的影响.如图4所示,在修复处理30d后,添加不同接种量的白腐真菌对土壤中DDT都具有一定的降解作用,但降解去除效果在各接菌量处理间差异显著(P<0.05).在Tween60处理体系,接菌量为0.2和0.4mL/g时的去除率仅为27.1%和34.5%,而接菌量提高到0.8和1.0mL/g时,去除率达到64.1%和67.9%,显著高于低接菌量时的去除率.在Tween60-SDS(3:1)混合处理中的DDT去除效果要略好于Tween60处理, 最低去除率出现在0.2mL/g接菌量时的29.1%,最高去除率出现在接菌量为1.0mL/g时的70.9%,而且高接菌量(≥0.6mL/g)时的去除率同样显著高于低接菌量(≤0.4mL/g)时的去除率,即DDT去除率随着接菌量的增加而显著增加.该结果表明适当提高接种量有利于降解菌的增殖,缩短延迟期,提高降解活性.
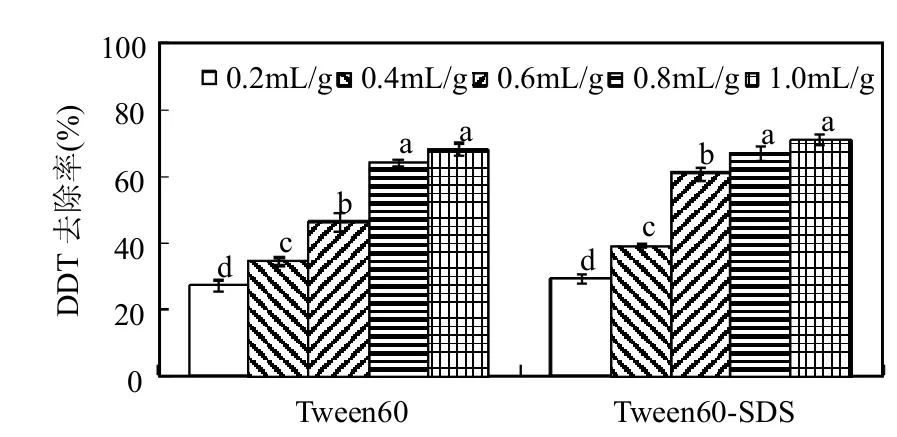
图4 接菌量对土壤中DDT生物降解的影响Fig.4 Effect of inoculum amount on biodegradation of DDT in soil
从图4还发现,当接菌量增至最大的1.0mL/g时,降解去除效果与接菌量为0.8mL/g时相比虽有增加,但并不显著.原因可能是当接菌量达到一定程度时,菌体与底物已经充分接触,此时接菌量已接近饱和,不再是制约DDT降解的主要因素[18].若继续投加降解菌可能会导致种间竞争,出现营养不足的现象,反而影响自身代谢过程及修复效率.因此,该试验条件下白腐真菌接种量控制在0.8~1.0mL/g之间对于提高土壤修复效率是比较合适的.
2.5 土壤含水率对DDT污染土壤修复效率的影响
土壤水分通过改变土壤孔隙度、氧化还原电位、污染物溶解性及土壤吸附性等对土壤修复效率产生影响[19].本文研究了在表面活性剂浓度为1.0mg/g干土,接菌量为0.6mL/g,不同土壤含水率条件下DDT的降解去除情况.如图5所示,处理30d后,含水率不同的土壤中DDT去除率亦有显著差异(P<0.05),呈现出随含水率的增加而显著增加的趋势.在Tween60处理体系中,土壤含水率为10%和20%时DDT的去除率仅为12.4%和21.1%,而随着含水率上升至40%,去除率也快速提高至56.1%,当含水率达到50%时,去除率达到最高的69.2%.而在Tween60-SDS(3:1)处理中,含水率为10%时,去除率为最低的14.0%,在含水率为50%时的去除率最高,达到74.9%.该结果表明含水率会明显影响白腐真菌对土壤中DDT的降解去除效率.土壤水分少,DDT被土壤颗粒吸附,降解菌难以利用;而土壤水分越多,表面活性剂生成的胶束就越多,从而加速DDT从土壤固相上的解吸,有利于DDT的生物降解.此外,土壤水分的增加同样有利于降解菌的生长繁殖和酶活性的发挥[20],进一步促进了对污染土壤中DDT的降解去除.
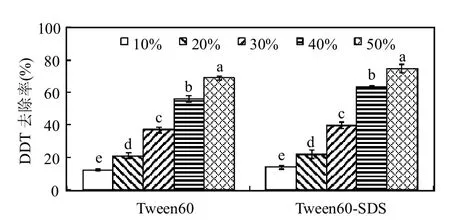
图5 土壤含水率对DDT生物降解的影响Fig.5 Effect of moisture on biodegradation of DDT in soil
3 结论
3.1 在一定浓度范围内,非离子表面活性剂Tween60和阴离子表面活性剂SDS通过对DDT的增溶解吸作用,可不同程度地促进白腐真菌P. lindtneri GB1027对土壤中DDT的降解,且去除率随着表面活性剂浓度的升高而增加.相同浓度条件下,Tween60对土壤生物修复作用的强化效果要好于SDS.
3.2 将两种类型的表面活性剂以不同质量比进行混合后,对DDT去除率的强化效果明显区别于单一表面活性剂.不同处理间DDT去除率大小顺序为:Tween60:SDS(3:1)>Tween60:SDS(2:1)>Tween60:SDS(1:1),即Tween60的比例越高,DDT降解去除效果越好,其中Tween60:SDS(3:1)和Tween60:SDS(2:1)处理中DDT去除率要高于Tween60单独处理.
3.3 菌株接种量是制约土壤生物修复效果的主要因素之一.高接菌量可以保持降解菌数量上的优势,缩短生物降解的延迟期,从而提高对DDT的降解活性.本研究中,接菌量为0.8和1.0mL/g干土时,对土壤中DDT的降解去除效果较好.
3.4 土壤含水率会显著影响DDT污染的修复效率.土壤水分越多越有利于发挥表面活性剂的增溶和洗脱DDT的效果,提高DDT的生物利用性和去除率.在土壤含水率为10%~50%范围内,DDT去除率随着含水率的升高而显著增加,土壤含水率为50%时DDT的去除率可达到70%左右.
[1]陈 瑶.湖南省农田土壤中HCH和DDT残留状况研究 [J]. 中国环境监测, 2012,28(5):44-47.
[2]毕峻奇,严登峰,郑丽丽,等.福州地区不同土地利用类型土壤中六六六和滴滴涕的残留特征 [J]. 农业环境科学学报,2012,31(9):1752-1758.
[3]欧 丽,李义连.武汉某废弃农药厂土壤中DDT及其代谢产物的空间分布特征研究 [J]. 安全与环境工程, 2014,21(2):46-50.
[4]安凤春,莫汉宏,郑明辉,等.DDT及其主要降解产物污染土壤的植物修复 [J]. 环境化学, 2003,22(1):19-25.
[5]Zhao Y C, Yi X Y, Zhang M, et al. Fundamental study of degradation of dichlorodiphenyltrichloroethane in soil by laccase from white rot fungi [J]. International Journal of Environmental Science and Technology, 2010,7(2):359-366.
[6]王定美,徐 智,黄锦楼,等.土壤中六六六和滴滴涕的堆肥生物修复研究 [J]. 环境污染与防治, 2008,30(11):58-61.
[7]赵煜坤,廖海丰,陈一楠,等.六六六、滴滴涕污染土壤的微生物修复作用研究 [J]. 江苏农业科学, 2011,39(2):463-465.
[8]Xiao P, Mori T, Kamei I, et al. A novel metabolic pathway for biodegradation of DDT by the white rot fungi, Phlebia lindtneri and Phlebia brevispora [J]. Biodegradation. 2011,22:859-867.
[9]肖鹏飞,应 杉,李玉文.阴-非离子表面活性剂对黑土中DDTs的洗脱研究 [J]. 水土保持学报, 2014,28(6):283-288.
[10]章瑞英,王国庆,陈伟伟,等.三种表面活性剂对高浓度DDTs污染土壤的洗脱作用 [J]. 生态环境学报, 2009,18(6):2166-2171.
[11]谢文明,李苑泽,安丽华,等.表面活性剂对南瓜消解土壤中DDT的影响 [J]. 农业环境科学学报, 2007,26(5):1640-1644.
[12]Zheng Z, Obbard J P. Polycyclic Aromatic Hydrocarbon Removal from Soil by Surfactant Solubilization and Phanerochaete chrysosporium Oxidation [J]. Journal of Environmental Quality,2002,31:1842-1847.
[13]肖鹏飞,孙丽军,李玉文.Tween系列表面活性剂对白腐菌降解氯丹影响 [J]. 环境工程学报, 2014,8(10):4468-4473.
[14]王 欢,王 瑶,肖鹏飞.非-阴离子表面活性剂对PAHs的增溶作用及无机盐的强化效果研究 [J]. 环境科学与管理, 2014,39(10):96-100.
[15]施 周,何小路.表面活性剂洗脱污染土壤中多氯联苯(PCBs)的研究与应用 [J]. 生态环境, 2004,13(4):666-669.
[16]万卷敏,杨亚提,刘 霞,等.塿土对阴-非离子表面活性剂的吸附特征研究 [J]. 农业环境科学学报, 2011,30(4):690-696.
[17]姜 霞,陈 刚,金相灿,等.复合表面活性剂对污染土壤中柴油的增溶和洗脱作用 [J]. 生态环境学报, 2009,18(2):523-530.
[18]Comeau Y, Greer C W, Samson R. Role of inoculums preparation and desity on the bioremediation of 2,4-D contaminated soils [J]. Applied Microbiology Biotechnology, 1993,38:681-687.
[19]Ingerslev H, Torang L, Lock M L, et al. Primary biodegradation of veterinary antibiotics in aerobic and anaerobic surface water simulation systems [J]. Chemosphere, 2001,44:865-872.
[20]金彩霞,陈秋颖,吴春艳,等.环境条件对土壤中磺胺间甲氧嘧啶降解的影响 [J]. 环境污染与防治, 2009,31(9):10-14.
Enhancement of Tween60 and SDS for bioremediation of DDT-contaminated soil by white rot fungus.
XIAO Peng-fei1∗,LI Yu-wen1, KONDO Ryuichiro2(1.College of Forestry, Northeast Forestry University, Harbin 150040, China;2.Faculty of Agriculture, Kyushu University, Fukuoka 812-8581, Japan ). China Environmental Science, 2015,35(12):3737~3743
The effects of nonionic surfactant Tween60 and anionic surfactant SDS on bioremediation of DDT contaminated soils by white rot fungus Phlebia lindtneri GB1027 were investigated. The results showed that Tween 60 and SDS could enhance the degradation rate of DDT by fungus in soil, and the optimum concentration of both surfactants for fungal degradation of DDT was 1.0mg/g. P. lindtneri GB1027 showed the higher degradation activity of DDT from soil with Tween60than that with SDS. The efficiency of Tween60-SDS mixed surfactants for enhancing biodegradation capacity was as: Tween60-SDS (3:1)>Tween60-SDS (2:1)>Tween60-SDS (1:1), and the enhancing capacity of Tween60-SDS (3:1) and Tween60-SDS (2:1) for fungal degradation of DDT from soil was higher than that of Tween 60. The inoculum amount could greatly enhance the removal rate of DDT from soil by P. lindtneri GB1027at a range of 0.2 to 1.0mL/g, and the highest degradation rate of DDT was 70.9% within 30days, when the inoculum amount of fungus was 1.0mL/g. It was also found that fungal degradation rates of DDT increased sharply with increasing soil moisture at a range between 10% and 50%, and that DDT of about 70% was removed from soil with moisture of 50% during 30 days of incubation. The above results confirmed the workability of white rot fungus-surfactants augmented remediation of DDT-contaminated soil.
DDT;surfactant;white rot fungus;biodegradation;soil remediation
X53
A
1000-6923(2015)12-3737-07
肖鹏飞(1978-),男,辽宁丹东人,讲师,博士,主要从事污染土壤的修复技术研究.发表论文30余篇.
2015-04-29
中央高校基本科研业务费专项资金项目(DL13CB12);国家自然科学基金项目(41201307);日本农林水产省农产品安全项目(PO-3216);人社部留学回国人员科技活动择优资助项目
* 责任作者, 讲师, xpfawd@nefu.edu.cn
