混合菌种发酵生产低酸度川味香肠加工过程中生物胺含量的变化*
2015-11-19孙霞巩洋杨勇曾建华刘涛杨敏卿丹丹李静
孙霞,巩洋,杨勇,曾建华,刘涛,杨敏,卿丹丹,李静
(四川农业大学食品学院,四川雅安,625014)
香肠是我国传统腌腊肉制品之一,川味香肠因具有色亮、味美、爽口等特点,在国内较为有名。川味香肠主要通过自然发酵,发酵微生物来源于环境中混入的杂菌和肉中有益菌与杂菌竞争形成的优势菌群,而其可能具有氨基酸脱羧酶活性,导致川味香肠中氨基酸脱羧形成生物胺。生物胺(biogenic amines,BA)是由氨基酸脱羧或醛和酮氨基化形成的具有生物活性的小分子量含氮有机化合物[1],过量生物胺会引起血管扩张,导致人体的不良反应,因此对香肠加工过程中生物胺含量变化进行研究具有重要意义。
生物胺的含量受多种因素影响,如温度、湿度、pH、发酵剂的种类和数量等[2-3]。一般通过接种单一或者混合发酵剂以及筛选具有胺氧化酶的菌株等来控制香肠中生物胺[4-7]。有研究发现,香肠pH值较低,能抑制氨基酸脱羧酶阳性细菌的生长,从而降低香肠中生物胺积累[8]。帅瑾[9]通过接种植物乳杆菌和葡萄球菌生产川式萨拉米香肠,pH值较低,但与传统川味香肠的口感差异很大,很难满足当地人民的饮食习惯。生物胺的积累与温湿度存在复杂的关系,而不是简单地呈正相关或反相关[10];另有学者发现,较高发酵温度适宜乳酸菌生长,能提高乳酸菌对生物胺合成菌的竞争优势,从而降低香肠中生物胺的含量[11];还有学者研究发现葡萄球菌和微球菌具有产生物胺氧化酶的能力,接种此类发酵剂不但可以提升香肠的风味,还能降低香肠中生物胺的含量[12]。因此可以通过选择合适的温湿度条件和发酵剂协同作用来抑制香肠中生物胺的积累。
本研究通过以植物乳杆菌(Lactobacillus plantarum)、戊糖片球菌(Pediocossus pentosaceus)、葡萄球菌(Staphylococcus)作为发酵剂,采用智能化控温控湿现代工艺生产低酸度川味香肠,研究其加工过程中pH值、氨基酸态氮和生物胺含量的变化,评价发酵剂应用安全性,找出适宜的应用条件,为川味香肠的工业化生产提供理论支持。
1 材料与方法
1.1 材料与仪器
葡萄球菌(Staphylococcus)、植物乳杆菌(Lactobacillus plantarum)和戊糖片球菌(Pediocossus pentosaceus)均由四川农业大学肉品研究室从传统自然发酵川味香肠中分离得到[9,13]。新鲜猪后腿肉、肠衣、辣椒、花椒和食盐等调味料均购于当地农贸市场。色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺及丹磺酰氯均购自美国Sigma公司;乙腈和丙酮为色谱纯;HCl、氨水、NaOH、Na2CO3等均为分析纯;超纯水为实验室自制(Milli-Q,Millipore)。
LHS-250SC恒温恒湿培养箱,上海荣丰科学仪器有限公司;ST16R高速冷冻离心机,北京博仪恒业科技发展有限公司;HWS24电热恒温水浴锅,上海一恒公司;BMS602型均质机,德国BRT公司;海尔冰箱;电子天平;高效液相色谱仪(岛津LC-2010CHT);超声波清洗器(KH5200B型);PHS-3C型酸度计,上海仪电科学仪器股份有限公司;SW-GJ-IFD型超净工作台,苏净集团泰安公司。
1.2 川味香肠的制作
参照张雪梅[14]的配方:猪肉100 kg(皮下脂肪20 kg,瘦肉 80 kg),食盐 2.5 kg,辣椒粉 1.0 kg,花椒粉 0.4 kg,白砂糖 1.0 kg,味精 0.15 kg,白酒 1.0 kg,十三香 0.05 kg,NaNO30.025 kg,NaNO20.007 5 kg。
工艺流程:原料肉→预处理→绞碎→添加配料→接种→混合→灌肠→发酵→成熟→干燥→成品
发酵剂的制作:30℃下液态培养基培养菌株14 h后,置于4℃下4 000 r/min冷冻离心10 min,用无菌生理盐水洗涤1次再离心,收集菌体并适量稀释,运用血球计数法计数,接种量为106CFU/g,植物乳杆菌、戊糖片球菌和葡萄球菌按1∶1∶1的比例混合加入。
本研究在单因素和正交实验的基础上,确定低酸度川味香肠的工艺参数:发酵温度20℃,发酵相对湿度75%,发酵时间12 h,葡萄糖添加量0.10%;成熟温度13℃,成熟相对湿度60%,成熟时间4 d;干燥温度55℃,干燥时间24 h。
实验分为4个处理,以字母A、B、C、D表示。A是接种混合发酵剂并在控温控湿条件下生产的低酸度川味香肠;B是不接种混合发酵剂但在控温控湿条件下生产的川味香肠;C是接种混合发酵剂在自然条件 (温度为8~15℃,相对湿度为75% ~90%)下生产的川味香肠;D是不接种混合发酵剂在自然条件(温度为8~15℃,相对湿度为75% ~90%)下生产的传统川味香肠。
1.3 样品采集
取川味香肠在加工过程中的7个工艺点,0 h(原料肉)、12 h(发酵结束)、36 h(成熟 1 d)、60 h(成熟2 d)、84 h(成熟 3 d)、108 h(成熟 4 d)、132 h(干燥结束)的香肠作为指标测定样品。
1.4 实验方法
1.4.1 pH的测定
参照GB/T9695.5—2008。取10 g样品4 000 r/min均质2 min,加入90 mL蒸馏水,浸提30 min,过滤,滤液用酸度计测定。
1.4.2 氨基酸态氮测定
采用甲醛滴定法进行测定[15]。
1.4.3 生物胺标准溶液的配制和衍生
称取色胺、苯乙胺、腐胺、尸胺、组胺、酪胺和亚精胺各50 mg,用0.1 mol/L HCl定容到50 mL,在4℃冰箱避光保存。吸取单标储备液,置于10 mL容量瓶,用0.1 mol/L HCl稀释成浓度为:0.5、1.0、2.5、5.0、10、20 μg/mL混合标准溶液,在4℃冰箱避光保存。
取1 mL混合标准溶液,加200 μL 2 mol/L NaOH使之呈碱性,再加入300 μL饱和NaHCO3溶液缓冲,室温下反应30 min,然后加入2 mL 10 mg/mL丹磺酰氯丙酮溶液,在40℃下处于黑暗中反应45 min后加入100 μL的NH4OH终止反应,室温下暗反应30 min,去除残留丹磺酰氯溶液,加入乙腈使终体积为5 mL。衍生处理后0.22 μm滤膜过滤,用于分析检测。
1.4.4 样品处理
取5 g香肠加入20 mL 0.1 mol/L的HCl,匀浆机上彻底匀浆,冷冻离心机(4℃,4 000 r/min)离心10 min,沉淀部分如前的方法再重新提取1次。取2次的上清液用0.1 mol/L的HCl定容到50 mL,取1 mL的样液如1.4.3中的方法进行衍生。
1.4.5 色谱条件
色谱柱为 C18(4.6 mm ×250 mm,5 μm),流速 1 mL/min,紫外检测波长 254 nm,进样量 10 μL,柱温30℃,流动相A为H2O,流动相B为乙腈,采用梯度洗脱程序,见表1。

表1 梯度洗脱程序Table 1 Gradient elution program
2 结果与分析
2.1 pH值变化
川味香肠加工过程中pH值的变化如图1所示。A组pH值呈先下降后上升的趋势,B、C和D组pH值变化不显著(P>0.05)。在发酵期(0~12 h),A组pH值迅速下降(P<0.01),是因为A组接种了植物乳杆菌和戊糖片球菌,在适宜温度下乳酸菌生长繁殖,分解碳水化合物产生乳酸。C组和D组pH值变化不显著,可能是因为环境温度较低,乳酸菌生长受到抑制。在成熟前期(12~60 h),A组pH值迅速下降,是因为虽然温度和相对湿度下降,但香肠中心温度还未达到成熟温度,乳酸菌还在继续生长。在成熟后期(60~108 h),A组pH值缓慢下降(P>0.05),是因为环境温度较低,抑制了乳酸菌的生长。在干燥期(108~132 h),4组香肠pH值均呈略微上升趋势(P>0.05),这是由于环境温度较高促使蛋白质不断降解产生碱类物质。

图1 低酸度川味香肠加工过程中pH值的变化Fig.1 Changes of pH in low acidity Sichuan-style sausage during processing
2.2 氨基酸态氮的变化
在川味香肠加工过程中氨基酸态氮的变化如图2所示。氨基酸态氮呈上升趋势(P<0.05)。在发酵期(0~12 h),A组和B组氨基酸态氮含量明显高于C组和D组(P<0.01),这可能是由于微生物在较高的发酵温度下产生蛋白酶促进蛋白质降解,使香肠中氨基酸态氮含量提高。

图2 低酸度川味香肠加工过程中氨基酸态氮的变化Fig.2 Changes of amino acidic nitrogen in low acidity Sichuan-style sausage during processing
在整个成熟(12~108 h)过程中,4组香肠氨基酸态氮变化不显著(P>0.05),这可能是由于成熟温度较低,抑制了微生物活动和组织蛋白酶活性使蛋白质降解作用降低,此外部分氨基酸态氮参与了川味香肠风味的形成,自身被消耗。在干燥期(108~132 h),4组香肠氨基酸态氮含量迅速上升(P<0.01),这可能是因为干燥期水分含量降低,使氨基酸态氮相对浓度增大,也可能是因为水分散失导致食盐含量增加,蛋白质结构遭到破坏,使蛋白酶更易作用于蛋白质[16]。干燥结束时,A、B、C和D组氨基酸态氮分别为0.215%、0.237%、0.193%和0.185%,4组差异不显著(P>0.05),这可能是由于4组香肠经过快速干燥水分散失量大,氨基酸相对干基含量区别不显著。
2.3 混标的分离与分析
图3是生物胺混合标样的色谱图。由图3可见,本实验所采用的HPLC方法,可将溶剂峰及杂质峰在前5 min内全部洗脱出。而7种生物胺均能在20 min内有效分离,采用该方法具有较好的分离效果。从表2可以看出,7种生物胺的峰面积与其相应的浓度分别呈良好的线性关系,相关系数均大于0.999,通过该方法可准确测定出生物胺的含量。
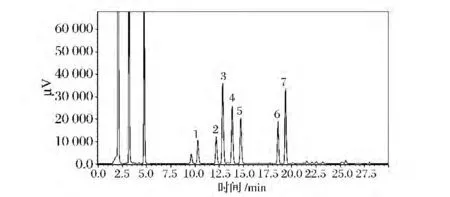
图3 生物胺混合标准HPLC色谱图Fig.3 The HPLC chromatogram for a standard mixture of biogenic amines

表2 七种生物胺回归方程及相关系数Table 2 Regression equations and correlation coefficients of seven biogenic amines
2.4 各种生物胺含量的变化
2.4.1 四组川味香肠中的生物胺含量
4组川味香肠中7种生物胺含量如表3所示。4组香肠的生物胺总量在61.981~107.852 mg/kg,A组生物胺总量显著低于B、C、D组(P<0.01),由于A组较低的pH值抑制了生物胺的积累;B组生物胺总量最高,为107.852 mg/kg,这可能是由于B组的温度较高,增强了蛋白酶的活性,促进蛋白质降解产生生物胺。4组香肠的生物胺,除亚精胺外,其余生物胺含量差异显著(P<0.01),A组香肠中色胺、苯乙胺、腐胺、组胺和酪胺含量均显著低于B、C、D组(P<0.01),说明混合发酵剂在适宜的温湿度条件下对其抑制作用显著。4组香肠的生物胺含量均较低,未超过FDA相关的标准。

表3 四组川味香肠中的生物胺含量 单位:mg/kgTable 3 The content of biogenic amines in four kinds of Sichuan-style sausage
2.4.2 色胺含量的变化
在川味香肠加工过程中色胺含量呈缓慢增加趋势,见图4。在发酵期(0~12 h),4组香肠色胺含量变化不明显(P>0.05);在成熟期(12~108 h),4组香肠色胺含量均呈上升趋势,其中B组和D组变化显著(P<0.01),这可能是由于B组较高的温湿度更有利于蛋白质的降解,D组在自然条件下可能侵入了某些能够产生色氨酸脱羧酶的微生物,导致色胺的积累;在干燥期(108~132 h),4组香肠色胺含量均呈上升趋势,且C组变化最为明显(P<0.01),这可能是由于自然环境中微生物与接种的混合发酵剂竞争形成优势,在较高的温度下使色氨酸脱羧产生色胺;干燥结束时,B组和D组色胺含量分别达到了6.362 5 mg/kg和5.845 0 mg/kg显著高于A组(3.211 5 mg/kg),而与C组(5.065 1 mg/kg)差异不显著(P>0.05),这可能是由于混合发酵剂在适宜的温湿度条件下生长产生了酸类物质降低了pH抑制了色胺的积累,这与谭李红[17]等研究结果相似,说明混合发酵剂在适宜的温湿度条件能够抑制色胺的积累。
2.4.3 苯乙胺含量的变化
在川味香肠加工过程中的苯乙胺含量呈增加的趋势,见图5。在发酵期(0~12 h),B组和D组苯乙胺快速增加(P<0.01),而 A组增加量较少(P>0.05),这可能是由于A组接种的混合发酵剂在适宜的温湿度条件下生长产生了酸类物质降低了pH抑制了苯乙胺的积累;在成熟期(12~108 h),4组香肠苯乙胺含量均呈上升趋势,其中B组变化最为明显(P<0.01);在干燥期(108~132 h),A组苯乙胺积累较少,B组苯乙胺积累最多,这可能是由于B组长期处于适宜的温湿度环境导致氨基酸脱羧酶不断脱羧形成苯乙胺;干燥结束时,B组和C组中苯乙胺含量变化最为明显(P<0.01),由原料肉的1.319 5 mg/kg增加到24.817 7 mg/kg和16.332 3 mg/kg,A组和D组虽然也呈上升趋势,但A组的含量(8.037 2 mg/kg)显著低于B组和C组,说明混合发酵剂在适宜的温湿度条件下能显著抑制苯乙胺的积累(P<0.01)。
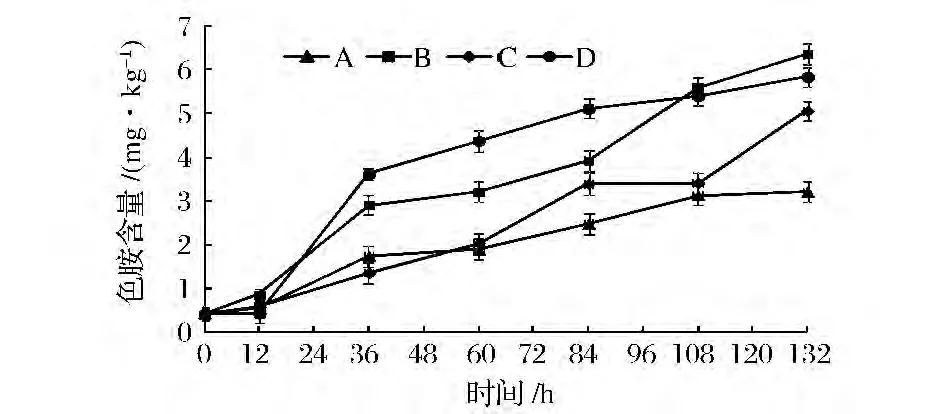
图4 低酸度川味香肠加工过程中色胺含量的变化Fig.4 Changes of amino tryptamine in low acidity Sichuan-style sausage during processing

图5 低酸度川味香肠加工过程中苯乙胺含量的变化Fig.5 Changes of amino phenylethylamine in low acidity Sichuan-style sausage during processing
2.4.4 腐胺含量的变化
在川味香肠加工过程中腐胺含量呈明显增加趋势(P<0.01),见图6。在发酵期(0~12 h),4组香肠腐胺含量变化不明显,A组腐胺含量与其他3组差异不显著(P>0.05),是由于混合发酵剂对腐胺抑制效果不明显;在成熟期(12~108 h),4组香肠腐胺含量均呈上升趋势且4组香肠间差异不明显(P>0.05);在干燥期(108~132 h),4组香肠腐胺含量均呈显著上升趋势(P<0.01),这可能是由于较高温度促使精氨酸和鸟氨酸脱羧产生腐胺,且B组和D组增加量显著高于A组和C组(P<0.01);干燥结束时,B组和D组中腐胺含量分别为17.139 8 mg/kg和16.113 3 mg/kg显著高于A组(10.360 3 mg/kg)和C组(11.977 2 mg/kg),说明混合发酵剂对腐胺有一定的抑制效果。
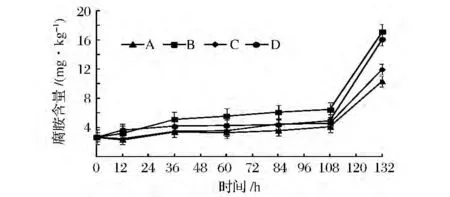
图6 低酸度川味香肠加工过程中腐胺含量的变化Fig.6 Changes of amino putrescine in low acidity Sichuan-style sausage during processing
2.4.5 尸胺含量的变化
在川味香肠加工过程中尸胺含量呈增加趋势,见图7。在发酵期(0~12 h),4组香肠尸胺含量变化不明显,A组尸胺含量与其他3组差异不显著(P>0.05),这可能是由于混合发酵剂对尸胺抑制效果不明显;在成熟期(12~108 h),4组香肠尸胺含量均呈显著上升趋势(P<0.01),B组中尸胺含量均高于其他3组,是由于较高温度促使赖氨酸不断脱羧产生尸胺;在干燥期(108~132 h),4组香肠尸胺也呈不断上升趋势,但A组上升趋势不明显(P>0.05),是由于A组在成熟结束时pH较低,抑制了部分氨基酸脱羧酶活性;干燥结束时,A、B、C和D组香肠中尸胺含量差异不显著(P>0.05),分别为11.483 5、15、692 3、14.389 4和14.697 6 mg/kg,说明混合发酵剂对尸胺有没有显著抑制效果(P>0.05),这与马宇霞[18]等研究发酵剂对熏马肠成熟过程中生物胺含量变化的尸胺含量影响的结果相似。
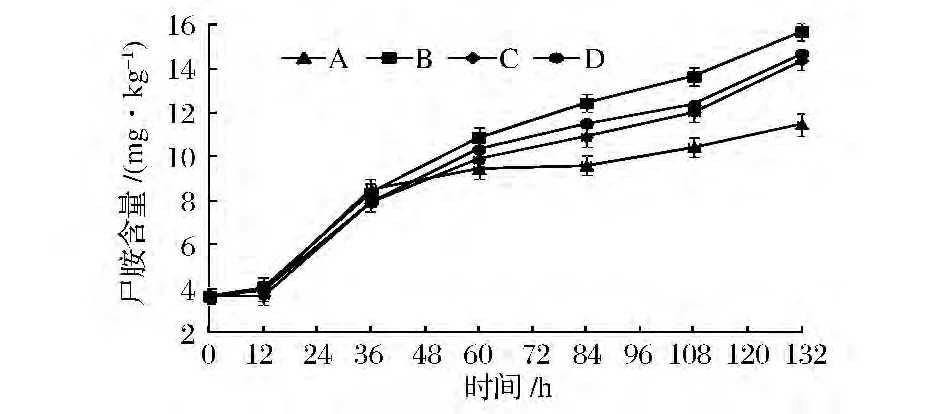
图7 低酸度川味香肠加工过程中尸胺含量的变化Fig.7 Changes of amino cadaverine in low acidity Sichuan-style sausage during processing
2.4.6 组胺含量的变化
在川味香肠加工过程中组胺含量呈增加趋势,见图8。在发酵期(0~12 h),除B组外,其他3组香肠含量变化不明显(P>0.05);在成熟前期(12~60 h),4组香肠组胺含量呈缓慢上升趋势,是由于成熟前期香肠中组氨酸含量比较低;在成熟后期(60~108 h),4组香肠组胺均呈显著上升趋势(P<0.01),这可能是由于时间延长,蛋白质不断分解产生组氨酸,组氨酸进一步分解产生组胺;在干燥期(108~132 h),组胺的变化与成熟后期的趋势一致;干燥结束时,A组香肠中组胺含量显著低于其他3组,而C组与B、D组差异不显著(P>0.05),说明混合发酵剂在适宜的温湿度条件下能显著抑制组胺的积累(P<0.01)。
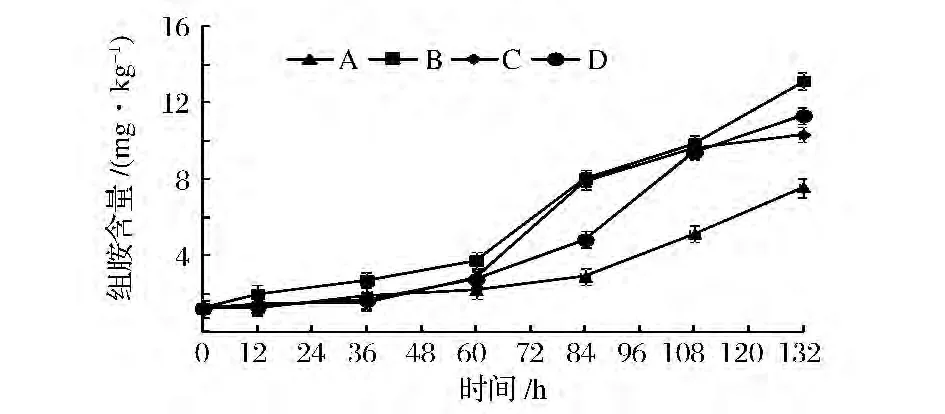
图8 低酸度川味香肠加工过程中组胺含量的变化Fig.8 Changes of amino histamine in low acidity Sichuan-style sausage during processing
2.4.7 酪胺含量的变化
在川味香肠加工过程中酪胺含量呈增加趋势,见图9。在发酵期(0~12 h),4组香肠中酪胺均呈缓慢上升趋势,是由于原料肉中本身带有的微生物具有氨基酸脱羧酶分解酪氨酸产生酪胺;在成熟期(12~108 h),4组香肠酪胺含量均呈上升趋势,且B组积累较多,是由于B组的温湿度条件能增加氨基酸脱羧酶活性;在干燥期(108~132 h),酪胺含量也呈上升趋势(P<0.01),是由于较高温度促使蛋白质分解产生氨基酸;干燥结束时,A组酪胺含量(16.227 8 mg/kg)低于其他3组,说明混合发酵剂能抑制酪胺的积累。

图9 低酸度川味香肠加工过程中酪胺含量的变化Fig.9 Changes of amino tyramine in low acidity Sichuan-style sausage during processing
2.4.8 亚精胺含量的变化
亚精胺是原料肉中常见的生物胺,始终存在于川味香肠中,加工过程中亚精胺含量的变化如图10所示。在川味香肠发酵、成熟和干燥过程中,亚精胺含量比较稳定,基本维持在3.7~5.1 mg/kg,说明成熟时间、温湿度和混合发酵剂对亚精胺的含量影响不显著(P>0.05)。这与朱志远[19]等研究不同发酵剂对发酵香肠中生物胺的影响的结果是相似的。
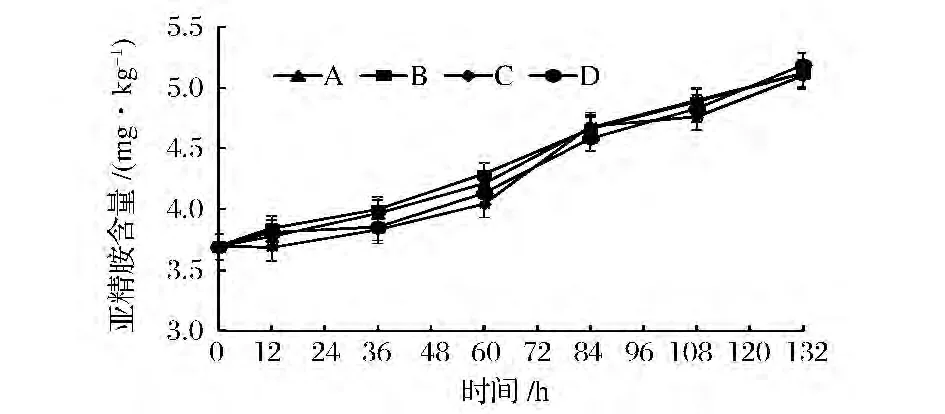
图10 低酸度川味香肠加工过程中亚精胺含量的变化Fig.10 Changes of amino spermidine in low acidity Sichuan-style sausage during processing
3 结论
通过接种植物乳杆菌、戊糖片球菌和葡萄球菌并在智能化控温控湿条件下生产的低酸度川味香肠,干燥结束时,其色胺、苯乙胺、腐胺、尸胺、组胺和酪胺均低于B组、C组和D组,其中色胺、苯乙胺、腐胺、组胺和酪胺均显著低于B组(P<0.01),B组的色胺、苯乙胺、腐胺、尸胺、组胺和酪胺均高于A组、C组和D组;四组川味香肠的亚精胺的含量差异不显著(P>0.05)。结果表明:混合发酵剂在适宜的温湿度条件下能显著抑制低酸度川味香肠中色胺、苯乙胺、腐胺、组胺和酪胺的积累(P<0.01),而对尸胺的抑制作用不显著(P>0.05)。
[1] Maijala R,Nurmi E,Fischer A.Influence of processing temperature on the formation of biogenic amines in dry sausages[J].Meat Science,1995,39(1):9 - 22.
[2] Talona R,Leroya S,Leberta I,et al.Safety improvement and preservation of typical sensory qualities of traditional dry fermented sausages using autochthonous starter cultures[J].International Journal of Food Microbiology,2008,26(1):227-234.
[3] 李平兰,沈清武.干发酵香肠中生物胺的产生与控制[J].食品与发酵工业,2004,30(11):59-64.
[4] Giulia T,Fabio C,Cristiana C,et al.Effects of starter cultures and fermentation climate on the properties of two types of typical Italian dry fermented sausages produced under industrial conditions[J].Food Control,2012,26(2):416-426.
[5] ZHANG Qi-lin,LIN Sheng-lin,NIE Xiao-hua.Reduction of biogenic amine accumulation in silver carp sausage by an amine-negativeLactobacillus plantarum[J].Food Control,2013,32(2):496 -500.
[6] NIE Xiao-hua,ZHANG Qi-lin,LIN Sheng-li.Biogenic amine accumulation in silver carp sausage inoculated withLactobacillus plantarumplusSaccharomyces cerevisiae[J].Food Chemistry,2014,153(15):432 -436.
[7] Simiona C A,Vizireanub C,Alexeb P,et al.Effect of the use of selected starter cultures on some quality,safety and sensorial properties of Dacia sausage,a traditional Romanian dry-sausage variety[J].Food Control,2014,35(1):123-131.
[8] 刘海燕,李英彪,周海珍,等.发酵肉制品中生物胺的影响因素及控制技术[J].肉类工业,2009(1):13-16.
[9] 帅瑾.传统自然发酵四川香肠中乳酸菌的分离、鉴定及其应用[D].雅安:四川农业大学,2013:22-24.
[10] Latorre-Moratalla M L,Bover-Cid S,Vidal-Carou M C.Technological conditions influence aminogenesis during spontaneous sausage fermentation [J].Meat Science,2010,85(3):537 -541.
[11] Mohamed A,Rabie B,Cidalia P F,et al.Evolution of amino acids and biogenic amines throughout storage in sausages made of horse,beef and turkey meats[J].Meat Science,2014,96(3):82 -87.
[12] Coppola R,Lorizzo M,Saotta R,et al.Characterization ofMicrococcyandStaphylococciisolated from soppressata molisame southern Italy fermented sausage[J].Food Microbiology,2007,14(2):73 -77.
[13] 杨勇,张雪梅,程艳,等.四川香肠中产香葡萄球菌的分离与鉴定[J].食品与发酵工业,2011,37(6):29-34.
[14] 张雪梅.四川香肠生产过程中理化特性、微生物特性及产香葡萄球菌的筛选与应用[D].雅安:四川农业大学,2011:10-11.
[15] 陈美春,康明武,杨勇.酱油中氨基酸态氮测定方法的探[J].四川食品与发酵,2008,44(2):54-56.
[16] ZHAO G M,ZHOU G H,WANG Y L,et al.Time-related changes in cathepsin B and L activities during processing of Jinhua ham as a function of pH,salt and temperature[J].Meat Science,2005,70(2):381 -388.
[17] 谭李红,夏文水,张春晖.一种混合发酵剂对干发酵香肠中生物胺含量的影响[J].食品工业科技,2005,26(6):90-95.
[18] 马宇霞,卢士玲,李开雄,等.发酵剂对熏马肠成熟过程中生物胺含量变化的影响[J].食品与发酵工业,2014,40(2):59-64.
[19] 朱志远,徐幸莲,李虹敏,等.不同发酵剂对发酵香肠生物胺含量的影响[J].食品与发酵工业,2009,35(9):133-137.
