石灰石沟-堆肥湿地系统处理酸性矿山废水的研究
2015-11-19张河民钟铭君吴启堂华南农业大学资源环境学院土壤环境与废物资源农业利用广东省高校重点实验室广东广州510642BBBBB
张河民,钟铭君,吴启堂(华南农业大学资源环境学院,土壤环境与废物资源农业利用广东省高校重点实验室,广东 广州 510642)BBBBB
石灰石沟-堆肥湿地系统处理酸性矿山废水的研究
张河民,钟铭君,吴启堂*(华南农业大学资源环境学院,土壤环境与废物资源农业利用广东省高校重点实验室,广东 广州 510642)BBBBB
为探讨石灰石沟-潜流堆肥湿地系统处理酸性矿山废水(AMD)的效果及影响因素,进行了6个月模拟试验,测定出水水质和植物生长等相关的影响因素.结果表明,石灰石沟可有效提高AMD的pH值,降低其酸度与重金属含量,但随着石灰石沟中氢氧化物的积累,后期处理性能下降;堆肥湿地可显著降低AMD的酸度与重金属,出水酸度随时间持续降低,出水的Cd、Pb在检测限以下,Zn、Cu平均浓度分别为1.8mg/L, 2.6μg/L,均达到农业灌溉水标准,而无前置堆肥的普通湿地后期Cd、Zn、Cu偏高;东南景天在湿地系统也能正常富积Cd/Zn;狭叶香蒲使堆肥湿地的产碱过程受到抑制,出水酸度升高,但其对堆肥湿地的重金属去除没有产生显著影响.
酸性矿山废水;石灰石沟;堆肥湿地;酸度;重金属
中国是第3大矿业国,每年因采矿、选矿排放的废水为12~15亿t,大部分未经处理直接排放[1].酸性矿山废水(AMD)具有pH值低、重金属及其它有毒物质含量高的特征,严重污染地表水、地下水及土壤[2],导致生态环境退化,生物多样性减少,并威胁人类健康[3-4].受AMD污染的水体也表现出低pH值、高重金属含量的特征,广义上,这些受污染的水也称为AMD,但其化学性质发生改变,酸度与重金属含量降低,大量Fe3+水解沉降.
被动处理技术利用自然的化学、生物过程净化矿山废水,具有运行、维护成本低、环境友好的特点,在欧美得到广泛应用[5-6].堆肥湿地主要通过硫酸还原与石灰石溶解产生碱度、促进重金属的去除,适合AMD(pH<5.5)的处理[7].表面流堆肥湿地的酸度、金属去除效率较低,占地面积大,垂直流堆肥湿地能够解决这一问题[8],但其建造成本较高,不易维护,会产生堵塞问题[9].有机质的补充对堆肥湿地的长期性能至关重要,但其在实际应用中经常被忽略[7],简易的有机质补充方式有利于堆肥湿地的运行与维护.
本文以广东北部一处受铅锌矿污染的河水为模拟研究对象,设计了一种前置堆肥的潜流湿地,并采用石灰石沟(LSD)作为其预处理单元.试验设计了堆肥湿地和与之对照的普通湿地,并对湿地设置了不同的植物,包括狭叶香蒲(重金属耐性植物)和东南景天(Cd/Zn超富集植物)处理,研究了LSD及前置堆肥湿地对模拟AMD的净化效果及影响因素,为开发一种经济有效、易于维护的AMD污染水的处理技术提供依据.
1 材料与方法
1.1 供试材料
石灰石:购于清远市佛冈县某采石场,平均粒径5cm,密度2.59g/cm3,空隙率42.56%.堆肥与精致泥炭土:购于石家庄市旭能生物技术有限公司.狭叶香蒲(Typha angustifolia):取自华南农业大学湿地公园.超富集东南景天(Sedum alfredii Hance):取自浙江衢州古老铅锌矿.

表1 试验材料的基本性质Table 1 Main properties of the tested substrates
模拟AMD:根据过去多次对污染河流的监测结果,以各污染物最高难度配置模拟污水,具体为: pH 3.5(H2SO4调节)、2mg/L Fe2+(FeSO4·7H2O)、8mg/L Fe3+(Fe2(SO4)3· xH2O)、25mg/L Zn (ZnSO4·7H2O)、0.3mg/L Pb(Pb(NO3)2)、0.1mg/L Cd (CdCl2·0.5H2O)、0.08mg/L Cu (CuSO4).
试验材料的基本理化性质见表1.
1.2 石灰石沟(LSD)设计与模拟
LSD用PVC管模拟建立.在长3m、直径16cm的PVC管内填充石灰石,水平放置,在PVC管两端装上弯头,弯头另一端垂直向上,使水能浸没管内石灰石,弯头上侧开一个孔,作为进/出水口.
1.3 潜流堆肥湿地设计与模拟
如图1所示,潜流堆肥湿地由厌氧池、石灰石床、有机基质层及湿地植物组成.AMD进入湿地前端的厌氧池,厌氧池与石灰石床用塑料板分隔,AMD只能通过厌氧池底部的石灰石层进入其后的石灰石床中.有机基质层在石灰石床表面,将有机质铺在石灰石床上而形成,湿地植物种植在有机基质层上.湿地的出水口在石灰石床上端,与石灰石床表面平齐.

图1 潜流堆肥湿地剖面结构示意Fig.1 Profile of the compost-based subsurface flow constructed wetland

潜流堆肥湿地用塑料箱模拟建立.塑料箱长、宽、高分别为60,40,30cm,在箱子长15cm处设置分隔板,隔板下端留有5cm高的空隙.隔离的小空间作为厌氧池,其底部填充石灰石至隔板下端,然后填充堆肥,堆肥的填充高度为20cm.隔板另一侧空间填充石灰石,填充高度为24cm,作为石灰石床.湿地系统的堆肥及石灰石都充分混匀、均一布置,以减少水流的不均匀分布.石灰石床表面铺一层6cm厚的精制泥炭土,形成有机基质层,其上种植香蒲或套种东南景天.
1.4 试验设计
为研究新型堆肥湿地对AMD的净化效果及其影响因素,试验设计5个处理, 3个重复.每个处理的石灰石床上都均匀铺有4.4kg(干重)精制泥炭土,厌氧池的填充基质与有机基质层的植物设置则不同.处理1(T1)填充堆肥,不种植物;处理2(T2)填充堆肥,种植香蒲;处理3(T3)填充堆肥,香蒲和东南景天套种;处理4(T4)填充石灰石,种植香蒲;处理5(T5)填充石灰石,香蒲和东南景天套种.以上处理中,堆肥的用量为2.3kg(干重),香蒲种植4棵,东南景天扦插15株.T1、T2、T3是具有不同植物设置的堆肥湿地,而T4、T5是作为对照的普通湿地.
1.5 处理系统的运行
在1000L的塑料箱中,每次配800L模拟AMD.LSD及各湿地系统的进水都由阀门控制,以保证系统各部分进/出水流量的稳定和均匀.AMD进入LSD的流量为202.25L/d,水力停留时间4h (静态接触试验将酸性废水中和至pH 6.0所需的时间).LSD出水通过多通道水流分配装置均匀分配至15个湿地系统中,水力停留时间35h (1~2d是经济、合适的[10-11],本研究采用1.5d),废水经各湿地系统处理后排放.香蒲和东南景天于2014年4月26日种植在模拟人工湿地上,处理系统于5月16日开始运行.
1.6 样品采集与分析
采集各湿地处理系统出水水样,同步采集模拟AMD原液和LSD出水水样.前3个月每隔7~10d采一次水样,后3个月每隔12~15d采一次水样.测定水样pH值、酸度、Fe2+、金属全量.电位滴定法(滴定至pH 8.3)测定酸度,邻菲啰啉分光光度法测定Fe2+,金属全量采用硝酸-高氯酸消解(GB7475-87),原子吸收光谱仪测定.
6月21日收割东南景天,8月13日收割香蒲.东南景天整株拔起,香蒲收割地上部,并采集部分根系.植株用自来水洗净,再用蒸馏水洗3遍,晾干,于105℃杀青30min,65℃烘干至恒重,粉碎.测定植株的金属与养分(N、P)含量.金属采用硝酸-高氯酸(5:1)消解,原子吸收光谱仪测定;养分采用H2SO4-H2O2消解,奈氏比色法测定全氮,钼锑抗比色法测定全磷.
1.7 数据分析
数据处理与图表制作采用Excel 2003软件,统计分析采用SAS 9.0软件,处理间的差异采用单因子方差分析(one-way ANOVA).
2 结果与讨论
2.1 处理系统的酸度去除效果
由图2可知,在前75d,经LSD处理后,AMD的pH值由3.3上升至6.3,酸度由80mg/L(以CaCO3计)下降至40mg/L.75d后,LSD出水pH值开始下降.128d后,LSD出水pH值大幅下降,此时,其出水的酸度也开始上升.后期,LSD出水pH值下降至4.5,酸度上升至55mg/L.
AMD进入各湿地系统后,其pH值进一步提高.初期,T1、T2、T3出水pH值不断上升,42d后,出水pH值基本稳定,且T1出水pH值显著(P<0.01)高于T2、T3,T2、T3之间没有差异.这表明,狭叶香蒲的生长使堆肥湿地的出水pH值降低,而套种东南景天不会对其出水pH值产生影响.T4、T5出水pH值为6.5~6.6,相对稳定,但其出水pH值显著(P<0.01)低于T1、T2、T3,说明堆肥可显著提高湿地系统的出水pH值.
AMD进入各湿地系统后,其酸度发生显著的变化.T1、T2、T3初始的出水酸度高达150mg/L,远高于其40mg/L的进水酸度,但其后出水酸度急剧下降.42d后,其出水酸度降至进水酸度以下并持续下降,且T1的出水酸度显著(P<0.01)低于T2、T3,但T2、T3之间没有差异.这表明,狭叶香蒲的生长使堆肥湿地出水酸度升高,而套种东南景天不会对出水的酸度产生影响.
T4、T5的出水酸度则相对稳定,初期略有下降,之后上升并稳定在35mg/L左右.前42d,T4、T5的出水酸度远低于T1、T2、T3,随着T1、T2、T3的出水酸度持续降低,42后,T1、T2、T3的出水酸度显著(P<0.01)低于T4、T5.这表明,填充堆肥会使湿地系统初期的出水酸度升高,但其对酸度的去除能力越来越好.后期,LSD出水pH值下降,酸度上升,但各湿地处理系统出水的pH值与酸度未受影响,说明各湿地系统都具有较强的酸缓冲能力.

图2 酸性矿山废水经过石灰石沟及各湿地系统后出水的pH值与酸度(各点数据为均值, n=3)Fig.2 pH and acidity (mean, n=3) of effluents of limestone ditch (LSD) and wetlands treating acid mine drainage (AMD)
2.2 AMD及其处理系统中Fe的形态转化与分布
AMD中Fe的氧化与水解主要受pH值调控.模拟AMD中Fe2+与Fe3+含量分别为2,8mg/L.由图3可知, Fe2+在AMD(pH 3.3)中稳定存在,而Fe3+则大量水解,剩余含量为0.7~1.0mg/L.Fe3+的水解释放大量的质子酸,降低水的pH值,试验中模拟AMD的pH值由3.5降至3.3.
AMD进入LSD后,石灰石的溶解使其pH值迅速上升,促进Fe2+的氧化及Fe3+的水解.从图3可知,在前75d, LSD出水的Fe含量约为1.2mg/L,而Fe2+含量为0.这表明,随着pH值的上升,AMD中的Fe2+已完全氧化,LSD出水的Fe全部为Fe3+.受LSD出水pH值下降的影响,75d后,LSD出水的Fe2+含量升高,LSD出水pH值越低,其出水的Fe2+含量越高,这使其出水的Fe含量也同步升高.

图3 酸性矿山废水经过石灰石沟及各湿地系统后出水的Fe2+与总Fe含量(各点数据为均值, n=3)Fig.3 Fe2+and total Fe concentrations (mean, n=3) of effluents of limestone ditch (LSD) and wetlands treating acid mine drainage (AMD)
各湿地系统中Fe的形态与分布具有显著的差异与变化.从图3可知,初始阶段T1、T2、T3出水的Fe都是Fe2+,并随时间迅速下降,42d后,其出水的Fe2+下降并稳定至0.2mg/L左右.可能是因为随着湿地系统有机物的消耗与流失,其还原能力下降.155d后,T2、T3出水的Fe2+含量降为0,T1出水的Fe2+含量仍保持稳定, 还略有升高.这表明,不种狭叶香蒲的湿地系统具有更强的还原性.受表层泥炭土的影响,T4、T5的出水也含有较高的Fe2+,但其出水的Fe2+含量在32d后就下降为0.T4、T5初期出水的Fe含量在0.5mg/L左右,42d后下降并稳定在0.2mg/L左右,其出水的Fe主要是Fe3+.
2.3 处理系统的重金属去除效果
LSD去除重金属的效果受其酸中和能力影响.如图4所示,前75d, LSD出水的Zn、Cd、Cu、Pb含量分别约为18mg/L、38μg/L、23μg/L、19μg/L,平均去除率分别为28%、66%、70%、90%.出水的Zn、Cu、Pb相对稳定,而Cd在前51d逐渐降低,之后开始上升.受出水pH值下降影响,75d后,LSD出水的Zn、Cd、Cu、Pb含量上升,随着pH值进一步下降,其对Zn、Cd、Cu、Pb的除去率分别下降至5%、17%、23%、46%.
AMD进入各湿地系统后,其重金属含量进一步下降.从图4可以看出,T1、T2、T3对重金属的去除效果及变化规律基本一致,T4、T5之间也是如此.这表明,种植狭叶香蒲及套种东南景天并不会对湿地系统的重金属去除产生显著的差异.堆肥湿地系统(T1、T2、T3)具有良好的重金属去除效果,而普通湿地系统(T4、T5)对重金属去除效果较差,这表明,堆肥对堆肥湿地系统的重金属去除起主要作用.
初期,堆肥湿地系统(T1、T2、T3)出水的Zn在2mg/L以下,67d后,出水的Zn略有上升和波动;其对Cd去除效果良好,前22d,出水的Cd为0.5~2.0μg/L,之后未检出Cd(检出限0.1μg/L).普通湿地系统(T4、T5)出水的Zn不断上升,42d后,出水的Zn稳定在18mg/L左右,103d后,出水的Zn波动上升,最后失去对Zn的去除能力;前51d,其出水的Cd在20μg/L左右,之后上升至36 μg/L左右,后期有上升趋势.
各湿地系统出水的Cu、Pb含量都很低,且比较稳定.堆肥湿地系统(T1、T2、T3)出水的Cu含量显著(P<0.01)低于普通湿地系统(T4、T5),系统运行期间,其出水未检出Pb(检出限1.0μg/L),而普通湿地系统(T4、T5)出水的Pb在1~10μg/L间波动.虽然进水的Cd含量高于Cu,堆肥湿地系统(T1、T2、T3)的出水未检出Cd,却检出1~8μg/L的Cu,这可能和Cu易与溶解性有机物结合有关.
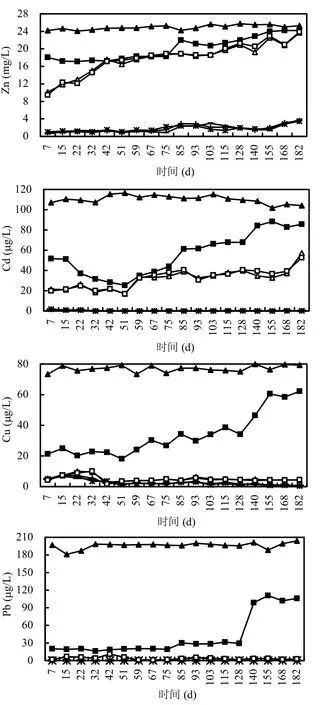
图4 酸性矿山废水经过石灰石沟及各湿地系统后出水的重金属含量(各点数据为均值,n=3)Fig.4 Heavy metal concentrations (mean, n=3) of effluents of limestone ditch (LSD) and wetlands treating acid mine drainage (AMD)
2.4 狭叶香蒲在湿地系统中的生长及金属富集
各湿地系统香蒲的生物量及其N、P、K含量见图5.T2种植的香蒲生物量显著高于T4、T5,与堆肥提供了更多的营养有关;T2种植的香蒲生物量也显著高于T3,与缺少了东南景天的竞争有关,且可能受种苗不均的影响.香蒲茎的P含量显著高于叶,但各湿地系统香蒲茎、叶的P含量没有显著差异.香蒲叶的N含量高于茎,且T2、T3香蒲叶的N含量显著高于T4、T5.香蒲茎的K含量高于叶,且T2、T3香蒲茎的K含量显著高于T4、T5.
从图6可知,在普通湿地系统(T4,T5)生长的狭叶香蒲其植株中的Cd、Zn、Pb、Cu含量高于堆肥湿地系统(T2,T3).Cd、Zn、Pb主要富集在根部,茎、叶中的含量则较低.而Cu的分布在Cu含量较低的生境(T2,T3)中有特殊性,主要分布在香蒲的根和叶,但在Cu含量较高的生境(T4,T5)中,香蒲的根相比于茎、叶又富集更多的Cu.
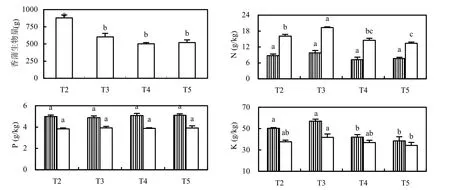
图5 各湿地系统狭叶香蒲的生物量及其N、P、K含量(均值±标准误, n=3)Fig.5 Biomass and N, P, K concentrations (mean, n=3) of Typha angustifolia grown in wetlands无相同字母表示处理间差异显著(P<0.05),下同


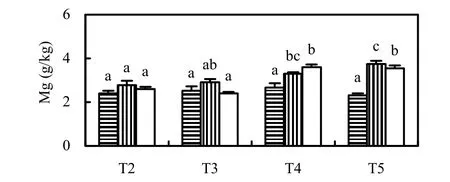
图6 各湿地系统中狭叶香蒲的金属含量(均值±标准误, n=3)Fig.6 Metal concentrations (mean, n=3) in tissues (root, shoot, leaf) of Typha angustifolia grown in wetlands

Fe2+是植物吸收Fe的主要形式,堆肥湿地系统(T2,T3)中的Fe主要以Fe2+形式存在,其香蒲植株中的Fe含量也显著高于普通湿地系统(T4,T5). Fe主要富集在香蒲的根部,少量在茎、叶,但叶片中的Fe显著高于(P<0.01)茎.普通湿地系统(T4,T5)中香蒲根、茎、叶的Ca含量显著低于堆肥湿地系统(T2,T3),表明对Ca 的吸收受到显著抑制,但其对Mg的吸收却反而有所提高. Batty等[12]发现,AMD湿地处理系统中生长的芦苇的Ca吸收受到抑制,并认为低pH值、重金属毒效应及根系铁膜(Iron plaques)是抑制Ca吸收的3种可能原因.普通湿地(T4、T5)生长的狭叶香蒲对Mg的吸收却显著提高,可能是由于根系铁膜对Mg的吸附比Ca弱,而且植物对Ca、Mg的吸收存在拮抗作用[13],植物减少对Ca的吸收有利于对Mg的吸收.
2.5 东南景天在堆肥湿地中的生长及对金属的富集
由于湿地系统中景天的种植时间晚、生长期短,其生物量比较低(表2),然而,其Cd浓度达到50mg/kg,与一般污染土壤上的正常浓度相当[14],分别为香蒲(T5)根、茎、叶的5倍、80倍、250倍.如表2所示,由于湿地系统T5出水的Zn含量高,其景天富集的Zn含量显著高于T3,而两者的生物量及Cd浓度没有显著差异.

表2 各湿地系统中东南景天的生物量与重金属含量(均值±标准误)Table 2 Biomass and heavy metal concentrations of Sedum alfredii Hance grown in wetlands (mean ± SE, n=3)
2.6 讨论
降低AMD的酸度有利于其重金属的去除,也为其生物修复创造适宜的环境[15].LSD是一种简单、经济的被动处里系统,其利用石灰石的溶解产生碱度,提升AMD的pH值,促进金属的氧化与水解.但氢氧化物沉降在石灰石表面,形成一层包膜(Armoring),降低石灰石的溶解速率,使LSD出水pH值下降.据报道[16-17],包膜使石灰石溶解速率下降20%~50%.本试验中,LSD出水pH值呈阶段性下降,这表明,当石灰石表面的包膜达到一定程度时,其溶解才会受到影响.然而,也有研究表明[18-19],包膜对石灰石的溶解影响甚微,这可能与其进水水质和水流状态有关.当LSD坡度大于12%时,其水流速度使沉淀物呈悬浮状态,并促进石灰石的表面冲刷,阻止包膜的形成,使其获得最佳处理效果[6].因此,在今后的中试试验中应提高LSD坡度或水流速度,防止石灰石表面包膜的形成,这是LSD具备长期处理能力的关键.
但氢氧化物也可促进LSD对痕量金属的去除.研究表明[18],氢氧化物的吸附、共沉淀作用可使水中溶解态金属降低50%以上. Galán等[20]也发现,沉降在AMD污染河流两岸的Fe羟基氢氧化物是主要的痕量金属清除剂.本试验中,LSD初期对Zn、Cd、Cu、Pb的去除率分别为28%、66%、70%、90%, pH值下降使其出水的金属含量上升,这表明,痕量金属与Fe氢氧化物的吸附、共沉淀受pH值影响.Miller等[21]研究表明, 在基于石灰石的处理系统中,痕量金属的去除主要受AMD的初始Fe含量与pH值影响.在本试验中,AMD的Fe含量基本不变,因此,pH值是影响痕量金属去除的主要因素.研究表明[22],当pH<4时,Fe氢氧化物对Cu、Pb、Zn没有吸附作用,本试验也证实了这一点,然而共沉淀作用是否受到影响需要进一步的研究证实.
在堆肥湿地中,有机质的降解为SRB提供碳源和还原性环境,堆肥是常用的有机质[23]. Yim等[24]发现,垂直流堆肥湿地系统的产碱能力和金属去除能力随磨菇渣肥用量的增加而提高.随着有机质的消耗及其去除位点的饱和,其处理性能下降.向堆肥湿地补充有机质的必要性早已被认识,但其在实际应用中经常被忽略[7].本试验设计的堆肥湿地将有机质集中放置在其前端的厌氧池,水垂直向下流过有机质,使其具备垂直流堆肥湿地的特点,同时,有机质的补充或更换变得简单易行.
基于堆肥的AMD处理系统,系统的规模及环境条件对其处理性能具有重要影响[10].运行良好的堆肥湿地可有效地去除酸性废水中的Zn[10,25].本研究表明,堆肥湿地可显著降低AMD的酸度与重金属,出水酸度随时间持续降低,Cd、Zn去除率分别为100%、91%,出水的重金属(Zn、Cd、Pb、Cu)浓度均达到农业灌溉水标准.今后需要确定堆肥的最大有效时间、确定更换周期.
促进微生物的生长可能是植物在AMD处理系统中最重要的作用[26].硫酸还原过程产生碱度并使金属以硫化物形式沉淀,有学者认为[5,23],植物根系释氧会破坏堆肥湿地中的硫酸还原过程,不宜种植植物,这一现象还没有实验研究报道.本研究表明,种植狭叶香蒲使堆肥湿地出水的pH值显著(P<0.01)降低、酸度显著(P<0.01)提高,香蒲的根系释氧使堆肥湿地的还原性产碱过程受到抑制.但堆肥湿地对金属的去除并没有受到影响,表明硫化物沉淀不是堆肥湿地的主要金属去除机制.种植植物有利于景观,可以考虑保留.
植物吸收对湿地的金属去除贡献很小.金属Mn、Fe、Zn、Cu、Ni、Cr在植物里都有富集,但这只占湿地金属去除量的一小部分[27].Nyquist和Greger等[28]分析了植物吸收Fe、Cu、Zn、Cd含量占进水总量的比例,分别为0.002~0.13%、0.008~0.3%、0.02~0.4%、0.17~2.9%.表明植物对Cd去除的贡献较大,因而,本试验仍然种植香蒲.此外,金属在湿地植物中的分布基本呈现为根>茎>叶[29].本试验中,金属Fe、Zn、Cd、Pb富集在香蒲根部,茎、叶中的含量则非常低,只有Cu在茎、叶中也占有较大的比例.因此,在收获湿地植物时应尽量连根去除.
为提高湿地系统对主要目标重金属Cd的长期去除能力,本研究将Cd/Zn超富集植物东南景天引入其中.试验表明,东南景天能够在所设计的湿地上生长,也能富积Cd/Zn.但是本试验东南景天生长期短,生物量与金属富集量都比较低,对湿地出水水质未产生显著影响,其在湿地系统中的作用有待更长期的试验研究确认.
3 结论
3.1 石灰石沟(LSD)可有效地提高AMD的pH值,降低其酸度,促进金属的氧化与水解,并通过吸附、共沉淀作用降低水中的重金属.但是,后期应采取措施防止石灰石表面包膜的形成,使LSD具备长期处理能力.
3.2 前置堆肥湿地可有效降低AMD的重金属与酸度,有机质对堆肥湿地的重金属去除起决定性作用,出水的Cd、Pb在检测限以下,Zn、Cu的平均出水含量分别为1.8mg/L、2.6μg/L.
3.3 狭叶香蒲的生长会减弱堆肥湿地中的还原性,使堆肥湿地的出水pH值降低、酸度升高,但其对堆肥湿地的金属去除没有产生显著影响,而东南景天在湿地系统也能正常富积Cd/Zn.
[1]罗仙平,谢明辉.金属矿山选矿废水净化与资源化利用现状与研究发展方向 [J]. 中国矿业, 2006,15(10):51-56.
[2]Peppas A, Komnitsas K, Halikia I. Use of organic covers for acid mine drainage control [J]. Minerals Engineering, 2000,13(5):563-574.
[3]Johnson D B, Hallberg K B. Pitfalls of passive mine water treatment [J]. Reviews in Environmental Science and Biotechnology, 2002,1(4):335-343.
[4]Azapagic A. Developing a framework for sustainable development indicators for the mining and minerals industry [J]. Journal of Cleaner Production, 2004,12(6):639-662.
[5]Johnson, D B, Hallberg K B. Acid mine drainage remediation options: A review. Science of the Total Environment, 2005,338:3-14.
[6]Skousen J, Ziemkiewicz P. Performance of 116 passive treatment systems for acid mine drainage [A]. //Barnhisel R. Proceedings of National Meeting of the American Society of Mining and Reclamation [C]. Breckenridg: ASMR, 2005:1100-1133.
[7]Mayes W M, Batty L C, Younger P L, et al. Wetland treatment at extremes of pH: A review [J]. Science of the Total Environment,2009,407(13):3944-3957.
[8]Batty L C, Younger P L. The use of waste materials in the passive remediation of mine water pollution [J]. Surveys in Geophysics, 2004,25(1):55-67.
[9]Taylor J, Pape S, Murphy N. A Summary of Passive and Active Treatment Technologies for Acid and Metalliferous Drainage(AMD) [A]. //Bell C. Proceedings of the Fifth Australian Workshop on Acid Drainage [C]. Fremantle, Western Australia:ACMER, 2005,1-49.
[10]Gandy C J, Jarvis A P. The influence of engineering scale and environmental conditions on the performance of compost bioreactors for the remediation of zinc in mine water discharges[J]. Mine Water Environ., 2012,31:82-91.
[11]Lee J Y, Khim J, Ji W H. A full-scale successive alkalinityproducing passive system (SAPPS) for the treatment of acid mine drainage [J]. Water Air Soil Pollut, 2013,224:1656.
[12]Batty L C, Younger P L. Growth of Phragmites australis (Cav.)Trin ex. Steudel in mine water treatment wetlands: effects of metal and nutrient uptake [J]. Environmental Pollution, 2004,132(1):85-93.
[13]Marschner H. Mineral Nutrition of higher Plants [M]. New York:Academic Press San Diego, 1995:461-462.
[14]Wu Q T, Wei Z B, Ouyang Y. Phytoextraction of metal contaminated soil by hyperaccumulator Sedum alfredii H: effects of chelator and co-planting [J]. Wat Air Soil Pollut, 2007,180:131-139.
[15]Willow M A, Cohen R R H. pH, dissolved oxygen, and adsorption effects on metal removal in anaerobic bioreactors [J]. Journal of Environmental Quality, 2003,32(4):1212-1221.
[16]Pearson F H, McDonnell A J. Use of crushed limestone to neutralize acid wastes [J]. Journal of Environmental Engineering Division, 1975,101(1):139-158.
[17]Ziemkiewicz P F, Skousen J G, Lovett R. Open limestone channels for treating acid mine drainage: a new look at an old idea [J]. Green Lands, 1994,24(4):36-41.
[18]Cravotta III C A, Trahan M K. Limestone drains to increase pH and remove dissolved metals from acidic mine drainage [J]. Applied Geochemistry, 1999,14(5):581-606.
[19]Alcolea A, Vázquez M, Caparrós A. Heavy metal removal of intermittent acid mine drainage with an open limestone channel[J]. Minerals Engineering, 2012,26:86-98.
[20]Galán E, Gómez-Arizab J L, González I, et al. Heavy metal partitioning in river sediments severely polluted by acid mine drainage in the Iberian Pyrite Belt [J]. Applied Geochemistry,2003,18(3):409-421.
[21]Miller A, Wildeman T, Figueroa L. Zinc and nickel removal in limestone based treatment of acid mine drainage: The relative role of adsorption and co-precipitation [J]. Applied Geochemistry,2013,37:57-63.
[22]Schemel L E, Kimballb B A, Bencala K E. Colloid formation and metal transport through two mixing zones affected by acid mine drainage near Silverton, Colorado [J]. Applied Geochemistry,2000,15(7):1003-1018.
[23]Gazea B, Adam K, Kontopoulos A. A review of passive systems for the treatment of acid mine drainage [J]. Minerals Engineering,1996,9(1):23-42.
[24]Yim G, Ji S, Cheong Y, et al. The influences of the amount of organic substrate on the performance of pilot-scale passive bioreactors for acid mine drainage treatment [J]. Environ Earth Sci, 2015,73(8):4717-4727.
[25]Whitehead P G, Hall G, Neal C, et al. Chemical behaviour of the Wheal Jane bioremediation system [J]. Science of the Total Environment, 338(1/2):41-51.
[26]Frank Schaller. Reclamation of Drastically Disturbed Lands [M]. Madison, Wis: American Society of Agronomy-Crop Science Society of America-Soil Science Society of America, 2000:131-168.
[27]Mays P A, Edwards G S. Comparison of heavy metal accumulation in a natural wetland and constructed wetlands receiving acid mine drainage [J]. Ecological Engineering, 2001,16(4):487-500.
[28]Nyquist J, Greger M. A field study of constructed wetlands for preventing and treating acid mine drainage [J]. Ecological Engineering, 2009,35(5):630-642.
[29]Sheoran A S, Sheoran V. Heavy metal removal mechanism of acid mine drainage in wetlands: A critical review [J]. Minerals Engineering, 2006,19(2):105-116.
The treatment of acidic mine drainage using limestone ditch and compost constructed wetland system.
ZHANG He-min, ZHONG Ming-jun, WU Qi-tang*(Key Laboratory of Soil Environment and Waste Reuse in Agriculture of Guangdong Higher Education Institutes, College of Natural Resources and Environment, South China Agricultural University, Guangzhou 510642, China). China Environmental Science, 2015,35(10):3032~3040
In order to evaluate the performance and affecting factors of a limestone ditch-compost wetlands system to treat acidic mine drainage (AMD), a pilot test for six months was conducted with the measurements of effluents quality and plant growth-related parameters. Results show that limestone ditch (LSD) can effectively increase pH, decrease acidity and heavy metals of AMD, but the efficiency declined with the accumulation of metal hydroxides in LSD. The acidity and heavy metals decreased significantly after passing through compost wetlands, the acidity of the effluents decreased continuously and concentrations of Cd, Pb were below the levels of detection, the mean concentrations of Zn, Cu were 1.8mg/L, 2.6μg/L, respectively, which conform to the standards for irrigation water quality. However, much higher concentrations of Cd, Zn were found in the effluents of wetlands without the addition of compost. Sedum alfredii Hance planted in wetlands grew and extracted normally Cd/Zn. Alkalinity production in compost wetlands were inhibited in the presence of Typha angustifolia, and the acidity of the effluents were increased, but heavy metals removals were not significantly affected by planting Typha angustifolia.
acid mine drainage (AMD);limestone ditch (LSD);compost wetlands;acidity;heavy metals
X703.1
A
1000-6923(2015)10-3032-09
张河民(1989-),男,广东省韶关人,华南农业大学硕士研究生,主要从事矿区水、土壤污染修复技术研究.
2015-03-12
国家自然科学基金项目(41371308);国家“863”项目(2012AA06A202);广东省自然科学基金团队项目(S2011030002882);广东省科技计划项目(2012A030700003)
* 责任作者, 教授, wuqitang@scau.edu.cn
