基质投加方式对污泥碱性发酵性能的影响
2015-11-19金宝丹王淑莹邢立群彭永臻北京工业大学北京市污水脱氮除磷处理与过程控制工程技术研究中心北京市水质科学与水环境恢复工程重点实验室北京100124
金宝丹,王淑莹,邢立群,彭永臻 (北京工业大学北京市污水脱氮除磷处理与过程控制工程技术研究中心,北京市水质科学与水环境恢复工程重点实验室,北京 100124)
基质投加方式对污泥碱性发酵性能的影响
金宝丹,王淑莹*,邢立群,彭永臻 (北京工业大学北京市污水脱氮除磷处理与过程控制工程技术研究中心,北京市水质科学与水环境恢复工程重点实验室,北京 100124)
为了研究低温条件(15±2)℃下投加方式对剩余污泥碱性发酵的影响,将剩余污泥分别在NaOH、KOH、Ca(OH)2和混合碱(Ca(OH)2和KOH) 4种碱性(pH=10±0.2)系统中进行发酵,并在系统稳定后依次改变污泥投加方式(1次投加污泥、平均2次投加和平均3次投加),分别对发酵体系的剩余污泥溶液化、溶解性蛋白质、溶解性多糖、挥发性脂肪酸(SCFAs)和关键酶(水解酶和辅酶420(F420))进行研究.研究发现,4种碱性发酵体系中,不同投加方式对剩余污泥的水解和酸化性能具有显著的影响,其中SCOD随着污泥投加次数的增加略有减小,但是发酵液中可溶性的蛋白质和多糖有增加趋势.水解酶活性随着污泥投加次数的增加而降低,但是在NaOH和KOH发酵体系中,辅酶420随着投加次数的增加而增大,混合碱发酵体系中其活性基本不变,而在Ca(OH)2发酵体系中其活性则降低.NaOH、KOH和混合碱发酵体系产酸能力随投加次数的增加而下降,但是Ca(OH)2发酵体系酸化能力则先增大后少量降低,由此发现,Ca(OH)2发酵体系水解及产酸能力较为稳定,同时该体系中乙酸/SCFAs最大,高于其他发酵体系的10%左右.
碱性发酵;投加方式;水解酶;辅酶420;碱类型
碳源短缺是当前城市污水处理厂亟待解决的关键问题之一,低C/N污水导致以活性污泥工艺为主的城市污水处理厂脱氮除磷效果较差,而且同时产生大量较难处理处置的剩余污泥,两者长期困扰着城市污水处理厂的运行.据统计,日本的工业材料中剩余污泥约占47%[1],而在城市污水处理厂中,剩余污泥处理费用占污水处理厂的25%~60%[2],剩余污泥中含有大量的有机物质(蛋白质和多糖等),厌氧发酵能将剩余污泥中的大量的有机物质释放到发酵液中,进一步将其转化为可挥发性短链脂肪酸(SCFAs)[3].SCFAs是生物处理过程的优质碳源,特别是乙酸和丙酸[4].通过污泥厌氧发酵不仅可解决污水处理厂碳源短缺问题,同时能够解决污泥处理处置问题.污泥发酵分为水解、酸化和产甲烷3个阶段,其中水解是污泥发酵的限制性步骤[5-6],同时产甲烷菌能够利用酸化产物进行产甲烷反应[7],因此,如何促进污泥水解及抑制产甲烷菌生长是污泥发酵产酸的关键.研究发现,碱性条件下污泥厌氧发酵能够大幅度的增大污泥水解速率和抑制产甲烷菌生长[8],适当提高温度能够促进剩余污泥发酵产酸[9],其中NaOH、KOH、Ca(OH)2等碱类型的污泥发酵研究较多[9-10],但均以中温及一次性投加基质方式为主,而实际污水处理工艺中运行温度和剩余污泥产量是不同的,因此仅以一次投加基质为污泥发酵方式是不全面的.
本文研究低温条件下(15℃)污泥投加方式对剩余污泥碱性发酵的影响,采用NaOH、KOH、Ca(OH)2及混合碱(KOH;Ca(OH)2=0.3:0.7)调节pH值,同时在发酵系统启动成功后改变污泥投加方式,探讨不同投加方式对污泥厌氧发酵水解酸化性能及关键酶(水解酶和F420)活性的影响.
1 材料与方法
1.1 污泥来源及试验装置
本试验使用的发酵污泥来自SBR工艺中试剩余污泥(总体积: 8.8m3,有效体积: 6.2m3),该污泥在使用前用自来水清洗3次,并浓缩控制污泥浓度,试验污泥性质如表1所示.
试验反应器材料为有机玻璃,总体积为3.5L,有效容积为3.0L,内设置转子及pH值探头,采用磁力搅拌器进行匀速搅拌,控制转速为750r/min,反应温度为(15±2)℃.该装置采用密封圈密封,以保证厌氧环境,同时在装置顶部设置取样口、加药口及加泥口,中部设置排泥口,底部设置放空口.
1.2 试验方法
污泥及水溶液性质如表1,分别取3L浓缩后剩余污泥投加至1号、2号、3号、4号反应器中,同时分别向1~4号反应投加NaOH(4mol/L)、KOH(4mol/L)、Ca(OH)2(2mol/L)及混合碱(KOH:Ca(OH)2=3:7, 2mol/L)调节pH值,控制调节pH=10±0.2,每2~3d取样一次.

表1 试验污泥性质Table 1 sludge properties of test
1.3 系统运行方式

表2 发酵系统运行方式Table 2 The operation mode of fermentation system
该反应器采用半连续流运行方式.启动初期根据反应器中SCFAs含量变化来确定污泥龄,当SCFAs产量达到最大后,确定发酵系统中发酵污泥的污泥龄.为了保证4个发酵系统同步运行,以最大污泥龄为准,即SRT为10d,此时视为启动成功.因此在发酵至第10d时开始每天排出适当成熟发酵污泥,同时投加等量的新鲜剩余污泥,并且维持pH值10±0.2(投加污泥及调节pH均在取样测量后进行).前一次投加污泥方式运行稳定后,则改变污泥投加方式,即前一次运行方式结束时间为下一次运行方式开始时间,该实验共计41d,具体运行方式及条件如表2所示.
1.4 分析方法
SCOD、污泥浓度及可挥发性污泥浓度根据国标方法测定[11].SCFAs采用Agilent 6890(色谱柱:DB-MAXETR)气相色谱仪测定[12].多糖采用硫酸-蒽酮分光光光度法测定[13],蛋白质采用Lowry-folin试剂分光光度法测定[14].蛋白酶采用偶氮酪蛋白分光光度计方法测定,α-葡萄糖苷酶采用对硝基-a-d-吡喃葡萄糖苷分光光度计法测定[15-16],辅酶420采用异丙醇提取法测定[17].
2 结果与讨论
2.1 投加方式对污泥厌氧发酵水解的影响
2.1.1 投加方式对污泥厌氧发酵污泥溶液化的影响 污泥溶液化是污泥溶解、破碎并且释放可溶性物质的过程,通常以SCOD含量作为衡量指标[18].
由图1可知,4个反应体系中污泥发酵产生的SCOD在反应初期迅速增长,以NaOH和KOH为碱剂(为强碱体系)的污泥发酵系统中SCOD产生量均在发酵5~7d达到最大值,而以Ca(OH)2和混合碱为碱剂(为中强碱体系)的污泥发酵系统中SCOD最大值则出现在9~10d,由此可见,低温条件下中强碱体系污泥厌氧发酵的污泥龄大于中强碱发酵体系污泥龄,而且SCOD产生量远小于强碱发酵体系.
同时由图1发现,发酵系统稳定后,3种污泥投加方式下4种碱性(NaOH, KOH, Ca(OH)2,混合碱)发酵系统中平均SCOD浓度分别为Run1:473.20,496.96,353.82,392.85mg/gVSS;Run2:439. 14,417.96,287.69,360.07mg/gVSS;Run3:450.11,4 60.21,300.12,400.31mg/gVSS,由此可知,随着投加次数的增加,发酵系统中SCOD略有减少.这是因为,随着污泥投加次数的增加,剩余污泥在反应器内的碱作用时间及水解酸化时间变短,系统酸化性能降低或耗酸性增强,所以SCOD随着投加次数的增加出现降低现象.3种投加方式中,NaOH、KOH、Ca(OH)2和混合碱发酵系统SCOD产量大小关系依次为NaOH>KOH>混合碱>Ca(OH)2,这是因为二价碱条件作用下剩余污泥的水解能力小于一价碱条件[19],而且在混合碱中由于Ca2+与蛋白质发生再絮凝反应,使细胞外的EPS结构更加稳定[20],不利于细胞质的溶出,所以NaOH和KOH发酵系统中SCOD的产量显著高于Ca(OH)2和混合碱发酵系统,由于混合碱中KOH的存在,使其发酵体系中SCOD的产量高于Ca(OH)2发酵体系.

图1 投加方式对厌氧发酵污泥溶液化的影响Fig.1 The effect of adding method on the fermented sludge solubilization
2.1.2 投加方式对污泥厌氧发酵溶解性蛋白质和多糖释放的影响 剩余污泥中含有大量的胞外聚合物(EPS),而蛋白质和多糖是EPS的主要组成部分[21-22],总量约占EPS的80%左右[8].同时研究发现,碱性条件能够解离EPS中酸基基团,使其带负电荷基团同电荷相斥,从而增强EPS中蛋白质和多糖的释放率[23].水解菌通过水解酶将蛋白质和多糖分解成氨基酸和单糖等物质,酸化菌则利用水解产物生成SCFAs,因此溶解性蛋白质和多糖是污泥厌氧酸化的关键物质[24-25],由此也可知,水解是污泥厌氧发酵的限制步骤[7].

图2 投加方式对发酵系统中溶解性蛋白质和多糖的影响Fig.2 The effect of adding method on soluble protein and polysaccharide
由图2a和图2b可知,可溶性蛋白质和多糖变化与SCOD相似,发酵系统稳定后,3种投加方式下4种碱性系统中的蛋白质平均含量分别为:112.80, 124.26, 118.77mgCOD/gVSS(NaOH);103.82, 114.61, 135.85mgCOD/gVSS(KOH); 64.47,75.59, 58.97mgCOD/gVSS(Ca(OH)2); 80.93,86.85, 106.45mgCOD/gVSS(混合碱).多糖平均含量分别为:13.04, 13.28, 18.24mgCOD/gVSS(NaOH); 10.69, 14.59, 23.07mgCOD/gVSS(KOH);2.77, 4.33, 6.27mgCOD/gVSS(Ca(OH)2); 6.49,10.34, 15.59mgCOD/gVSS(混合碱).2次投加方式和3次投加方式较一次投加相比,蛋白质含量分别提高10.16%、5.28%(NaOH),10.38%、30.84%(KOH), 17.25%、-8.53%%(Ca(OH)2),7.32%、31.53%(混合碱),多糖含量分别增加1.81%、39.80% (NaOH), 36.42%、115.73% (KOH),56.48%、126.41% (Ca(OH)2), 59.28%、140.22%(混合碱).分析发现, NaOH、KOH和混合碱3种碱性发酵系统的可溶性蛋白质和多糖随着投加次数的增加明显增加,而Ca(OH)2发酵系统中的可溶性蛋白质和多糖均增加不明显,这是因为随着污泥投加次数的增加,发酵系统内的污泥龄缩短,长期短污泥龄淘洗使酸化菌数量较少和活性降低,从而利用可溶性蛋白质和多糖的能力降低,所以NaOH、KOH、Ca(OH)2及混合碱发酵系统中可溶性蛋白质和多糖含量随着投加次数的增加而提高.NaOH和KOH污泥发酵系统产生的可溶性蛋白质和多糖含量均高于Ca(OH)2和混合碱条件,这是由于Na+和K+能够与EPS的高价离子进行交换,从而使EPS结构变得疏松,有利于EPS的溶出[19],但是Ca2+与EPS中的蛋白质再絮凝,使EPS结构更加稳定,不利于蛋白质和多糖的溶出[10],所以在3种投加方式下可溶性蛋白质和多糖含量均为: NaOH>KOH>混合碱>Ca(OH)2.
2.1.3 投加方式对水解酶活性的影响 蛋白质和多糖是剩余污泥中的主要成分,α-葡萄糖苷酶破坏麦芽糖内的α-1,4糖苷键并释放葡萄糖,蛋白酶则可通过破坏大分子蛋白质的肽链,进而达到水解蛋白质的目的[15],因此,蛋白酶和α-葡萄糖苷酶可分别将蛋白质和多糖水解成可被酸化菌利用的氨基酸和单糖等小分子物质,所以蛋白酶和α-葡萄糖苷酶在污泥厌氧发酵过程中起着重要作用.
由表3可知,随着投加次数的增加,蛋白酶与α-葡萄糖苷酶活性降低,2次投加和3次投加与1次投加相比分别降低10%~20%,1%~2%.同时发现,在3种投加方式下,蛋白酶活性高于α-葡萄糖苷酶活性,这是因为酶与其反应底物同时位于微生物细胞体内,当反应底物从细胞内向细胞外转移时,相关酶也随着向外转移[26],即向外转移底物越多,相关酶活性就越高.由图2可知,发酵液中的蛋白质含量显著高于多糖含量,因此导致蛋白酶活性高于α-葡萄糖苷酶活性.与Cadoret等[27]研究相同,Cadoret发现在污泥絮体EPS部分含有23%的蛋白酶和5%的α-葡萄糖苷酶,而剩余水解酶则位于球体层内.其他研究发现,干式厌氧发酵系统嗜中温和嗜热条件下的α-葡萄糖苷酶活性与蛋白酶活性有着显著的差别[28],由此发现,温度对于水解酶活性具有显著影响,特别是低温条件下α-葡萄糖苷酶与蛋白酶活性差别更为明显.4种发酵系统中,α-葡萄糖苷酶和蛋白酶含量有显著地差别,NaOH、KOH和混合碱发酵系统中的α-葡萄糖苷酶和蛋白酶活性均高于Ca(OH)2发酵系统,由此可知强碱发酵系统中的水解酶活性高于中强碱发酵系统.强碱型发酵系统中较高的酶活性可能与底物相关,因为强碱条件下底物从污泥絮体内部向外转移活动增强,从而促进酶的转移,但是在中强碱系统中底物转移活动相对较弱,所以NaOH和KOH条件下水解酶的活性均大于Ca(OH)2和混合碱条件.

表3 投加方式对发酵系统中水解酶活性的影响Table 3 The effect of adding method on hydrolase in the fermentation system
2.2 投加方式对污泥厌氧发酵产酸的影响
2.2.1 投加方式对SCFAs的影响 SCFAs是污泥厌氧发酵过程中酸化的终端产物,同时SCFAs作为生物处理工艺中的优质碳源受到广泛关注.
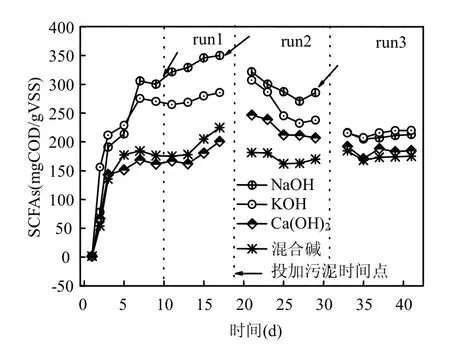
图3 投加方式对发酵系统中SCFAs的影响Fig.3 The effect of adding method on SCFAs
由图3可知,不同投加方式条件下产生的SCFAs含量有明显区别,而且SCFAs含量与碱类型也有密切的关系.NaOH, KOH, Ca(OH)2,混合碱4个发酵系统中SCFAs分别为Run1:350.50,273.85,174.70,191.94mgCOD/gVSS;Run2:293.16,261.79,223.21,171.45mgCOD/gVSS;Run3:210.44,215.59,183.87,175.04mgCOD/gVSS,由此发现,SCFAs产量随着投加次数增加而降低,而且1次投加方式中SCFAs产量NaOH>KOH>混合碱>Ca(OH)2,但是2次投加方式中SCFAs产量NaOH>KOH>Ca(OH)2>混合碱,而且在3次投加方式下4个发酵系统中的SCFAs含量相近.2次投加和3次投加较1次投加相比,产酸变化分别为:-11.03%、-36.14%(NaOH),-4.39%、-21.28%(KOH),28.05%、5.48%(Ca(OH)2),-10.67%、-8.80%(混合碱), NaOH、KOH和混合碱条件下SCFAs降低幅度较大,但是Ca(OH)2条件下均有增加,其中2次投加方式增加幅度最大为28.05%.在NaOH和KOH发酵系统中,分次投加产酸量降低的原因可能是:一方面,投加次数增加使系统内酸化菌的数量及活性降低,不利于SCFAs的生成;另一方面,发酵系统存在部分适碱环境的产甲烷菌[29],由于频繁的污泥投加使发酵系统内厌氧环境改变,,碱作用时间缩短,从而使产甲烷菌活性有所提高,如表3所示,进而加大SCFAs的消耗;第3方面,发酵系统中水解酶活性的降低,使酸化菌可用的酸化底物减少,从而导致SCFAs含量降低.相对于中强发酵系统,投加次数对于强碱发酵系统影响更为明显,这可能是因为Ca2+具有一定缓冲作用,弱化了反应时间缩短对酸化菌数量和水解酶活性的影响.
2.2.2 投加方式对F420的影响 在污泥发酵系统中,产甲烷菌消耗酸化产物SCFAs生成CH4,导致产酸量下降,而碱性条件能够明显抑制产甲烷菌的生长[8],但是仍有部分产甲烷菌能够适应酸性或碱性[29-30]环境,所以虽然碱性发酵系统中产甲烷菌较少且活性较低,但是对于发酵系统中SCFAs产量的变化仍具有一定的研究意义.因此本研究以F420表征产甲烷菌活性,对于不同投加方式下4种发酵系统中F420进行研究.

表4 投加方式对发酵系统中F420活性的影响(×10-5μg/gVSS)Table 4 The effect of adding method on coenzyme 420 in the fermentation system (×10-5μg/gVSS)

图4 投加方式对发酵系统中乙酸及乙酸/SCFAs比例的影响Fig.4 The effect of adding method on acetic acid and the proportion of acetic acid in SCFAs
由表4可知,在3种投加方式中,NaOH、KOH及混合碱发酵系统中F420的活性随着投加方式的增加而增大,这可能与微生物的厌氧环境及碱作用时间有关.但是Ca(OH)2发酵系统中F420的活性随着投加次数的增大而减小,这是因为:Ca2+是产甲烷菌生长的必要因素[31],同时对于微生物之间的聚集也有显著作用[32-33],过量的Ca2+导致厌氧微生物降解有机物质时必要营养元素和缓冲能力的损失,增大其他生物量但减少产甲烷菌等特定物种的数量和活性[34-36].研究发现,4种金属离子中产甲烷菌最优生长浓度分别为:Ca2+约为200mg/L[37],K+约为400mg/L[38],Na+约为100~350mg/L[39-40],产甲烷菌对Ca2+更加敏感,当Ca2+浓度在2500~4000mg/L时将对污泥厌氧消化产生影响[37].而在此项研究中pH为10的情况下,Ca2+浓度约为400~600mg/L[41]明显高于产甲烷菌最适生长浓度,因此Ca(OH)2发酵系统能够更加有效的抑制产甲烷菌生长,但同时增大了发酵系统中其他微生物的数量,其中包括水解酸化菌.
2.2.3 投加方式对乙酸的影响 研究发现,反硝化过程中优先利用乙酸,其次是丁酸、丙酸和戊酸[42].Chen[4]也发现乙酸和丙酸适宜作为脱氮除磷的有机碳源,因为发酵系统中丙酸和丁酸含量相对较低,所以本试验着重研究投加方式对乙酸的影响.
由图4可知,随着投加次数的增加,乙酸的含量降低,可能有以下2方面原因;一方面,随着投加次数的增加,系统的水解能力下降,酸化基质短缺,乙酸生成量减少;另一方面,乙酸是产甲烷菌最易利用碳源,而发酵系统中存在部分适应碱环境的产甲烷菌,使乙酸的消耗量增加.同时分析图5可知, 3种投加方式条件下随着投加次数增加乙酸占SCFAs比例略有提高,而且Ca(OH)2条件下发酵系统中乙酸在SCFAs中百分比大于其他条件下约为10%左右,可见Ca2+是有利于污泥碱性发酵系统中乙酸的积累.
3 结论
3.1 SCOD随着投加次数的增加而略有减少;发酵液中的可溶性蛋白质和多糖随着投加次数的增加而增大;SCFAs随着投加次数增加而显著降低,但是Ca(OH)2条件下却有少量的增加.
3.2 NaOH, KOH,混合碱条件下水解酶活性均随着投加次数的增加而减小,而且蛋白酶含量显著大于α-葡萄糖苷酶含量.F420则随着投加次数的增加而增大,而Ca(OH)2发酵系统中的水解酶变化不明显,但是F420随着投加次数的增加而减小.
3.3 SCFAs中乙酸含量随着投加次数的增加而降低,但是SCFAs中乙酸的百分比增加,而且Ca(OH)2体系中乙酸百分比明显高于其他发酵体系,说明Ca(OH)2发酵体系有利于乙酸的积累.
[1]Yoshida H, Tokumoto H, Ishii K, et al. Efficient, high-speed methane fermentation for sewage sludge using subcritical water hydrolysis as pretreatment [J]. Bioresource Technology, 2009,100:2933-2939.
[2]Yan S, Miyanaga K, Xing X-H, et al. Succession of bacterial community and enzymatic activities of activated sludge by heat-treatment for reduction of excess sludge [J]. Biochemical Engineering Journal, 2008,39:598-603.
[3]Batstone D J, Keller J, Angelidaki I, et al. Anaerobic digestion model no. 1 (ADM1) [M]. IWA publishing, 2002.
[4]Chen Y, Randall A A, McCue T. The efficiency of enhanced biological phosphorus removal from real wastewater affected by different ratios of acetic to propionic acid [J]. Water Research,2004,38:27-36.
[5]Feng L, Yan Y, Chen Y. Kinetic analysis of waste activated sludge hydrolysis and short-chain fatty acids production at pH 10 [J]. Journal of Environmental Sciences, 2009,21:589-594.
[6]Yu G H, He P J, Shao L M, et al. Extracellular proteins,polysaccharides and enzymes impact on sludge aerobic digestion after ultrasonic pretreatment [J]. Water Research, 2008,42:1925-1934.
[7]Eastman J A, Ferguson J F. Solubilization of particulate organic carbon during the acid phase of anaerobic digestion [J]. Journal(Water Pollution Control Federation), 1981:352-366.
[8]Chen Y, Jiang S, Yuan H Q, et al. Hydrolysis and acidification of waste activated sludge at different pHs [J]. Water Research,2007,41:683-689.
[9]Li X, Peng Y, Ren N, et al. Effect of temperature on short chain fatty acids (SCFAs) accumulation and microbiological transformation in sludge alkaline fermentation with Ca (OH)2adjustment [J]. Water Research, 2014,61:34-45.
[10]苏高强,霍明昕,汪传新,等.碱的类型对剩余污泥碱性发酵及脱水性能的影响 [J]. 土木建筑与环境工程, 2013:140-146.
[11]Clesceri L S, Greenberg A E, Eaton A D. Standard methods for the examination of water and wastewater [M]. American Public Health Association, Washington, DC, 1998.
[12]Yuan H, Chen Y, Zhang H, et al. Improved bioproduction of short-chain fatty acids (SCFAs) from excess sludge under alkaline conditions [J]. Environmental Science and Technology,2006,40:2025-2029.
[13]Herbert D, Philipps P, Strange R. Carbohydrate analysis [J]. Methods Enzymol. B, 1971,5:265-277.
[14]Classics Lowry O, Rosebrough N, Farr A, et al. Protein measurement with the Folin phenol reagent [J]. J. boil. Chem.,1951,193:265-275.
[15]Goel R, Mino T, Satoh H, et al. Enzyme activities under anaerobic and aerobic conditions in activated sludge sequencing batch reactor [J]. Water Research, 1998,32:2081-2088.
[16]Mu H, Chen Y. Long-term effect of ZnO nanoparticles on waste activated sludge anaerobic digestion [J]. Water Research, 2011,45:5612-5620.
[17]俞毓馨,吴国庆.孟宪庭环境工程微生物检测手册 [M]. 北京:中国环境科学出版社, 1990.
[18]Andreasen K, Petersen G, Thomsen H, et al. Reduction of nutrient emission by sludge hydrolysis [J]. Water Science and Technology,1997,35:79-85.
[19]Stuckey D C, McCarty P L. The effect of thermal pretreatment on the anaerobic biodegradability and toxicity of waste activated sludge [J]. Water Research, 1984,18:1343-1353.
[20]Higgins M J, Novak J T. The effect of cations on the settling and dewatering of activated sludges: Laboratory results [J]. Water Environment Research, 1997,69:215-224.
[21]Tanaka S, Kobayashi T, Kamiyama K, et al. Effects of thermochemical pretreatment on the anaerobic digestion of waste activated sludge [J]. Water Science and Technology, 1997,35:209-215.
[22]Wang Z, Gao M, Wang Z, et al. Effect of salinity on extracellular polymeric substances of activated sludge from an anoxic-aerobic sequencing batch reactor [J]. Chemosphere, 2013,93:2789-2795.
[23]Wingender J, Neu T R, Flemming H-C. Microbial extracellular polymeric substances: characterization, structure, and function [J]. Springer Science and Business Media, 1999.
[24]Sutherland I W. Biofilm exopolysaccharides: a strong and sticky framework [J]. Microbiology, 2001,147:3-9.
[25]Feng L, Chen Y, Zheng X. Enhancement of Waste Activated Sludge Protein Conversion and Volatile Fatty Acids Accumulation during Waste Activated Sludge Anaerobic Fermentation by Carbohydrate Substrate Addition: The Effect of pH [J]. Environmental Science and Technology, 2009:4373-4380.
[26]Yu G -H, He P -J, Shao L -M, et al. Enzyme activities in activated sludge flocs [J]. Appl. Microbiol. Biotechnol., 2007,77:605-612.
[27]Cadoret A, Conrad A, Block J-C. Availability of low and high molecular weight substrates to extracellular enzymes in whole and dispersed activated sludges [J]. Enzyme and Microbial Technology, 2002,31:179-186.
[28]Lu S-g, Imai T, Ukita M, et al. Start-up performances of dry anaerobic mesophilic and thermophilic digestions of organic solid wastes [J]. Journal of Environmental Sciences, 2007,19:416-420.
[29]Zhilina T N, Zavarzin G A. Alkaliphilic anaerobic community at pH 10 [J]. Current Microbiology, 1994,29:109-112.
[30]Bräuer S L, Cadillo-Quiroz H, Yashiro E, et al. Isolation of a novel acidiphilic methanogen from an acidic peat bog [J]. Nature,2006,442:192-194.
[31]Murray P A, Zinder S H. Nutritional requirements of Methanosarcina sp. strain TM-1 [J]. Applied and environmental microbiology, 1985,50:49-55.
[32]Thiele J H, Wu W M, Jain M K, et al. Ecoengineering high rate anaerobic digestion systems: analysis of improved syntrophic biomethanation catalysts [J]. Biotechnology and bioengineering,1990,35:990-999.
[33]Huang J, Pinder K. Effects of calcium on development of anaerobic acidogenic biofilms [J]. Biotechnology and bioengineering, 1995,45:212-218.
[34]Keenan P J, Iza J, Switzenbaum M S. Inorganic solids development in a pilot-scale anaerobic reactor treating municipal solid waste landfill leachate [J]. Water environment research,1993:181-188.
[35]Van Langerak E, Gonzalez-Gil G, Van Aelst A, et al. Effects of high calcium concentrations on the development of methanogenic sludge in upflow anaerobic sludge bed (UASB) reactors [J]. Water Research, 198,32:1255-1263.
[36]El-Mamouni R, Guiot S, Mercier P, et al. Liming impact on granules activity of the multiplate anaerobic reactor (MPAR) treating whey permeate [J]. Bioprocess Engineering, 1995,12:47-53.
[37]Kugelman I J, McCarty P L. Cation toxicity and stimulation in anaerobic waste treatment [J]. Water Pollution Control Federation,1965:97-116.
[38]Chen Y, Cheng J J, Creamer K S. Inhibition of anaerobic digestion process: A review [J]. Bioresource Technology, 2008,99:4044-4064.
[39]McCarty P L. Anaerobic waste treatment fundamentals [J]. Public works, 1964,95:107-112.
[40]Patel G, Roth L. Effect of sodium chloride on growth and methane production of methanogens [J]. Canadian journal of microbiology, 1977,23:893-897.
[41]Su G, Huo M, Yuan Z, et al. Hydrolysis, acidification and dewaterability of waste activated sludge under alkaline conditions:Combined effects of NaOH and Ca(OH)2[J]. Bioresource Technology, 2013,136:237-243.
[42]Elefsiniotis P, Wareham D, Smith M. Use of volatile fatty acids from an acid-phase digester for denitrification [J]. Journal of biotechnology, 2004,114:289-297.
The effect of substrate adding method on performance of sludge alkaline fermentation.
JIN Bao-dan, WANG Shu-ying*, XING Li-qun, PENG Yong-zhen (Engineering Research Center of Beijing, Key Laboratory of Beijing for Water Quality Science and Water Environment Recovery Engineering, Beijing University of Technology, Beijing 100124,China). China Environmental Science, 2015,35(10):3010~3017
In order to study the effect of adding method on the waste activated sludge(WAS) alkaline fermentation in the low temperature (15±2)℃. The WAS were fermented in the NaOH, KOH, Ca(OH)2and mixed alkalis fermentation systems (pH=10±0.2), and changed the dosing method of WAS after the fermentation system stability(a dosing, average two dosing, average three dosing). Dissolution of organic matters, short volatile fatty acids (SCFAs), soluble protein,soluble polysaccharide and key enzyme (hydrolase and coenzyme 420) were analyzed during sludge anaerobic fermentation process. The acetic acid in the SCFAs was also observed. The batch-mode results showed that the dosing method had a significant impact on performance of the hydrolysis and acidification. The soluble chemical oxygen demand(SCOD) decreased with WAS dosing times, where soluble protein and polysaccharide increased. The hydrolytic enzyme decreased with WAS dosing times. However, the coenzyme420 increased in the NaOH and KOH conditions, remained about the same in the mixed alkali condition, declined in the Ca(OH)2condition. The activity of acidification declined with WAS dosing times in NaOH and KOH conditions, but the SCFAs increased in average two dosing and decreased in the average three dosing in the Ca(OH)2condition. Acidification performance was stable relatively in the Ca(OH)2condition and the proportion of acetic acid in SCFAs was the optimal which was higher 10% comparing with other conditions.
alkaline fermentation;dosing method;hydrolytic enzyme;coenzyme 420;alkali type
X703
A
1000-6923(2015)10-3010-08
金宝丹(1985-),女,吉林长春人,博士,主要从事污水处理及水污染控制研究.
2015-03-16
国家自然科学基金(51178007);北京市教委资助项目;第十三届研究生科技基金资助项目(ykj-2014-10608)
* 责任作者, 教授, wsy@bjut.edu.cn
