钒酸铁类Fenton催化剂的制备及性能研究
2015-11-19孙玉颖崔春月青岛农业大学资源与环境学院山东青岛26609哈尔滨工业大学威海海洋科学与技术学院山东威海264209
孙 浩,吴 娟,马 东,孙玉颖,崔春月(.青岛农业大学资源与环境学院,山东 青岛 26609;2.哈尔滨工业大学(威海)海洋科学与技术学院,山东 威海 264209)
钒酸铁类Fenton催化剂的制备及性能研究
孙 浩1,2,吴 娟1*,马 东1,孙玉颖1,崔春月1(1.青岛农业大学资源与环境学院,山东 青岛 266109;2.哈尔滨工业大学(威海)海洋科学与技术学院,山东 威海 264209)
在不同酸碱条件下,采用水热法制备了FeVO4催化剂,利用XRD、TEM、FTIR对产物表征,并将其作为非均相类Fenton催化剂氧化降解有机染料罗丹明B,研究了初始反应溶液pH值、类Fenton试剂中各组分的浓度、钒酸铁催化剂的制备条件等因素对类Fenton反应效率的影响.结果表明,制备的钒酸铁为FeVO4·1.25H2O,在优化条件下降解罗丹明B时60min内脱色率可达97%以上.与传统Fenton试剂相比,类Fenton催化剂具有更广泛的pH适用范围,易于与水分离,应用前景广阔.
类Fenton;钒酸铁;水热法;非均相;罗丹明B
传统Fenton试剂是由Fe2+与H2O2组合而成的一种强氧化剂.在Fe2+的催化作用下H2O2可分解产生氧化还原电位高达2.8V的·OH,无选择性地将各种有机污染物氧化降解,因而在处理含大量难生化降解有机污染物的废水时得到了广泛应用[1-4].但传统Fenton试剂在实际应用中一直存在反应体系pH值偏低(约2~4),均相催化剂Fe2+流失严重难以重复利用,污泥含铁量高后处理复杂等弊端[5-7].为改善这些缺陷,大量研究人员对传统Fenton试剂作了各种改进[8-10],其中将均相催化剂Fe2+替换成含铁的固相催化剂以构成非均相类Fenton体系成为近年来的一种新的研究热点[11-12],其反应机理为:

Deng等[13]采用液相沉积法制备钒酸铁催化剂,并与α-Fe2O3、Fe3O4、γ-FeOOH 3种类Fenton催化剂做比较,结果显示钒酸铁具有更高的催化活性,能适应pH=3~8的条件,并揭示了钒酸铁类芬顿体系中除(1)、(2)外还存在着以下产·OH反应:
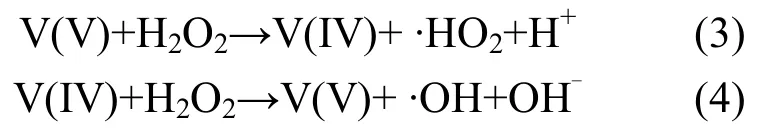
Lehnen等[14]研究发现,草酸根、氯离子、硝酸根这几种不同阴离子的存在对合成钒酸铁的形貌将产生较大影响,进而影响其性能.综合同类研究可以发现,钒酸铁的制备条件均为单一pH值,所得产物的氧化降解能力有较明显差异[13-16].可见,酸碱条件对制备的钒酸铁而言至关重要,然而关于钒酸铁类Fenton催化剂的酸碱制备条件及其对整个类Fenton体系的影响,至今鲜有报道.
本文在不同酸碱条件下,采用水热法制备钒酸铁作为非均相催化剂,替代传统均相Fenton体系降解有机染料罗丹明B(Rh B),探索制备条件对其形貌、结构及催化性能的影响,并研究非均相体系pH、催化剂浓度、H2O2浓度等最优反应条件,以期筛选出一种易于沉降分离、pH适用范围宽、具有更高实用价值的类Fenton催化剂.
1 材料与方法
1.1 试剂与仪器
试剂:硝酸铁(Fe(NO3)3·9H2O)、偏钒酸铵(NH4VO3)、氢氧化钠(NaOH)、氨水(NH3·H2O)、硝酸(HNO3)、草酸、柠檬酸、无水乙醇、H2O2(30%溶液)、Rh B、丙酮,以上试剂均为分析纯.试验中用水均为自制去离子水.
仪器:PHS-3C酸度计、UV-2102型紫外可见分光光度计、德国Multi-N/C 2000总有机碳分析仪、美国PE Optima 8x00电感耦合等离子体发射光谱仪(ICP-OES)等.
1.2 钒酸铁催化剂的制备方法
将5mmol NH4VO3溶于20mL热水中,记为A液,再将5mmol Fe(NO3)3·9H2O溶于20mL水中,记为B液.在磁力搅拌下将A液逐滴加入B液,继续搅拌30min,将混合液转移至50mL水热反应釜中,180℃下加热24h.反应结束后冷却至室温,将产物离心分离,用水和丙酮依次洗涤后,60℃真空干燥过夜,即得钒酸铁类Fenton催化剂.
调节制备体系pH值可得不同类型的类Fenton催化剂,具体步骤如下:在A液中分别加入各5mmol的NaOH、NH3·H2O、H2O、柠檬酸、草酸和HNO3,分别记为FVO-1、FVO-2、FVO-3、FVO-4、FVO-5和FVO-6.
1.3 钒酸铁催化剂的表征方法
钒酸铁形貌用日本日立JEM1011型透射电子显微镜(Transmission electron microscope,TEM)表征,钒酸铁物相用日本理学D/max-rB型X射线衍射仪(X-ray diffractometer,XRD)分析,表面官能团用美国热电IR200型傅里叶变换红外光谱仪(Fourier Transform Infrared Spectroscopy,FTIR)表征.
1.4 类Fenton降解试验
将一定量的钒酸铁、H2O2(30%)加入250mL Rh B溶液(4mg/L)中,进行类Fenton降解实验.用HCl、NaOH调节体系pH值,定时取样测定Rh B剩余浓度.重复该过程3次,所测浓度值取平均.
2 结果与讨论
2.1 钒酸铁形貌分析
钒酸铁样品的TEM图像如图1所示.

图1 钒酸铁样品的TEM图像Fig.1 TEM images of iron(III)vanadate samples
从图1可以看出,在碱性条件下水热反应制得的FVO-1、FVO-2样品,其钒酸铁晶体均成纳米棒状,这是由于偏钒酸铵在碱性条件下溶解性好,更易于钒酸铁晶粒的生长所致.中性条件下制备的FVO-3样品长度相对较短,且直径较碱性条件下小,纳米棒的分散性更好.酸性条件下制备的FVO-4、FVO-5和FVO-6三个样品的形貌为纳米棒和纳米颗粒的混合物,这可能是由于酸根离子的螯合作用限制了部分钒酸铁晶粒的各向异性生长,导致纳米颗粒的生成,另一方面在酸性条件下会导致暂时性Fe(OH)2的产生进而影响钒酸铁的成核[14],同时可能会造成钒酸铁颗粒结晶不完全.
2.2 钒酸铁物相及表面结构分析
对六种钒酸铁样品进行XRD分析,并对FVO-3样品进行了FTIR光谱分析,结果见图2.
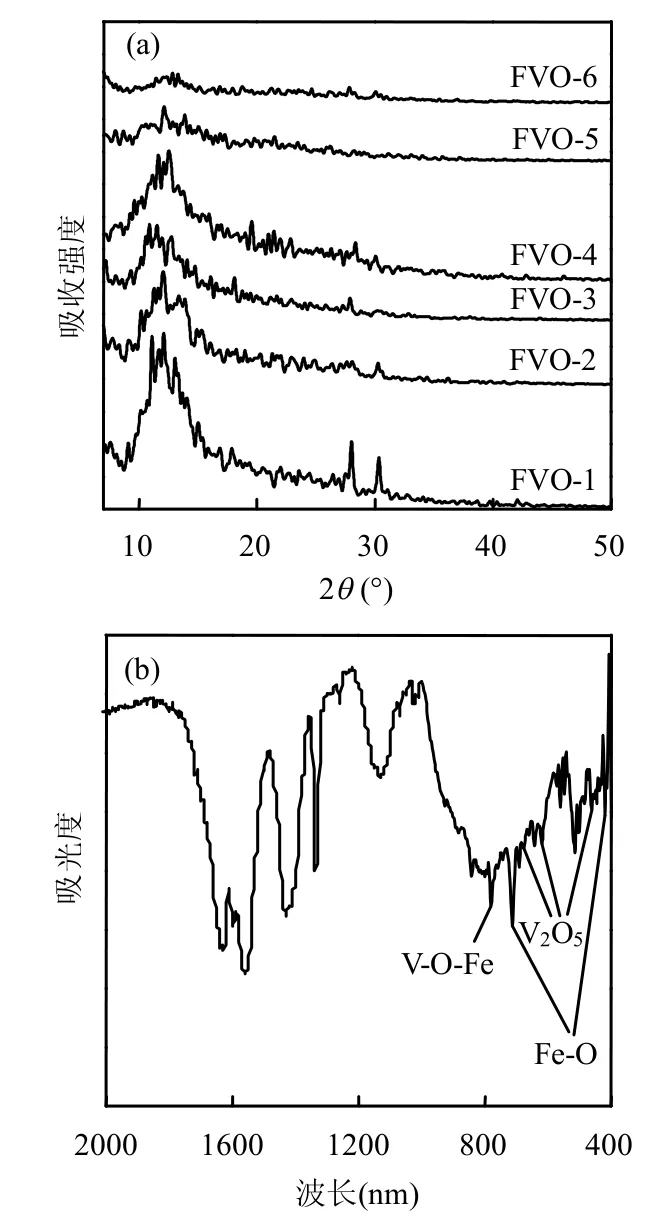
图2 钒酸铁样品的XRD(a)、FTIR(b)图谱Fig.2 XRD(a)and FTIR(b)spectra of FVO samples
经比对XRD标准库,试验制备的钒酸铁样品均为水钒铁矿(FeVO4·1.25H2O),其特征峰与标准卡片(JCPDS 27-0257)吻合[15].FVO-5、FVO-6样品的特征峰明显较弱,可见中强酸条件不利于钒酸铁晶体的形成.下文降解实验中采用结晶度最好的FVO-1样品来探索类Fenton降解反应条件.在FVO-3样品的红外光谱图中出现了钒酸铁结构的特征吸收峰.其中,781cm-1的吸收峰属于V—O—Fe的骨架特征吸收,714和420cm-1的吸收峰归属于铁氧八面体结构中Fe—O键的伸缩振动,而677、619和461cm-1处的吸收峰归属于V2O5的骨架特征吸收,其中677cm-1归属为V—O—V的弯曲振动,461cm-1归属为VV O的弯曲振动[16-17].
2.3 钒酸铁投加量
在初始pH值为3、H2O2的浓度为5mmol/L的条件下,依次将FVO-1的浓度设置为0,1,2.5,5,7.5mmol/L,对Rh B染料的降解结果见图3.
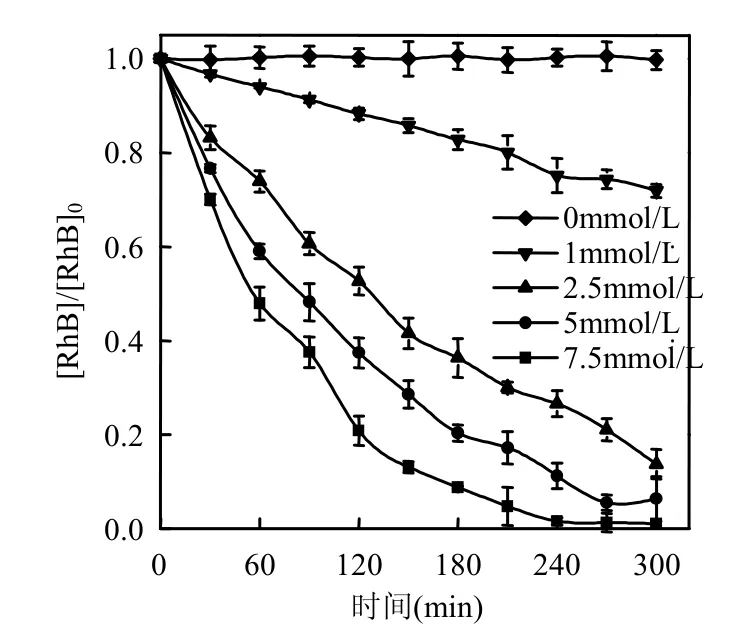
图3 钒酸铁FVO-1投加量对Rh B降解的影响Fig.3 Effect of FVO-1dosage on degradation of Rh B
从图3可知,随着钒酸铁的浓度逐渐增加至2.5mmol/L,经过300min的脱色降解,Rh B的降解速度迅速提高,其残留率已经降至不足15%,继续提高其浓度至7.5mmol/L过程中,Rh B的降解速度仍有提高,300min后其残留率可减至不足1%,但降解速度的提升有所变缓,且钒酸铁投加量过高其降解效率相差不明显,综合考虑优选钒酸铁投加量为2.5mmol/L.
非均相类Fenton反应主要发生在催化剂的表面,增加钒酸铁催化剂的投加量,非均相反应接触面积、·OH产量也随之增加,故而类Fenton反应速率也随之增加.继续投加钒酸铁时,降解速率增速减缓,这是由于钒酸铁投加量增加虽然增加了·OH产量,但由于自由基寿命极短以致无法及时氧化降解溶液中的Rh B染料,反而加速了·OH的淬灭,且Rh B降解效率本身已经较高,很难有再进一步提升的空间[18].
2.4 H2O2投加量
在pH值为3、FVO-1浓度为2.5mmol/L条件下,设置非均相体系中H2O2浓度梯度为0,0.25,0.5,0.75,1mmol/L,其降解Rh B的结果见图4.

图4 双氧水投加量对Rh B降解的影响Fig.4 Effect of H2O2dosage on degradation of Rh B
从图4可知,H2O2浓度由0增至0.5mmol/L过程中,Rh B降解速率不断增加,超过0.5mmol/L后降解速率开始不断下降.在H2O2浓度为0.75mmol/L时,300min后Rh B残留率已经降至不足0.1%.这是由于H2O2浓度较低时,随着H2O2浓度的增加最终产生的·OH自由基的数量也随之增加,但当H2O2的浓度超过其临界值时,由于H2O2对·OH的捕获作用亦随之加强,反而使溶液中·OH总量减少,使Rh B的降解速率随之降低[19].
2.5 体系pH值
在FVO-1投加量为2.5mmol/L、H2O2浓度为0.75mmol/L的条件下,调节反应体系pH值范围1~6,此时对Rh B的降解结果如图5所示.
由图5可知,类Fenton体系pH值范围在1~3时,Rh B的降解率较高,pH为3时240min的降解率接近100%.继续提高体系pH值时,Rh B的降解速率下降,Rh B的降解率不足20%.这是由于在较低pH条件下,由于氢离子能大量捕获·OH,类Fenton反应的降解能力大大降低[20].在较高pH条件下,所溶出的Fe3+在溶液中可形成Fe(OH)3化合物,进而减慢了催化产生·OH的速度,降低Fenton反应速率[21].另外钒酸铁中Fe3+溶出率亦会随着pH提高而降低,因而使得其对Rh B的降解效率迅速降低.
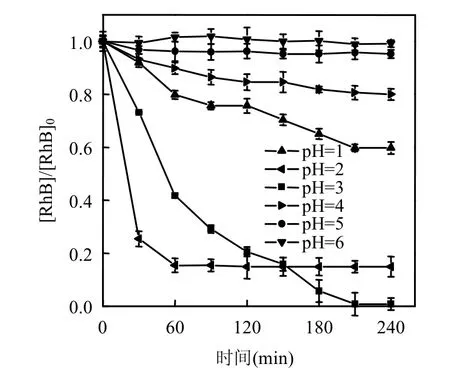
图5 类Fenton体系pH对Rh B降解的影响Fig.5 Effect of pH of Fenton-like on degradation of Rh B
2.6 钒酸铁的筛选
在钒酸铁浓度为2.5mmol/L、H2O2浓度为0.75mmol/L时,调节体系pH值分别为3和7,考察制备的6种钒酸铁样品对Rh B降解的影响,见图6.从图6(a)可知,在pH=3时,碱性(FVO-1、FVO-2)或中性(FVO-3)条件下制备的钒酸铁样品对Rh B的降解速率优于酸性条件.其中,FVO-3样品的降解速率最快,240min后降解率为97.2%.从图6(b)可见,在pH=7时,FVO-3样品降解Rh B的效率最高,240min后降解率达76%.由此可见,FVO-3样品在酸性和中性条件下较其他样品均表现出了良好的降解效率,说明其不仅在传统Fenton酸性体系中性能优异,在中性条件下也表现出良好的降解能力.综合考虑图1中各样品的TEM图可知,FVO-3样品优异的催化活性可归结为其纳米棒状的长度相对更短,直径相对更小,纳米棒的分散性更好所致.
在FVO-3浓度2.5mmol/L,H2O2浓度0.75mmol/L的条件下,体系pH值在1~12范围内对Rh B进行降解,并与同条件下传统均系Fenton体系(Fe2+)进行对照,结果见图7.由图7可见,传统Fenton体系在pH<4的强酸性条件下具有较高的降解能力,FVO-3样品却表现出了较宽的使用条件,在pH值1~9范围内均具有较高的氧化降解能力.同时,相对于传统芬顿反应,FVO-3非均相类Fenton反应结束后,可通过沉淀实现固相Fenton试剂与废水的分离,弥补了传统Fenton体系的固有缺陷.

图6 不同pH值条件下钒酸铁样品对Rh B降解曲线Fig.6 Optimization of FVO samples by degradation of Rh B in different pH
2.7 降解产物分析
在FVO-3浓度2.5mmol/L、H2O2浓度0.75mmol/L、pH值为7的条件下降解Rh B,降解液的紫外可见吸收光谱和TOC浓度见图8.经过4h降解后,Rh B在554nm处的特征吸收峰迅速下降,表明生色团被逐渐分解,紫外区的吸收也随时间逐渐降低,说明其降解产物没有产生累积,而是迅速被矿化.此结果亦可从降解液的TOC浓度变化来印证,Rh B染料4h的矿化率为82.2%,表明Rh B及其降解中间产物可有效被FVO-3类Fenton过程中产生的·OH等活性基团矿化.
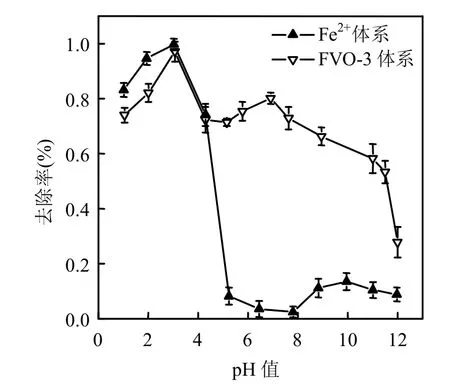
图7 FVO-3与Fe2+体系在pH 1~12范围的对照曲线Fig.7 Comparison of FVO-3与Fe2+system at pH 1~12
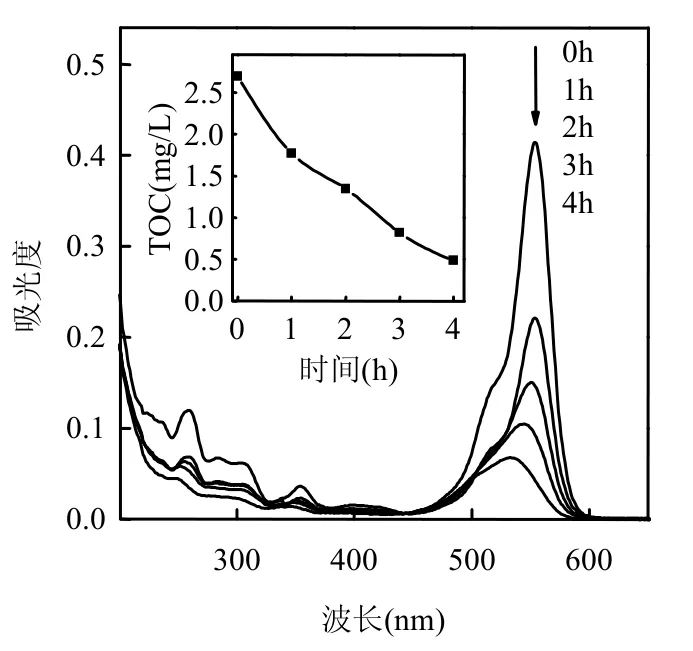
图8 钒酸铁类Fenton体系的TOC和UV-VIS图谱Fig.8 TOC and UV-VIS spectra of FVO Fenton-like system
2.8 催化剂的溶出与回收
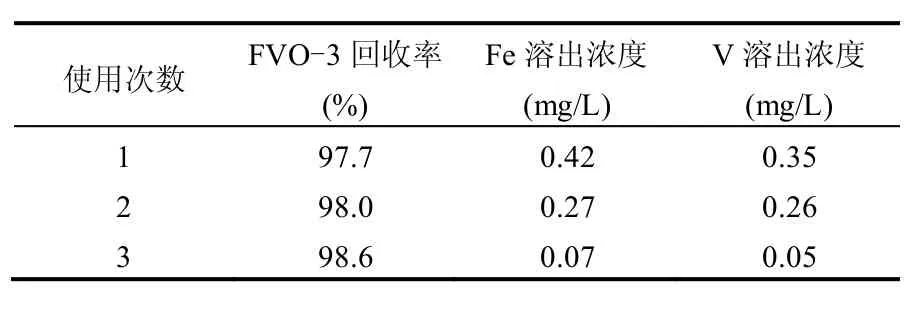
表1 FVO-3的重复使用回收率与Fe、V溶出浓度Table 1 Recovery rate and Leaching performance of FVO-3
在FVO-3浓度2.5mmol/L、H2O2浓度0.75mmol/L、pH值为7条件下降解Rh B,反应4h后沉淀15min倒出全部上清液并测定其Fe、V浓度,同时沉淀物干燥后称量并计算沉淀回收率.重复上述过程3次,试验结果见表1.FVO-3催化剂具有较好的沉淀效果,沉淀回收率97%以上.Fe、V溶出率很低,且随重复利用次数增加而逐渐降低.
3 结论
3.1 由水热法在不同酸碱条件下制备的类Fenton催化剂均为水钒铁矿FeVO4·1.25H2O.
3.2 制备的FVO-3样品在投加量2.5mmol/L、H2O2投加量0.75mmol/L、pH=3时,历时240min后对Rh B的降解率为97.2%.
3.3 与传统Fenton体系比,在pH=1~9范围内均有较强氧化能力,是一种具有pH宽响应、可重复利用、经济环保、前景广阔的类Fenton催化剂.
[1]Neyens E,Baeyens J.A review of classic Fenton’s peroxidation as an advanced oxidation technique[J].Journal of Hazardous Materials,2003,98(1-3):33-50.
[2]Chamarro E,Marco A,Esplugas S.Use of Fenton reagent to improve organic chemical biodegradability[J].Water Research,2001,35(4):1047-1051.
[3]Richard J W,Matthew D U,Paul A R,et al.Treatment of pentachlorophenol-contaminated soils using Fenton's reagent[J].Hazardous Waste and Hazardous Materials,1990,7(4):335-345.
[4]Potter F J,Roth J A.Oxidation of chlorinated phenols using Fenton's reagent[J].Hazardous Waste and Hazardous Materials,1993,10(2):151-170.
[5]李 新,刘勇弟,孙贤波,等.印染废水生化出水中各类有机物在Fenton氧化过程中的去除效果[J].环境工程学报,2012,6(11):3953-3958.
[6]高迎新,张 昱,杨 敏,等.Fe3+或Fe2+均相催化H2O2生成羟基自由基的规律[J].环境科学,2006,27(2):305-309.
[7]张 欣,吴昌永,石忠涛,等.CLT酸生产废水的Fenton氧化预处理试验研究[J].中国环境科学,2012,32(4):630-634.
[8]Sanz J,Lombraña J I,De Luis A M,et al.Microwave and Fenton’s reagent oxidation of wastewater[J].Environmental Chemistry Letters,2003,1(1):45-55.
[9]Ermírio J,Moraes F,Frank H,et al.Treatment of saline wastewater contaminated with hydrocarbons by the photo-Fenton process[J].Environmental Science and Technology,2004,38(4):1183-1187.
[10]Pozza A D,Ferrantelli P,Merli C,et al.Oxidation efficiency in the electro-Fenton process[J].Journal of Applied Electrochemistry,2005,35(4):391-398.
[11]Panda N,Sahoo H,Mohapatra S.Decolourization of methyl orange using Fenton-like mesoporous Fe2O3-SiO2composite[J].Journal of Hazardous Materials,2011,185(1):359-365.
[12]存 洁,田森林,王 倩,等.二茂铁催化光助非均相类Fenton氧化法处理含罗丹明B废水[J].中国环境科学,2013,33(6):1011-1016.
[13]Deng J H,Jiang J Y.FeVO4as a highly active heterogeneous Fenton-like catalyst towards the degradation of Orange II[J].Applied Catalysis B: Environmental,2008,84(3/4):468-473.
[14]Lehnen T,Valldor M,Nižňanský D,et al.Hydrothermally grown porous FeVO4nanorods and their integration as active material in gas-sensing devices[J].Journal of Materials Chemistry A,2014,2:1862-1868.
[15]Chen L,Liu F Q,Li D B.Precipitation of crystallized hydrated iron(III)vanadate from industrial vanadium leaching solution[J].Hydrometallurgy,2011,105:229-233.
[16]Morton C D,Slipper I J,Thomas M J K,et al.Synthesis and characterisation of Fe-V-O thin film photoanodes[J].Journal of Photochemistry and Photobiology A: Chemistry,2010,216:209-214.
[17]Routray K,Zhou W,Kiely C J,Catalysis Science of Methanol Oxidation over Iron Vanadate Catalysts: Nature of the Catalytic Active Sites[J].ACS Catalysis,2011,1,54-66.
[18]冯 勇,吴德礼,马鲁铭.黄铁矿催化类Fenton反应处理阳离子红X-GRL废水[J].中国环境科学,2012,32(6):1011-1017.
[19]Buxton G V,Greenstock C L,Helman W P,et al.Critical review of rate constants for reactions of hydrated electrons,hydrogen atoms and hydroxyl radicals(·OH/·O-)in aqueous solution[J].Journal of Physical and Chemical Reference Data,1988,17(2):1-21.
[20]Tang W,Huang C.Effect of chlorinated phenols on their oxidation killetics by Fenton’s reagent[J].Chemosphere,1996,33(8):1621-1635.
[21]Pignatello J J.Dark and photoassisted Fe3+-catalyzed degradation of chlorophenoxy herbicides by hydrogen peroxide[J].Environmental Science and Technology,1992,26(5):944-951.
Preparation of iron(III)vanadate Fenton-like catalyst and its catalytic performance.
SUN Hao1,2,WU Juan1*,MA Dong1,SUN Yu-ying1,CUI Chun-yue1(1.Resources and Environment College,Qingdao Agricultural University,Qingdao 266109,China;2.School of Marine Science and Technology,Harbin Institute of Technology at Weihai,Weihai 264209,China).China Environmental Science,2015,35(6):1734~1739
Iron(III)vanadate catalysts were prepared by a hydrothermal method under different acid-base.The obtained samples were characterized by X-ray diffraction(XRD),transmission electron microscope(TEM)and Fourier Transform infrared spectroscopy(FTIR).The as-prepared samples were used as Fenton-like catalysts on the degradation of Rhodamine B(Rh B)which was used as a model pollutant.The effects of pH value,H2O2concentration,iron(III)vanadate concentration and the type of iron(III)vanadate on the heterogeneous Fenton-like degradation of Rh B were investigated.The XRD patterns indicate that Iron(III)vanadate samples were FeVO4·1.25 H2O.The decolorization rate of Rh B at 60 min could reach 97%at the optimal operating conditions.The range of pH values which the FeVO4·1.25 H2O was appropriate was found to be much wider than that of the classic Fenton's reagent.Moreover,FeVO4·1.25 H2O samples could be reutilized for the perfect settling performance.The Fenton-like catalysts may have a better prospect of application in wastewater treatment.
Fenton-like;iron(III)vanadate;hydrothermal method;heterogeneous;Rh B
X703.5
A
1000-6923(2015)06-1734-06
孙 浩(1990-),男,山东高青人,哈尔滨工业大学(威海)硕士研究生,主要从事环境功能材料和便携式环境分析仪器的研发及应用研究.
2014-11-01
国家自然科学基金项目(51208274,21307065);山东省自然科学基金项目(ZR2011EL044);青岛农业大学高层次人才启动基金项目(631016)
* 责任作者,副教授,wujuan410@163.com
