污水中抗生素与重金属对红霉素抗药性基因的选择性效应
2015-11-18李侃竹刘振鸿东华大学环境科学与工程学院上海20620国家环境保护纺织工业污染防治工程技术中心上海20620
李侃竹,高 品,2*,王 凯,刘振鸿,2,薛 罡,2(.东华大学环境科学与工程学院,上海 20620;2.国家环境保护纺织工业污染防治工程技术中心,上海 20620)
污水中抗生素与重金属对红霉素抗药性基因的选择性效应
李侃竹1,高 品1,2*,王 凯1,刘振鸿1,2,薛 罡1,2(1.东华大学环境科学与工程学院,上海 201620;2.国家环境保护纺织工业污染防治工程技术中心,上海 201620)
采用电感耦合等离子体质谱(ICP-MS)和固相萃取-高效液相色谱串联质谱(SPE-HPLC-MS/MS)分别检测分析了上海某污水处理厂中6种重金属和3种抗生素的含量水平和分布特征,采用实时荧光定量PCR检测分析了7种红霉素抗药性基因(ERY-ARGs)在污水处理厂中的分布变化.结果表明,抗生素磺胺甲恶唑(SMX)、红霉素(ERY)和四环素(TC)在污水处理厂中均被检出,两段A/O工艺对其去除效果较差,去除率为3%(ERY)~36%(TC).重金属Cr、Cu、Zn和Pb在污水中被检出,浓度范围分别为136.9~235.5、7.1~37.4、18.1~98.4和143.1~383.0μg/L,两段A/O工艺对Zn基本完全去除,但对Cu、Pb和Cr的去除率分别为48%、43%和18%.目标ERY-ARGs在污水处理厂中均被检出,其在原水中的浓度为9.28×103(ermA)~1.83×108(ereA)copies/L,两段A/O工艺对其具有较好的去除效果,降低幅度可达1.19~3.97个对数浓度.通过相关性分析可知, ERY-ARGs与ERY之间具有显著相关性(P<0.05),而酯酶基因ereA与Cu、Zn和Pb之间也呈现出较好的显著相关性(P<0.05),表明污水中ERY对ERY-ARGs的演变产生具有重要影响,而重金属对ERY-ARGs也可能存在潜在的选择性作用.
污水;抗药性基因;抗生素;重金属;选择性效应
近年来,环境中细菌抗药性基因(ARGs)的产生和散播受到广泛关注[1].目前普遍认为,ARGs的演变产生是由抗生素药物产生的持续选择性压力所引起的[2-3].通常情况下,抗生素药物进入人体和动物体内后只能被部分代谢吸收,未被代谢的则会随着排泄物进入污水中,最终进入城市污水处理厂进行处理[4].在生物处理过程中,细菌与抗生素药物持续混合,这为细菌抗药性的产生和传播创造了合适的环境[5].此外,污水中其他污染物如重金属等也可能会对抗药性细菌产生共选择效应[6].有研究指出,当金属的浓度超过细菌可利用量时,作为其SOS(Save our soul)应答反应中的部分抵抗机制可能会被诱发以减轻重金属所带来的毒性作用[7].因此,深入研究污水处理厂中抗生素药物及重金属等污染物对抗药性基因产生的选择诱导作用对于控制ARGs的产生和传播具有重要意义.
红霉素(ERY)是一种常用的大环内酯类抗生素,其结构稳定,难以被生物降解去除,因此在城市污水和地表水中被频繁检出[8-10].通常情况下,细菌微生物对ERY的抵抗机制主要包括3种[11]:通过外排泵机制将ERY排出体外;通过改变或修饰ERY在核糖体上的结合作用位点;直接破坏ERY的分子结构使其失去抗菌作用.然而,要实现对ERY的有效降解,相关降解微生物对其必须具有抵抗性.有研究表明[12],污水中抗药性酯酶基因ereA的存在和增殖是ERY得以降解的重要原因.
本研究根据细菌微生物对ERY抵抗机制的不同,共选取7种ERY-ARGs(包括ereA、ereB、mefA/mefE、ermA、ermB、ermC和msrA/ msrB)作为研究对象,考察其在污水处理过程中浓度分布和去除特征,其中mefA/mefE和msrA/msrB为ERY外排泵基因,ermA、ermB和ermC为ERY核糖体甲基化酶基因,ereA和ereB为酯酶基因[13-14].此外,通过对污水中3种抗生素和6种重金属进行检测分析,探讨其与ERY-ARGs之间的相关关系,为揭示污水处理系统中ARGs演变和散播机制及其影响因素提供科学依据.
1 材料与方法
1.1 仪器与试剂
分析仪器:微波消解仪(MARS 5,CEM)、电感耦合等离子体质谱仪(iCAP-Q ICP-MS,Thermo Fisher)、固相萃取装置(Supelco)、HLB固相萃取小柱(500mg/6mL,Waters)、恒温水浴氮气吹干仪(Organomation Associates)、高效液相色谱串联双质谱仪(HPLC-MS/MS,VARIAN 310)、台式高速离心机(Thermo Scientific)、实时荧光定量PCR仪(Rotor-Gene 3000qPCR,Corbett)、核酸蛋白测定仪(NanoDrop 2000C,Thermo Scientific).
药品与试剂:磺胺甲恶唑(SMX,纯度为99%)、ERY(纯度为99.8%)和盐酸四环素(TC,纯度为99%)标准品均购自德国Dr. Ehrenstorfer公司.甲醇和乙腈均为色谱纯,购自美国Honeywell Burdick & Jackson公司;其它化学试剂均为分析纯,购自国药集团化学试剂有限公司.
1.2 样品采集
污水样采自上海某城市污水处理厂,该厂污水处理采用两段式A/O工艺,采样点位置包括:原水进水(W1)、曝气沉砂池出水(W2)、一级A/O出水(W3)、中间沉淀池出水(W4)、二级A/O出水(W5)和最终二沉池出水(W6).采样时间为2013年12月~2014年3月,共采集3次,每次取2个平行样,采集体积为1L,水样装入聚丙烯瓶后放入装有冰袋的冷却箱内,然后迅速运回实验室进行预处理.
1.3 检测分析方法
1.3.1 目标抗生素药物检测方法 污水样先经0.45μm的滤膜过滤,滤液收集后加入500mg/L Na2EDTA,采用0.1mol/L的磷酸将水样pH值调至5后进行固相萃取.固相萃取小柱先用6mL甲醇和6mL超纯水预活化,然后将水样通过固相萃取小柱进行富集,流速为5mL/min.富集完成后,加入10mL超纯水淋洗固相萃取小柱以去除一些残留的无机离子,然后真空干燥,干燥后采用6mL甲醇对富集的目标抗生素药物进行洗脱,洗脱液使用氮气吹干,最后使用甲醇定容至1mL,装入2mL琥珀色进样小瓶待测.
目标抗生素药物采用HPLC-MS/MS检测,色谱柱为Welch Ultimate XB-C18柱(150mm× 2.1mm,3μm),流速0.2mL/min,进样量20μL,柱温30ºC.质谱检测为电喷雾离子源正离子模式,流动相分别为含0.1%甲酸的水溶液(相A)和100%乙腈(相B).采用梯度洗脱模式,每个梯度完成后平衡时间为5min.检测模式为多离子反应检测(MRM)扫描模式.
水样中目标抗生素药物浓度采用外标法进行计算,检测分析方法的回收率为86.4%~108.5%.
1.3.2 重金属检测方法 水样消解预处理方法参照美国环境保护署推荐方法(USEPA 3015A)[15].首先,取5mL经0.45µm滤膜过滤后的水样置于聚四氟乙烯消解管中,分别加入1.5mL浓HNO3和1mL 饱和H2O2,混合后静置30min,然后放入微波消解仪中进行消解,微波消解过程参数[16]见表1.消解完成后,将消解液转至10mL的容量瓶中,使用体积分数为1% 的HNO3进行定容.检测时,先将样品溶液在10000r/min转速下离心10min,上清液经0.45μm滤膜过滤后采用ICP-MS测定溶液中Cr、Ni、Cu、Zn、Cd和Pb等重金属的含量,每次检测做3个平行样. ICP-MS主要检测条件参数见表2.

表1 微波消解条件参数Table 1 Optimized parameters for microwave digestion process
1.3.3 ERY-ARGs检测方法 采用TIANamp Soil DNA Kit (TIANGEN)提取样品DNA,操作步骤参照试剂盒说明书,所提取的DNA使用1%琼脂糖凝胶电泳和NanoDrop 2000C核酸蛋白测定仪分别检测其纯度和浓度.结果显示,所提取DNA的OD260/OD280值均大于1.8,纯度符合要求.
目标ERY-ARGs包括ereA、ereB、mefA/mefE、ermA、ermB、ermC和msrA/msrB,所使用的扩增引物序列见文献[17].qPCR反应体系(20μL)包括:10μL SuperReal Premix Plus(2×)(TIANGEN),上下游引物(10μmol/L)各1μL,DNA模板1μL,ddH2O 7μL.qPCR反应程序:95ºC预变性15min,95ºC变性10s,58℃退火30s,72℃延伸32s,共反应40个循环.每个样品做3个平行样,同时采用无菌水作为阴性对照.
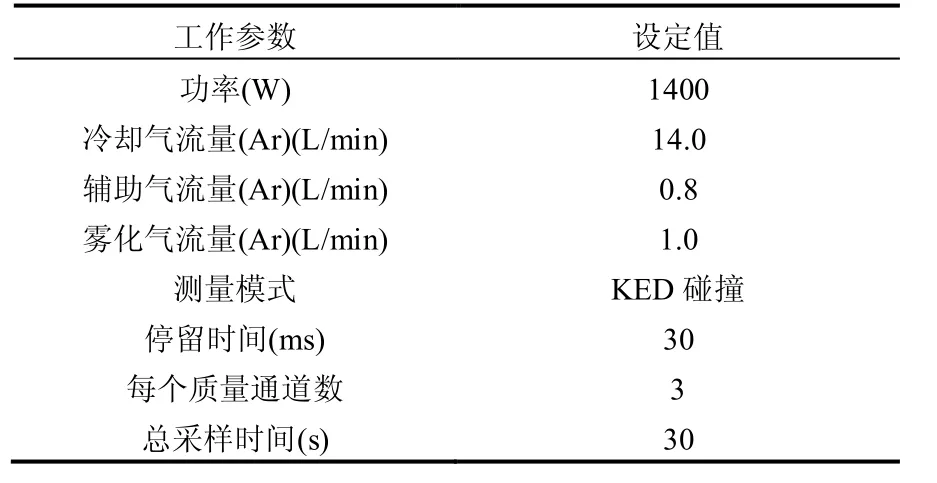
表2 ICP-MS检测条件参数Table 2 Operating parameters for ICP-MS detection
1.4 数据分析
目标抗生素药物、ARGs和重金属含量数据分析均采用3次采样的检测平均值.利用SPSS 19.0统计分析软件对检测数据进行处理,计算因变量和自变量之间的皮尔逊相关系数(R)和P值.P≤0.05认为变量之间具有显著相关性,反之则认为相关性不显著.
2 结果与讨论
2.1 目标抗生素药物在污水处理过程中的含量水平

图1 抗生素药物在污水处理过程中的浓度水平(n=6)Fig.1 Concentration of antibiotics during the sewage treatment process (n=6)
图1为目标抗生素药物在污水处理过程中的浓度分布情况.由图1可以看出, SMX、ERY和TC三种抗生素在污水处理厂中均被检出,浓度范围分别为24.5~38.7,47.5~49.2和43.1~85.4ng/L. Chang等[18]在重庆某污水处理厂最终出水中检出SMX、ERY和TC的浓度分别为2020、206和118ng/L,均要高于本研究检测结果,分析原因可能是不同区域抗生素药物的使用情况不同.此外,通过数据分析可知,两段A/O工艺对目标抗生素药物的去除效果普遍较差,去除率仅为3%(ERY)~36%(TC),大部分去除效果主要发生在一级A/O处理段,而初级处理工艺(格栅+曝气沉砂池)对其去除效果微乎其微.与此同时,由图1分析可以发现,ERY在整个污水处理流程中的浓度水平基本保持不变,表明ERY分子结构稳定,在传统活性污泥系统中难以被有效去除.Rosal等[19]在西班牙一家城市污水处理厂中检测发现了类似结果.
2.2 重金属在污水处理过程中的分布特征
在污水样中共检出Cr、Cu、Zn和Pb四种重金属元素,其在整个污水处理过程中的分布变化特征如图2所示.重金属检出浓度由高到低的排列顺序为Pb>Cr>Zn>Cu,浓度范围分别为143.1~383.0、136.9~235.5、18.1~98.4和7.1~37.4μg/L.Karvelas等[20]在希腊塞萨洛尼基一家污水处理厂同样检测出Cr、Cu、Zn和Pb等重金属元素,浓度高低顺序为Zn>Cu>Pb>Cr,浓度范围分别为270~470、33~79、27~39和20~40μg/L,其中Zn和Cu的浓度高于本研究结果,而Pb和Cr则相反.这可能是由于不同地区污水处理厂所接纳的污水水质、周边环境重金属污染状况等不同所造成的.
由图2分析可知,两段A/O工艺对Zn的总体去除效果最好,对Cu和Pb的去除率分别约为48%和43%,但对Cr的去除效果较差,去除率仅为18%.Üstün[21]在土耳其布尔萨一家城镇污水处理厂检测结果显示,活性污泥系统对Cr、Cu、Zn和Pb等重金属的去除率可达47%~95%.由于活性污泥处理工艺的设计主要是针对有机污染物的去除[22],并且污水成分相对复杂,其中腐殖酸等物质与重金属之间还会发生吸附螯合作用,导致重金属在污水处理过程中的去除变化较大[23].通过图2进一步分析可知,污水中重金属的去除主要发生在物理处理阶段(曝气沉砂池和中间沉淀池),初级处理工艺对Cr、Cu、Zn和Pb的去除幅度约为21%(Pb)~36%(Zn).在生物处理阶段,活性污泥由于静电作用实现对重金属的吸附,这些与活性污泥结合的重金属最终通过剩余污泥的排出得到去除,检测结果显示,中间沉淀池对Cr、Cu、Zn和Pb等重金属的去除率可达39%(Cr)~73%(Zn).

图2 重金属在污水处理过程中的浓度水平(n=6)Fig.2 Concentration of heavy metals during the sewage treatment process (n=6)
2.3 污水处理过程中ERY-ARGs的浓度分布和去除特征
图3为污水处理过程中目标ERY-ARGs的浓度分布情况.由图3可知,目标ERY-ARGs和16S rRNA基因在原水中均被检出,其中ereA浓度最高,达1.83×108copies/L,而ermA的浓度最低,为9.28×103copies/L.此外,ereB、mefA/mefE和ermB在原水中的浓度也相对较高,均超过107copies/L.从图3还可以看出,目标ERY-ARG在整个污水处理工艺流程中呈现出逐步降低的趋势,表明两段A/O工艺对目标ERY-ARGs具有较好的去除效果,去除幅度可达1.19~3.97个对数浓度,其中一级A/O工艺段对目标ERY-ARGs具有显著去除效果(P<0.05),去除幅度为0.88(ermB)~3.12(ermA)个对数浓度,而二级A/O段对ermA去除效果显著,在最终处理出水中未检出,但对其他目标ERY-ARGs未发现具有明显的去除效果(ermB除外).
2.4 目标抗生素与ERY-ARGs之间相关性分析
据报道,抗生素药物产生的持续选择性压力是细菌抗药性出现的主要原因[24],但也有研究表明[25-26],当抗生素药物的选择性压力消失或减弱时,相应ARGs并未随之消失或减少.目前,关于抗生素药物对其ARGs演变产生的选择性机制尚不清楚[27].
表3为目标抗生素与ERY-ARGs之间的相关性分析数据,可以发现,SMX作为一种磺胺类抗生素药物,与ERY-ARGs之间无显著相关性,而TC为四环素类抗生素药物,与ERY-ARGs之间也无显著相关性(msrA/msrB除外).尽管如此,表3数据显示,ERY与目标ERY-ARGs(除ermA)之间均呈现出显著相关性(0.859≤R≤0.963,P<0.05),而且与酯酶基因ere总和、核糖体甲基化酶基因erm总和、外排泵基因mef/msr总和,以及ERY-ARGs总和之间具有极高显著相关性(0.865≤R≤0.975,P<0.05),这在一定程度上表明污水中ERY对其相应ARGs的诱导产生和散播具有一定促进作用.Gao等[28]研究发现,活性污泥系统中磺胺类抗生素浓度与其相应ARGs sulI之间具有显著的线性相关性(R2=0.97, P<0.05).
作为ARGs的直接选择压力,环境中ARGs的丰度与其对应的抗生素浓度应存在一定的相关性.然而有研究显示,环境中ARGs的丰度与非同族抗生素之间可能也存在良好的相关性.Chad等[29]研究发现养殖场附近磺胺类抗生素与四环素类ARGs之间的相关性要高于四环素类抗生素与四环素类ARGs之间的相关性,同时也高于其与磺胺类ARGs之间的相关性,这可能是环境中抗生素对ARGs共选择的结果.在其它族抗生素的选择性压力下,可移动遗传因子上可能会同时携带一种或多种ARGs,从而使得环境中的ARGs丰度升高,并导致ARGs与不同族抗生素之间的相关性不断增强[30-31].
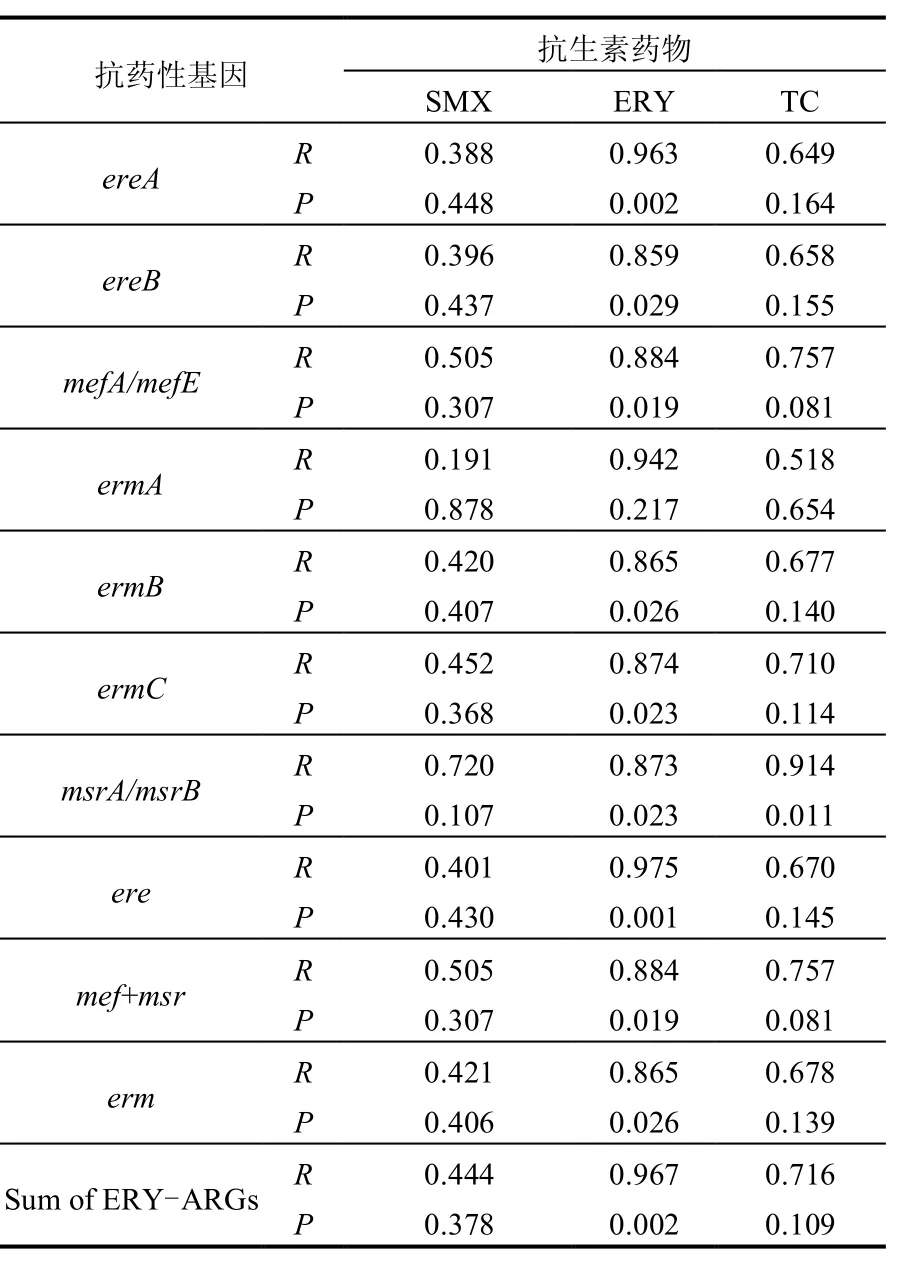
表3 目标抗生素与ERY-ARGs之间相关性分析Table 3 Correlation analysis between concentrations of the target antibiotics and ERY-ARGs
2.5 检出重金属与ERY-ARGs之间相关性分析
ERY对ERY-ARGs的演变产生具有一定的诱导作用.Ji等[32]对养殖场周边的农田土壤检测分析发现,四环素类和磺胺类抗生素与其相应ARGs之间没有显著相关性,而与重金属Cu、Zn和Hg之间呈现出较好的显著相关性,这表明重金属的存在对细菌微生物抗性的产生和传播可能也具有非常重要的作用.
由表4中数据分析可知,酯酶基因ereA与重金属Cu、Zn和Pb之间均呈现出较好的显著相关性(0.826≤R≤0.886,P<0.05),其它ERY-ARGs与重金属Cr、Cu、Zn和Pb之间也呈现出一定的正相关性(R值在0.491~0.886之间),但并不显著(P>0.05),表明重金属的存在可能是污水处理过程中ERY-ARGs丰度变化的一个重要因素. Knapp等[33]研究发现,在使用抗生素之前,土壤中的ERY-ARGs(ermB、ermC、ermE和ermF)就与重金属(Co、Cr、Cu、Ni、Pb、Zn和Fe)存在一定的相关性,其中ermB和ermF与重金属Cu之间具有显著相关性.事实上,有研究表明[34],重金属能够诱导细菌微生物对抗生素药物产生抵抗性或加强其抗性.Mcarthur等[35]在研究地表河流中链霉素和卡那霉素抗性细菌的空间分布时发现,抗药性细菌出现频率最高的地方是在一个接纳核反应堆和工业中心污水的支流与河流的汇合处,并随着汇合点往上游方向增加.此外,细菌抗药性与沉积物中Hg的含量呈现显著相关性(R2=0.54,P=0.023),表明重金属Hg可通过间接的选择性压力增强细菌微生物对相应抗生素药物的抵抗性.Stepanauskas等[36]研究发现,抗生素药物氨苄青霉素和四环素,以及重金属Cd和Ni均会显著提高具有多重抗药性菌群的检出频率,表明重金属暴露对抗药性菌群具有共选择效应.
虽然低浓度的重金属元素对细菌微生物的生理和生化过程是必不可少的,然而高浓度的重金属可能会对其产生毒害作用,破坏其DNA和细胞膜结构.此外,这部分不能被细菌所利用的重金属可能会诱发细菌SOS反应中的抵抗机制,以减轻重金属对生物体的毒害作用.值得注意的是,抗生素药物在水环境中的浓度相对较低,通常不足以影响微生物的正常生命活动,但重金属污染却已非常普遍,而且呈现出日益加剧的趋势.重金属在活细菌体内的存在非常持久,尤其是在一些非生命体或是生命迹象消失的生物体中,因此能够产生长期的选择性压力[37].与此同时, ARGs通常位于细胞质粒和转座子上,而质粒和转座子在微生物种内甚至是种间的水平转移是人体病原微生物获得对抗生素药物抵抗性的重要途径[38].因此,重金属暴露对抗药性菌群的共选择压力在一定程度上会促进ARGs在人体病原微生物上的转移和传播,对生态环境和人体健康具有潜在的危害.
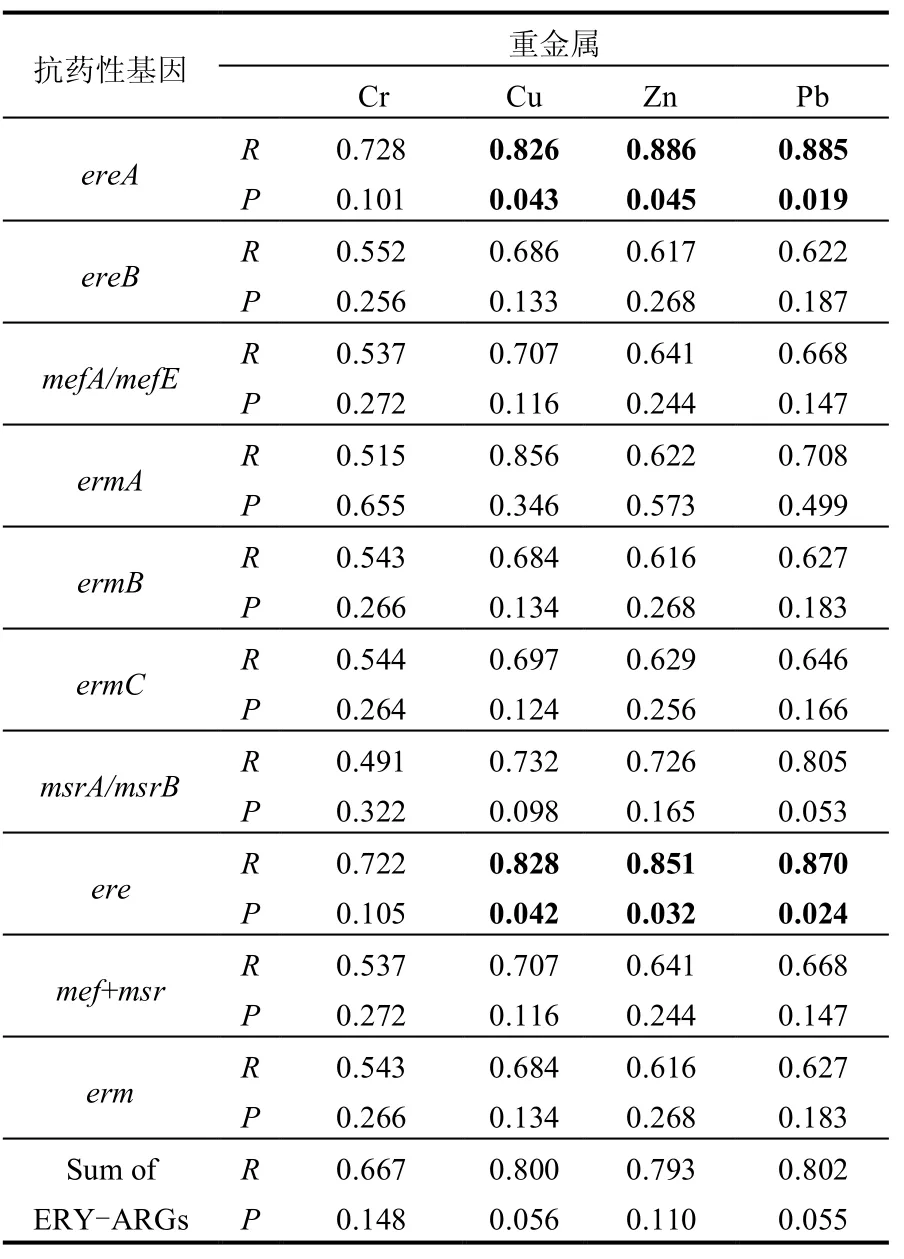
表4 检出重金属与ERY-ARGs之间相关性分析Table 4 Correlation analysis between concentrations of the detected heavy metals and ERY-ARGs
3 结论
3.1 抗生素药物SMX、ERY和TC在污水处理厂中均被检出,浓度范围分别为24.5~38.7,47.5~49.2和43.1~85.4ng/L.在污水中共检出Cr、Cu、Zn和Pb等4种重金属元素,浓度由高到低顺序为Pb>Cr>Zn>Cu.目标ERY-ARGs在污水处理厂中也均被检出,在原水中的浓度范围为9.28×103(ermA)~1.83×108(ereA)copies/L.
3.2 ERY与目标ERY-ARGs(除ermA)之间均具有显著相关性,与ERY-ARGs的总和之间也呈现出极高的显著相关性,表明ERY对ERY-ARGs的产生和散播具有重要影响.
3.3 酯酶基因ereA与重金属Cu、Zn和Pb之间呈现出较好的显著相关性,一定程度上表明重金属暴露可能对ERY-ARGs具有共选择性作用.
[1]Hsu J T, Chen C Y, Young C W, et al. Prevalence of sulfonamideresistant bacteria, resistance genes and integron-associated horizontal gene transfer in natural water bodies and soils adjacent to a swine feedlot in northern Taiwan [J]. Journal of Hazardous Materials, 2014,227:34-43.
[2]Livermore D. Can better prescribing turn the tide of resistance?[J]. Nature Reviews Microbiology, 2004,2(1):73-78.
[3]邰义萍,莫测辉,李彦文,等.长期施用粪肥土壤中喹诺酮类抗生素的含量和分布特征 [J]. 中国环境科学, 2010,30(6):816-821.
[4]Elmund G K, Morrison S M, Grant D W, et al. Role of excreted chlortetracycline in modifying the decomposition process in feedlot waste [J]. Bulletin of Environmental Contamination Toxicology, 1971,6(2):129-132.
[5]Auerbach E A, Seyfried E E, McMahon K D. Tetracycline resistance genes in activated sludge wastewater treatment plants[J]. Water Research, 2007,41(5):1143-1151.
[6]Wright M S, Peltier G L, Stepanauskas R, et al. Bacterial tolerances to metals and antibiotics in metal-contaminated and reference streams [J]. FEMS Microbiology Ecology, 2006,58(2):293-302.
[7]Beaber J W, Hochhut B, Waldor M K. SOS response promotes horizontal dissemination of antibiotic resistance genes [J]. Nature, 2003,427(6969):72-74.
[8]Li W, Shi Y, Gao L, et al. Occurrence, distribution and potential affecting factors of antibiotics in sewage sludge of wastewater treatment plants in China [J]. Science of the Total Environment, 2013,445:306-313.
[9]Jiang H, Zhang D, Xiao S, et al. Occurrence and sources of antibiotics and their metabolites in river water, WWTPs, and swine wastewater in Jiulongjiang River basin, south China [J]. Environmental Science and Pollution Research, 2013,20(12):9075-9083.
[10]Gao P, Ding Y, Li H, et al. Occurrence of pharmaceuticals in a municipal wastewater treatment plant: mass balance and removal processes [J]. Chemosphere, 2012,88(1):17-24.
[11]李凌凌,张部昌,马清钧.红霉素抗菌作用及细菌产生红霉素抗性的机制 [J]. 国外医药:抗生素分册, 2004,25(1):12-16.
[12]Fan C A, He J Z. Proliferation of antibiotic resistance genes in microbial consortia of sequencing batch reactors (SBRs) upon exposure to trace erythromycin or erythromycin-H2O [J]. Water Research, 2011,45(10):3098-3106.
[13]Amin M M, Zilles J L, Greiner J, et al. Influence of the antibiotic erythromycin on anaerobic treatment of a pharmaceutical wastewater [J]. Environmental Science and Technology, 2006, 40(12):3971-3977.
[14]Wright G D. Bacterial resistance to antibiotics: enzymatic degradation and modification [J]. Advanced Drug Delivery Reviews, 2005,57(10):1451-1470.
[15]EPA method 3015A. Microwave assisted acid digestion of aqueous samples and extracts. U.S. EPA, 1998.
[16]高利娟,刘善江,孙钦平,等.土壤样品重金属统一消解法的探讨[J]. 安徽农业科学, 2010,38(36):20693-20695.
[17]李侃竹,吴立乐,黄圣琳,等.污水处理厂中红霉素抗药性基因的污染特征及其选择性因子 [J]. 环境科学, 2014,35(17):175-181.
[18]Chang X, Meyer M T, Liu X, et al. Determination of antibiotics in sewage from hospitals, nursery and slaughter house, wastewater treatment plant and source water in Chongqing region of Three Gorge Reservoir in China [J]. Environmental Pollution, 2010, 158(5):1444-1450.
[19]Rosal R, Rodríguez A, Perdigón-Melón J A, et al. Occurrence of emerging pollutants in urban wastewater and their removal through biological treatment followed by ozonation [J]. Water Research, 2010,44(2):578-588.
[20]Karvelas M, Katsoyiannis A, Samara C. Occurrence and fate of heavy metals in the wastewater treatment process [J]. Chemosphere, 2003,53(10):1201-1210.
[21]Üstün G E. Occurrence and removal of metals in urban wastewater treatment plants [J]. Journal of Hazardous Materials, 2009,172(2):833-838.
[22]Neufeld R D, Hermann E R. Heavy metal removal by acclimated activated sludge [J]. Water Pollution Control Federation, 1975: 310-329.
[23]Da Silva Oliveira A, Bocio A, Trevilato T M B, et al. Heavy metals in untreated/treated urban effluent and sludge from a biological wastewater treatment plant [J]. Environmental Science and Pollution Research-International, 2007,14(7):483-489.
[24]Peak N, Knapp C W, Yang R K, et al. Abundance of six tetracycline resistance genes in wastewater lagoons at cattle feedlots with different antibiotic use strategies [J]. EnvironmentalMicrobiology, 2007,9(1):143-151.
[25]Tamminen M, Karkman A, Lõhmus A, et al. Tetracycline resistance genes persist at aquaculture farms in the absence of selection pressure [J]. Environmental Science and Technology, 2010,45(2):386-391.
[26]McKinney C W, Loftin K A, Meyer M T, et al. Tet and sul antibiotic resistance genes in livestock lagoons of various operation type, configuration, and antibiotic occurrence [J]. Environmental Science and Technology, 2010,44(16):6102-6109.
[27]Pruden A, Larsson D G J, Amézquita A, et al. Management options for reducing the release of antibiotics and antibiotic resistance genes to the environment [J]. Environmental Health Perspectives, 2013,121(8):878-885.
[28]Gao P, Munir M, Xagoraraki I. Correlation of tetracycline and sulfonamide antibiotics with corresponding resistance genes and resistant bacteria in a conventional municipal wastewater treatment plant [J]. Science of the Total Environment, 2012,421: 173-183.
[29]Chad, Keith, Michael, et al. tet and sul antibiotic resistance genes in livestock lagoons of various operation type, configuration, and antibiotic occurrence [J]. Environmental Science and Technology, 2010,44:6102-6109.
[30]Binh C T, Heuer H, Gomes N C, et al. Short-term effects of amoxicillin on bacterial communities in manured soil [J]. FEMS Microbiology Ecology, 2007,62:290-302.
[31]Wardwedd L H, Jude B A, Moody J P, et al. Co-selection of mercury and antibiotic resistance in sphagnum core samples dating back 2000years [J]. Geomicrobiol Journal, 2009,26:351-360.
[32]Ji X, Shen Q, Liu F, et al. Antibiotic resistance gene abundances associated with antibiotics and heavy metals in animal manures and agricultural soils adjacent to feedlots in Shanghai, China [J]. Journal of Hazardous Materials, 2012,235:178-185.
[33]Knapp C W, McCluskey S M, Singh B K, et al. Antibiotic resistance gene abundances correlate with metal and geochemical conditions in archived Scottish soils [J]. Plos One, 2011,6(11):e27300.
[34]Deredjian A, Colinon C, Brothier E, et al. Antibiotic and metal resistance among hospital and outdoor strains of Pseudomonas aeruginosa [J]. Research in Microbiology, 2011,162(7):689-700.
[35]McArthur J V, Tuckfield R C. Spatial patterns in antibiotic resistance among stream bacteria: effects of industrial pollution[J]. Applied and Environmental Microbiology, 2000,66(9):3722-3726.
[36]Stepanauskas R, Glenn T C, Jagoe C H, et al. Coselection for microbial resistance to metals and antibiotics in freshwater microcosms [J]. Environmental Microbiology, 2006,8(9):1510-1514.
[37]Kolpin D W, Furlong E T, Meyer M T, et al. Pharmaceuticals, hormones, and other organic wastewater contaminants in US streams, 1999-2000: A national reconnaissance [J]. Environmental Science and Technology, 2002,36(6):1202-1211.
[38]Wilson B A, Salyers A. Is the evolution of bacterial pathogens an out-of-body experience? [J]. Trends Microbial, 2003,11:347-350.
Selective pressure of antibiotics and heavy metals on erythromycin resistance genes in wastewater.
LI Kan-zhu1,GAO Pin1,2*, WANG Kai1, LIU Zhen-hong1,2, XUE Gang1,2(1.College of Environmental Science and Engineering,Donghua University, Shanghai 201620, China;2.State Environmental Protection Engineering Center for Pollution Treatment and Control in Textile Industry, Donghua University, Shanghai 201620, China). China Environmental Science,2015,35(3):889~896
Occurrence and distribution of six heavy metals and three antibiotics were investigated in a sewage treatment plant in Shanghai using inductively coupled plasma mass spectrometer (ICP-MS) and solid-phase extraction combined with high-performance liquid chromatograph tandem mass spectrometer (SPE-HPLC-MS/MS), respectively. Quantitative PCR (qPCR) was used to determine the distribution and removal of seven erythromycin resistance genes(ERY-ARGs) during the wastewater treatment process. The results showed that sulfamethoxazole (SMX), erythromycin(ERY) and tetracycline (TC) were detected, and their respective removal efficiency was low in the range from 3%(ERY) to 36% (TC). Heavy metals of Cr、Cu、Zn and Pb were detected with concentrations in the ranges of 136.9~235.5, 7.1~37.4, 18.1~98.4 and 143.1~383.0μg/L, respectively. Almost completely removal of Zn was found by the two-stage anoxic/oxic (A/O) process, while the elimination rates for Cu, Pb and Cr were 48%, 43% and 18%,respectively. Additionally, all ERY-ARGs were detected in the range between 9.28×103copies/L (ermA) and 1.83×108copies/L (ereA) in raw influent and were significantly reduced (1.19~3.97logs) in the wastewater treatment process. Based on the correlation analyses, the concentrations of ERY-ARGs exhibited significantly positive correlation (P<0.05) with ERY. Also, the concentration of ereA genes was strongly correlated with those of Cu, Zn and Pb (P<0.05), indicating that the presence of ERY played an important role in the evolution of ERY-ARGs, while heavy metals possibly exert selective pressures on the ERY-ARGs.
wastewater;antibiotic resistance gene;antibiotic;heavy metal;selective pressure
X52,R944.6
A
1000-6923(2015)03-0889-08
李侃竹(1990-),女,湖南株洲人,上海东华大学环境工程专业硕士研究生,主要从事水质安全与环境健康研究.
2014-07-10
国家自然科学基金项目(51208086,51178093);上海市浦江人才计划项目(13PJ1400100);中央高校基本科研业务费专项(14D111312);东华大学"励志计划"项目(14D211301)
* 责任作者, 副教授, pingao@dhu.edu.cn
