鄱阳湖水体悬浮物反硝化潜力模拟研究
2015-11-18姚晓龙徐会显唐陈杰中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室江苏南京210008中国科学院大学北京100049
姚晓龙,徐会显,唐陈杰,张 路(1.中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,江苏 南京 210008;2.中国科学院大学,北京 100049)
鄱阳湖水体悬浮物反硝化潜力模拟研究
姚晓龙1,2,徐会显1,2,唐陈杰1,2,张 路1*(1.中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,江苏 南京 210008;2.中国科学院大学,北京 100049)
以鄱阳湖为对象,采用乙炔抑制法,分别模拟了厌氧和好氧状态下的悬浮物反硝化潜力和过程,结果表明,厌氧和好氧状态下水体悬浮物均能够产生明显的反硝化作用.受乙炔抑制,其反硝化产物N2O的浓度累积随时间呈“慢-快-慢”的节律,浓度累积曲线符合逻辑斯谛模型(P<0.01).拟合结果显示:悬浮物浓度为30g/L时,厌氧培养条件下快增期反硝化速率达到(81.76±10.37)μmolN/(L·d),好氧环境下为(14.12±2.31)μmolN/(L·d).CO2浓度累积曲线同样符合逻辑斯谛模型,但好氧条件下CO2浓度累积极值较高,约为厌氧条件下的5倍,表明好氧条件下好氧呼吸占更大的比例.水体悬浮物反硝化潜力与悬浮物浓度有关,相同悬浮物浓度下,好氧培养水体悬浮物反硝化潜力较厌氧培养弱,且达到累积极值的时间更长,水体溶解氧一定程度上抑制了悬浮物反硝化作用.依据好氧培养的试验结果,估算得到鄱阳湖悬浮物全年反硝化导致的氮素净损失为1010t,约占鄱阳湖氮素年输入量的0.74%和鄱阳湖沉积物反硝化氮去除量的14%,鄱阳湖水体悬浮物反硝化在氮素净去除中起到一定作用.
鄱阳湖;悬浮物;反硝化;潜力
悬浮物含有其他水中溶解态物质难以凸现的环境和地球化学信息[9-10],悬浮物浓度较高的水体中,大多数的水体细菌产量和有机质矿化可能由吸附在悬浮物颗粒物表面的细菌造成[11-13],其他微生物介导的氧化还原反应也与悬浮颗粒物有关[13].悬浮颗粒物粒径大至约1mm,通常并非理想的球体,在受扰动的条件下会发生悬浮、絮凝、破碎等过程[14].由此可见,悬浮物颗粒中可能含有大量的利于反硝化的生物膜和厌氧微环境.悬浮物(颗粒污泥)反硝化在一些污水处理系统中已经得到一定应用[15-17].
鄱阳湖作为通江湖泊,受长江、挖沙影响巨大,悬浮物时空差异显著,特别是入江水道及采砂区悬浮物浓度远高于开敞湖区.由于悬浮物与表层沉积物具有同源和同质性,本研究采用鄱阳湖表层沉积物再悬浮,通过模拟厌氧和好氧两种条件,对悬浮物的反硝化过程,及伴生的矿化过程进行动力学分析.同时,估算了鄱阳湖水体悬浮物反硝化对湖泊脱氮的贡献.
1 材料与方法
1.1 研究对象
鄱阳湖年水位变化巨大,低水位9m标高时面积为216.62km2,而高水位20m标高时面积为3218.29km2,导致了“汛期一片,枯水一线”鄱阳湖独特的地学地貌环境景观[18].
鄱阳湖泥沙主要来自赣江,多年平均来水量和来沙量分别占“五河”总来水量和来沙量的56.1%和62.8%;其次为信江,占14.4%和13.2%[19].受输沙和挖沙影响,鄱阳湖水体悬浮物含量可高达3g/L,低可至0.006g/L,年平均值约为0.1g/L,并呈现明显的冬春季高于夏秋季,尾闾区高于主湖区的典型特点.

图1 鄱阳湖采样点位置Fig.1 The sampling location in Poyang Lake
1.2 样品采集
样品采集于枯水期的2013年12月和2014年1月.采样点位于中国科学院鄱阳湖湿地生态观测站附近出露洲滩(图1),样点经纬度为北纬29°26'46.03",东经116°03'11.83".由于水体悬浮物主要由表层砂性沉积物的再悬浮导致,本试验采集表层沉积物模拟悬浮沉积物.表层沉积物样品使用1/16m2彼得森采泥器采集,并用聚乙烯自封袋保存于4℃冰箱中.在采样点现场用便携式多参数水质分析仪(YSI)测定并记录常规水质参数.上覆水样品使用有机玻璃采水器于表层以下50cm处采集,密封保存于10L聚乙烯瓶,静置48h,上层清水作为培养用水.
1.3 室内培养
室内培养均采用经典的乙炔抑制法,结合批次培养法和带顶空的密封血清瓶进行模拟.为探讨鄱阳湖悬浮物的反硝化潜力,对2013年12月采集的沉积物样品设置了2组不同处理的模拟方法(悬浮物浓度均为30g/L).一组为厌氧条件下的反硝化潜力模拟,另一组为好氧条件下的模拟培养.通过厌氧培养组的模拟,讨论鄱阳湖悬浮物是否存在反硝化的物质基础(包括碳源条件和反硝化微生物),同时揭示反硝化过程中呼吸的过程特征;通过对好氧组的培养,进一步模拟鄱阳湖水体及悬浮物的物理化学环境,讨论好氧水体和厌氧水体中悬浮物反硝化过程差异,并利用好氧水体的悬浮物反硝化培养估算鄱阳湖水体悬浮物全年反硝化导致的氮素净去除量.进一步地,为探究悬浮物反硝化培养中溶解氧、、C2H2、C2H4等变化以及悬浮物浓度对反硝化的影响,对2014年1月再次采集的沉积物样品设置5g/L好氧培养组,并重新设置了培养装置.
1.3.1 高浓度悬浮物厌氧和好氧培养(SPS= 30g/L) 称取均质化新鲜沉积物4.5g(2013年12月采集)于300mL玻璃血清瓶中,加入150mL湖水,高纯He(99.999%)曝气15min,加丁基橡胶塞密封.通过向橡胶塞上插入两根针头,向顶空内曝He气5min.用50mL注射器抽取30mL顶空气体,向水体注入 30mL乙炔(萤石制备,经硫酸铜溶液净化),使顶空气体与大气压平衡,使用气相色谱仪测定N2O,CH4,CO2初始分压值.用注射器向盐水瓶内加入1.5mL500mg/LNaNO3,水平放置于震荡器中以恒定速率震荡,恒温25℃培养.试验中所用玻璃血清瓶和橡胶塞在培养前经高压灭菌锅灭菌,培养设置3个平行.按预定培养时间使用1mL色谱注射器取样,直接用气相色谱仪测定.
好氧培养组的培养和取样方法同厌氧培养,湖水与顶空不经He曝气.冬季湖水溶解氧接近饱和,培养设置3个平行.
1.3.2 低浓度悬浮物好氧培养(SPS=5g/L) 培养装置采用1.15L锥形瓶,称取3g鲜沉积物(2014年1月采集)于锥形瓶中,加湖水600mL(顶空体积550mL).使用气密橡胶塞密封,橡胶塞上打有两个孔,分别插入一长一短两根塑料导管,分别用来取水样和气样.培养前塞好橡胶塞,取水导管出口插有三通,取气导管用橡胶隔垫堵住并能够用气密注射器针头插入取气样.加塞,用100mL注射器抽取100mL顶空气体,并将 100mL C2H2注入水体(C2H2约占顶空体积的18%).培养设置3个平行,其中一个锥形瓶的橡胶塞多打一个孔,插有溶解氧电极,用来测定培养过程中溶解氧变化.橡胶塞与锥形瓶、导管与孔洞、三通与导管等的衔接处涂硅胶密封,防止漏气.试验中培养装置经过高压灭菌锅灭菌.通过取水导管向锥形瓶内注入6mL 500mg/LNaNO3,恒温25℃震荡培养.
每隔24h取气样和水样,气样使用双向针头自取气导管采集于14mL玻璃真空瓶内,水样用注射器自取水导管采集6mL于洗净的14mL玻璃瓶.取样前向顶空内注入20mL高纯He(99.999%),使瓶内总气压保持与大气压平衡.
1.4 气体测定
气体测定采用气相色谱法.N2O、CH4和CO2使用岛津公司(Shimadzu) GC-2014C型气相色谱仪测定.载气为高纯N2(99.999%),进样口温度60℃,柱温60℃,附加加热器温度350℃.火焰离子化检测器(FID)温度为200℃,燃气为H2(99.99%),助燃气为空气,尾吹气为H2(99.99%);电子捕获检测器(ECD)温度为200℃,尾吹气为CH4-Ar(CH4浓度为5%,V/V).N2O与CH4、CO2在不同的通道被检测.CH4、CO2经 80/100Porpack-Q(1.0m)填充柱分离后,被FID检测器检测.N2O经80/100Hayesep-D(1.0m)柱分离,被ECD检测器检测(200℃).测定时用1mL气密注射器直接在培养装置内取样,记录N2O、CH4和CO2的物质的量分数值.
C2H4和C2H2使用上海天美科学仪器有限公司的GC7890II型气相色谱仪测定,色谱柱为不锈钢填充柱Porapak N(3.0m),检测器使用氢火焰离子化(FID).载气为高纯N2(99.999%),燃气为H2(99.99%),助燃气为空气.柱温60℃,进样口温度80℃,检测器温度200℃.气体样品使用500μL色谱注射器进样100μL测定,记录C2H4和C2H2峰高与峰面积信号值.用高纯C2H2和高纯He制作标准气样,通过标样的分压值与峰面积信号值得到分压值与峰面积的换算系数,计算得到气样中 C2H4和C2H2的物质的量分数值(×10-6).
1.5 无机营养盐测定
依据《湖泊富营养化调查规范》[20]测定预定培养时间(SPS=5g/L)水体、、浓度.采用紫外分光光度法采用α-萘胺比色法采用纳氏比色法.方法检测限为0.04mg/L、为0.001mg/L、为0.05mg/L.
1.6 气体浓度的计算
1.6.1 顶空气体浓度的计算 将顶空内气体视为理想气体,顶空气体组分浓度由Dalton分压定律计算:

式中:PG为体系内某气体组分的分压值,Pa;nG为该气体组分的物质的量,mol;R为理想气体常数,8.314×103Pa·L/(mol·K),T表示体系内的热力学温度,K;VT为气体总体积,L;cG为最终要求得的该气体组分的浓度,μmol/L;fG为该气体组分的物质的量分数,气相色谱测定得到,单位×10-6;P为体系内气压值,Pa.
1.6.2 培养体系内水体溶存气体浓度计算 假设培养装置内顶空气体与水体达到溶解平衡,培养体系内水体溶存气体的浓度根据改善后的Weiss气体溶解度公式计算,顶空内总压强认为是1atm,N2O 和CO2浓度参照Weiss 等[21]计算,CH4浓度参照Wiesenburg等[22]计算.N2O 和CO2浓度计算公式为:
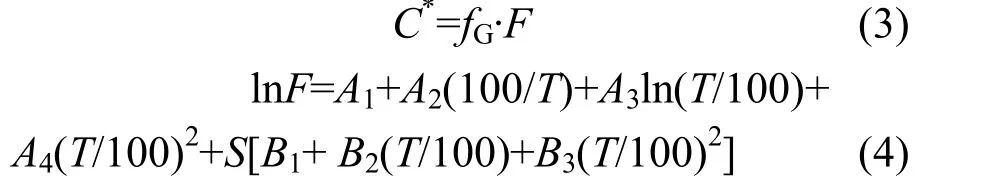
CH4浓度计算公式为:

其中,C*为培养体系内水体溶存气体浓度,N2O和CO2浓度单位为μmol/L,CH4浓度单位为nmol/L;fG为该气体组分的物质的量分数,气相色谱测定得到,单位×10-6;F为换算系数,相当于溶解度系数,mol/(L·atm);T为体系内的热力学温度,K;S为水体盐度,‰.A1、A2、A3、A4、B1、B2、B3为常数,本试验中计算所用常数见表1[21-22].

表1 水体溶存N2O、CH4和CO2浓度计算中用到的常数[21-22]Table 1 Constants for the calculation of dissolved N2O、CH4and CO2concentrations in water column[21-22]
1.6.3 培养体系气体累积浓度计算 培养产生的气体包括水体溶存的及顶空内的N2O、CH4和CO2,换算为水体累积浓度CT(μmol/L)为:

式中:CH和CW分别为顶空和水体内某气体组分浓度(nmol/L或μmol/L);VH和VW分别为顶空和水体体积(L).
1.7 数据处理
采用Excel2013和SPSS20.0进行数据分析,并使用origin8.5作图.对试验中的N2O和CO2数据使用origin8.5内置函数Logistic进行曲线拟合和方差分析,方程为:
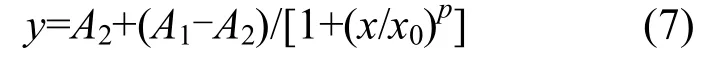
式中:x表示培养时间;y表示N2O或CO2气体浓度(μmol/L),A1、A2、x0、p为参数,A2为增长的极限值.曲线增长速率最大值点(二阶导数为零的点)横坐标x1=x0·[(p-1)/(p+1)]1/p,纵坐标y1= A1·[(p+1)+A2(p-1)]/(2p).
2 结果与分析
2.1 反硝化过程中乙炔抑制剂的变化
Jensen等[23]研究表明,大于70μmol/L的乙炔浓度能够抑制N2O向N2还原,抑制率为95%,而该浓度下乙炔还能同时抑制硝化过程和厌氧氨氧化过程.虽然乙炔抑制法对N2O的不完全抑制和对硝化作用的抑制造成对反硝化作用的低估[24],但该方法简单灵敏,具有快速、价格低廉等优点,并能够尽量保持体系原位状态[25-27].
本试验中,悬浮物浓度为5g/L时,如图2所示,顶空内C2H4和C2H2含量在培养开始的前2d波动较大,可能为向顶空内注入C2H2后,C2H4和C2H2与水体达到溶解平衡的过程.C2H2浓度在第2d后与培养时间显著相关(r=-0.825,P<0.01).而C2H4与培养时间不相关(r=0.430,P>0.05).第2~10d顶空内C2H2下降了(0.84±0.50)mmol/L,剩余C2H2浓度为2.31mmol/L (顶空中体积百分比为13%),换算为水体溶存浓度后远大于乙炔抑制反硝化的浓度阈值70μmol/L,C2H2仍可以充分抑制N2O向N2的转化.

图2 顶空内C2H2和C2H4含量随时间变化Fig.2 Concentrations of C2H2and C2H4over incubation time

图3 顶空内C2H2和C2H4的相关性Fig.3 Correlationship of concentrations between C2H2and C2H4
C2H2与C2H4的相关分析表明(图3),二者具有一定的相关性(r=0.634,P<0.05),但培养期间C2H2的减少量与C2H4增加量(以培养开始后第2d计)上相差较大,且C2H4浓度随时间降低,表明大部分减少的C2H2未被还原为 C2H4,可能大部分被作为了微生物呼吸过程的碳源.
2.2 厌氧体系中悬浮物反硝化潜力

图4 厌氧环境下N2O、CO2和CH4累积浓度随时间变化(SPS=30g/L)Fig.4 Cumulative concentrations of N2O、CO2and CH4over time under anoxic conditions (SPS=30g/L)
对高浓度悬浮物(SPS=30g/L)进行厌氧培养时,N2O累积浓度随时间呈现“慢-快-慢”的节律(图4(a)).
培养体系内产生的N2O经过约4d的渐增期后出现剧烈增长,短时间内达到极值.曲线拟合符合逻辑斯谛模型(P<0.01),约在第4.54d出现速率最大值(表2).快增期的第3.9~5.5d N2O浓度累积曲线符合线性模型(r=0.986,P<0.01),反硝化速率达到(81.76±10.37)μmolN/(L·d),培养体系内N2O累积浓度极值为80.34μmol/L.
当向厌氧环境中添加足量的硝酸盐时,微生物进行厌氧呼吸的电子受体主要为硝酸根,而非硫酸根等其他电子受体.在硝酸盐还原,产生中间产物N2O的同时,也伴随有机质的氧化,并产生CO2.因此,在乙炔抑制体系中,CO2的产生速率往往和N2O具有一定的化学计量关系.事实上,在厌氧培养体系中CO2浓度随时间的变化趋势的确具有与N2O类似的规律(图4(b)),其浓度变化曲线同样符合逻辑斯谛模型(P<0.01). 快增期出现的时间和持续时间与N2O很接近,约为第3.9~5.5d (直线拟合r=0.906,P<0.01),此时间内生成速率为(194.62±34.23)μmolC/(L·d),增长的极限值为656.50μmol/L,约为N2O累积浓度极值的8倍.
培养体系内CH4浓度与培养时间不相关(图4(c),r=0.572,P>0.05),说明培养过程中没有出现明显的有机质发酵和产甲烷过程,体系内CH4浓度平均值为(29.95±2.91)nmol/L.
2.3 好氧环境中悬浮物的反硝化
好氧环境下,高浓度悬浮物水体(SPS= 30g/L)N2O累积浓度随时间变化也呈“慢-快-慢”的节律(图5(a)),曲线拟合同样符合逻辑斯谛模型(P<0.01),但反硝化经历的快增期较长(第3.4~7.4d),并且符合线性模型(r=0.996,P<0.01),其斜率即快增期反硝化速率为(14.12± 2.31)μmolN/(L·d),N2O累积浓度极值为66.61μmol/L.溶解氧饱和度从培养初期的过饱和下降至25%.
好氧体系内CO2累积浓度随时间变化呈现与N2O相同的趋势(图5(b)),曲线拟合符合逻辑斯谛模型(P<0.01),曲线拐点几乎与N2O在相同时间出现.将快增期(第3.4~7.4d)拟合为一条直线(r=0.998,P<0.01),CO2浓度累积速率约为(473.85±137.40)μmolN/(L·d).逻辑斯谛模型拟合得到的累积浓度极值为3182.28μmol/L.
在约11d的培养时间内,体系CH4平均浓度为(143.38±2.31)nmol/L,并且与培养时间相关,CH4浓度出现一定增长(图5(c),r=0.640,P<0.05).培养过程中可能出现微弱的有机质发酵和产甲烷过程.体系CH4平均浓度高于厌氧培养组CH4浓度均值(29.95±2.91)nmol/L.

图5 好氧环境下N2O、CO2和CH4累积浓度随时间变化(SPS=30g/L)Fig.5 Concentrations of N2O over time under oxic conditions (SPS=30g/L)
2.4 悬浮物反硝化过程中水体无机氮变化
悬浮物浓度为5g/L时培养水体内N2O累积浓度曲线与30g/L相似(图6).
快增期 (第3~7d,直线拟合r=0.973,P<0.01)反硝化速率为(0.74±0.18)μmolN/(L·d),逻辑斯谛模型拟合(P<0.01)得到的累积浓度极值为2.45μmol/L.悬浮物体系溶解氧饱和度由培养前的111.3%下降至53.7%.

图6 好氧环境下N2O浓度随时间变化(SPS=5g/L)Fig.6 Concentrations of N2O over time under oxic conditions
体系内前期沉积物与水体混合时无机氮可能存在较强的源-汇效应,或存在较强的同化吸收、硝化等作用,而一些异养微生物活性较低,仍处于调整期,导致前2d浓度增加浓度降低.培养进入第3d,体系有机物分解生成的多于同化吸收等过程对的消耗含量出现增加趋势(第3~5d).随着底物不断消耗,有机物分解生成的又逐渐小于微生物同化、硝化等过程对的消耗含量出现降低趋势(第5~7d).含量的这一拐点发生时间(约第5d)与N2O生成速率极大值出现的时间非常接近.

图7 培养体系内无机氮随培养时间变化Fig.7 Concentrationss of inorganic nitrogen in the system under oxic conditions
3 讨论
3.1 厌氧环境与好氧环境下水体悬浮物反硝化差异
各种不同培养条件下N2O和CO2拟合公式及参数见表2.依据拟合结果,相同悬浮物浓度下(SPS=30g/L),封闭好氧环境N2O 累积浓度经历快增期较长,达到最大生成速率的时间为5.3d左右,而厌氧培养在4.5d左右(特征点横坐标值x1).好氧环境下,N2O 快增期累积速率较低(14.12± 2.31)μmolN/(L·d),约为厌氧环境的六分之一.N2O累积浓度极值出现时间也比厌氧环境长,数值比厌氧环境低(参数A2值,约为厌氧环境极限值的80%).这些参数证明厌氧条件下更有利于悬浮物反硝化的进行,溶解氧的存在一定程度上限制了反硝化作用.由于反硝化是厌氧过程,溶解氧对反硝化速率的影响剧烈[5,27],在土壤中,反硝化细菌只有在氧气浓度低于0.2μmol/mL时,才会转向厌氧呼吸,用作为电子受体[27-28].
封闭体系好氧环境下CO2各拐点出现时间均与N2O非常接近,例如生成速率最大的时间x1与N2O 相似,CO2累积浓度经历快增期较长,达到最大生成速率的时间和极值出现时间均比厌氧培养迟.CO2好氧环境达到的极限值比厌氧环境高,约为厌氧培养的5倍,表明好氧培养组好氧呼吸作用占更大的比例.
3.2 封闭好氧环境下悬浮物浓度对反硝化影响
好氧条件下,悬浮物浓度为5g/L时快增期反硝化速率为(0.74±0.18)μmolN/(L·d),N2O累积浓度极值为2.45μmol/L.悬浮物浓度为30g/L时,反硝化速率达到(14.12±2.31)μmolN/(L·d),约为5g/L时的19倍,N2O累积浓度极值约为5g/L时的27倍.比较悬浮物浓度为30g/L培养组和5g/L培养组溶解氧消耗可以得出,悬浮物浓度越低时,水体溶解氧消耗越少.水体悬浮物浓度为0g/L时,反硝化速率很低[8],若以0μmolN/(L·d)计,对悬浮物浓度(SPS=0,5,30g/L)与反硝化速率进行相关性分析,悬浮物浓度与反硝化速率未表现出显著的相关性(r=0.994, P>0.05).
在对鄱阳湖其他区域的沉积物进行反硝化模拟试验时,设置了系列浓度梯度的悬浮物的好氧培养,并采用与30g/L培养组相同的试验方法,结果表明悬浮物浓度与N2O累积速率显著相关(r=0.996,P<0.001,数据未显示),Liu等[8]的试验也得出悬浮物反硝化速率与悬浮物浓度相关的结论,悬浮物浓度越高,其内部存在的厌氧微位点可能越多.本试验中5g/L悬浮物培养组目的在于分析培养体系溶解氧、无机氮、乙烯、乙炔等变化,与30g/L培养组沉积物在不同时间采集,悬浮物浓度与反硝化速率未表现出相关性可能由于沉积物性质的时空差异导致反硝化速率存在差异.

表2 不同培养条件下N2O和 CO2逻辑斯谛模型拟合参数Table 2 Fitting parameters of N2O and CO2obtained by logistic model under different incubation conditions
3.3 鄱阳湖水体悬浮物反硝化氮素去除量估算
为估算鄱阳湖水体悬浮物反硝化脱氮量,将悬浮物浓度为0g/L时的反硝化速率视为0μmolN/(L·d),根据直接取样测定的30g/L培养组反硝化速率(14.12±2.31)μmolN/(L·d),得到单位浓度(1g/L)悬浮物对应反硝化速率为0.471μmolN/(L·d).同时,依据鄱阳湖4个季度悬浮物浓度平均值,计算得到四个季度反硝化速率分别为92.8,14.2,39.3,44.7nmolN/(L·d).鄱阳湖月平均水位以及湖体容积与水位的关系参考张本等[29],估算得到鄱阳湖平均1a悬浮物反硝化脱氮量为1010t(表3).结合唐陈杰等[30]对鄱阳湖3种类型湿地沉积物反硝化空间差异的研究,依据其3种类型湿地沉积物的反硝化速率均值(30.93μmol/(m2·h))和鄱阳湖不同季节平均湖水面积估算出鄱阳湖沉积物导致的年脱氮量约为7125t.鄱阳湖全年悬浮物反硝化氮去除量约为沉积物反硝化氮素去除量的14%.鄱阳湖氮素年输入量约为13.6万t[31],悬浮物反硝化年去除氮素约占总输入量的0.74%.鄱阳湖水体悬浮物的结构、组成、浓度等悬浮物本身性质存在时空差异,同时,鄱阳湖水温、水体硝酸盐负荷和水动力等也呈现显著的时空变化,因此,鄱阳湖悬浮物的反硝化速率同样存在时空异质性.另外,估算采用模拟的结果,好氧和厌氧培养组均添加了硝酸盐,可能对结果造成高估,因此,本结果仅仅是粗略的估算,但结果仍暗示鄱阳湖水体悬浮物反硝化在鄱阳湖氮素净去除中可能起到一定的作用.
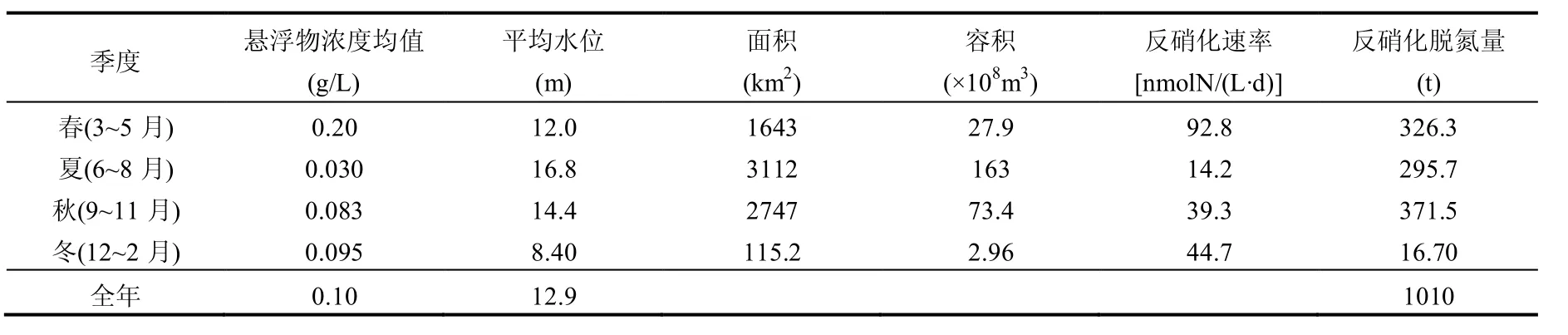
表3 鄱阳湖水体悬浮物反硝化脱氮量估算Table 3 Estimation of nitrogen removal by denitrification of SPS in Poyang Lake
4 结论
4.1 厌氧与好氧环境下的水体悬浮物均可以产生反硝化作用,反硝化动力学均符合逻辑斯谛模型,且反硝化产物N2O和呼吸作用产物CO2的累积浓度都随培养时间呈现“慢-快-慢”的变化特征.
4.2 相同悬浮物浓度下,好氧培养与厌氧培养相比,N2O累积浓度达到极限值的时间更长,且累积浓度极值较低.悬浮物浓度为30g/L时,厌氧培养快增期反硝化速率达到(81.76± 10.37)μmolN/(L·d),而好氧环境下快增期反硝化速率为(14.12±2.31)μmolN/(L·d).悬浮物浓度为5g/L时,反硝化速率低至(0.74±0.18)μmolN/(L·d),培养体系内乙炔浓度随时间缓慢降低,但培养结束时仍能充分抑制N2O向N2还原.
4.3 根据出露洲滩沉积物模拟的反硝化试验好氧培养组(30g/L) 快增期反硝化速率,估算出鄱阳湖水体悬浮物全年反硝化氮去除量约为1010t,占鄱阳湖氮素年输入量的0.74%和沉积物反硝化氮去除量的14%,表明鄱阳湖水体悬浮物反硝化可能在反硝化脱氮中起到一定的作用.
[1]Finlay J C, Small G E, Sterner R W. Human Influences on Nitrogen Removal in Lakes [J]. Science, 2013,342,(6155):247-250.
[2]Ward B B, Devol A H, Rich J J, et al. Denitrification as the dominant nitrogen loss process in the Arabian Sea [J]. Nature,2009,461,(7260):78-U77.
[3]Nielsen L P, Christensen P B, Revsbech N P, et al. Denitrification and oxygen respiration in biofilms studied with a microsensor for nitrous oxide and oxygen [J]. Microbial Ecology, 1990,19(1):63-72.
[4]Nielsen L P, Christensen P B, Revsbech N P, et al. Denitrification and photosynthesis in stream sediment studied with microsensor and whole-core techniques [J]. Limnol. Oceanogr, 1990,35(5):1135-1144.
[5]Christensen P B, Nielsen L P, Revsbech N P, et al. Microzonation of denitrification activity in stream sediments as studied with a combined oxygen and nitrous oxide microsensor [J]. Applied and Environmental Microbiology, 1989,55(5):1234-1241.
[6]Christensen P B, Nielsen L P, Sørensen J, et al. Denitrification in nitrate-rich streams: diurnal and seasonal variation related to benthic oxygen metabolism [J]. Limnol. Oceanogr, 1990,35(3):640-651.
[7]Andersen T, Jensen M, Sørensen J. Diurnal variation of nitrogen cycling in coastal, marine sediments [J]. Marine Biology, 1984,83(2):171-176.
[8]Liu T, Xia X, Liu S, et al. Acceleration of Denitrification in Turbid Rivers Due to Denitrification Occurring on Suspended Sediment in Oxic Waters [J]. Environmental Science and technology, 2013,47(9):4053-4061.
[9]王书航,姜 霞,王雯雯,等.蠡湖水体悬浮物的时空变化及其影响因素 [J]. 中国环境科学, 2014,34(6):1548-1555.
[10]秦伯强,范成新.大型浅水湖泊内源营养盐释放的概念性模式探讨 [J]. 中国环境科学, 2002,22(2):55-58.
[11]Crump B C, Baross J A. Particle-attached bacteria and heterotrophic plankton associated with the Columbia River estuarine turbidity maxima [J]. Marine Ecology Progress Series,1996,138(1):265-273.
[12]Crump B C, Baross J A, Simenstad C A. Dominance of particle-attached bacteria in the Columbia River estuary, USA [J]. Aquat. Microb. Ecol., 1998,14(1):7-18.
[13]Garneau M-È, Vincent W F, Terrado R, et al. Importance of particle-associated bacterial heterotrophy in a coastal Arctic ecosystem [J]. Journal of Marine Systems, 2009,75(1):185-197.
[14]张 彬,李 涛,刘会娟,等.模拟扰动条件下太湖水体悬浮物的结构特性 [J]. 环境科学, 2007,28(1):70-74.
[15]闫玉洁,张 建,贾文林,等.同步硝化反硝化过程中污染物的去除及温室气体的释放 [J]. 中国环境科学, 2012,22(11):1979-1983.
[16]蔡 庆,张代钧,丁佳佳.全自养脱氮颗粒污泥的培养及脱氮性能的恢复与强化 [J]. 中国环境科学, 2014,34(11):2805-2812.
[17]杨姣玲,高大文,彭永臻.温度对颗粒污泥脱氮过程中N2O产生量的影响 [J]. 中国环境科学, 2010,30(12):1622-1626.
[18]马逸麟,熊彩云,易文萍.鄱阳湖泥沙淤积特征及发展趋势 [J].资源调查与环境, 2003,(1):29-37.
[19]陈晓玲,吴忠宜,田礼乔,等.水体悬浮泥沙动态监测的遥感反演模型对比分析—以鄱阳湖为例 [J]. 科技导报, 2007,(6):19-22.
[20]金相灿,屠清瑛.湖泊富营养化调查规范 [M]. 北京:中国环境科学出版社, 1990.
[21]Weiss R, Price B. Nitrous oxide solubility in water and seawater[J]. Marine Chemistry, 1980,8(4):347-359.
[22]Wiesenburg D A, Guinasso Jr N L. Equilibrium solubilities of methane, carbon monoxide, and hydrogen in water and sea water[J]. Journal of Chemical and Engineering Data, 1979,24(4):356-360.
[23]Jensen M M, Thamdrup B, Dalsgaard T. Effects of specific inhibitors on anammox and denitrification in marine sediments [J]. Applied and environmental microbiology, 2007,73(10):3151-3158.
[24]Mengis M, GÄCHTER R, Wehrli B, et al. Nitrogen elimination in two deep eutrophic lakes [J]. Limnol. Oceanogr., 1997,42(7):1530-1543.
[25]Yoshinari T, Hynes R, Knowles R. Acetylene inhibition of nitrous oxide reduction and measurement of denitrification and nitrogen fixation in soil [J]. Soil Biology and Biochemistry, 1977,9(3):177-183.
[26]Seitzinger S P, Nielsen L P, Caffrey J, et al. Denitrification measurements in aquatic sediments: a comparison of three methods [J]. Biogeochemistry, 1993,23(3):147-167.
[27]王东启.长江口滨岸潮滩沉积物反硝化作用及N2O的排放和吸收 [D]. 上海:华东师范大学, 2006.
[28]Martin T L. Kaushik N, Trevors J, et al. Review: denitrification in temperate climate riparian zones. Water, Air, and Soil Pollution,1999,111,(1-4):171-186.
[29]张 本.鄱阳湖一些水文特征和整治战略 [J]. 长江流域资源与环境, 1993,(1):36-42.
[30]唐陈杰,张 路,杜应旸,等.鄱阳湖湿地沉积物反硝化空间差异及其影响因素研究 [J]. 环境科学学报, 2014,(1):202-209.
[31]刘元波,张 奇,刘 健,等.鄱阳湖流域气候水文过程及水环境效应 [M]. 科学出版社, 2012.
Denitrification potential of high suspend sediments in Poyang Lake, China.
YAO Xiao-long1,2, XU Hui-xian1,2,TANG Chen-jie1,2, ZHANG Lu1*(1.State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, China;2.University of Chinese Academy of Sciences, Beijing 100049, China). China Environmental Science, 2015,35(3):846~855
The denitrification potential of high suspend sediments (SPS) in Poyang Lake under aerobic and anaerobic conditions were performed using acetylene inhibition method. The results reflected that denitrification of SPS was found under both aerobic and anaerobic conditions, and the cumulative concentration of N2O showed “slow-fast-slow” rhythm along with incubation time, which satisfied the logistic model (P<0.01). The fitting results with SPS concentration of 30g/L showed that denitrification rate reached up to (81.76±10.37)μmolN/(L·d) during anaerobic incubation while the value was (14.12±2.31)μmolN/(L·d) under aerobic incubation. In addition, the cumulative concentration of CO2also accorded with the logistic model. The extreme value of CO2under oxic conditions, which was 5times higher than the value under anoxic conditions, indicated high proportion of aerobic respiration under oxic conditions. The denitrification potential was affected by the concentration of SPS. Under the same SPS concentration, weaker denitrification potential of SPS and longer time to reach extreme value of N2O under aerobic condition implied the possible inhibition of denitrification by dissolved oxygen (DO). Full-year nitrogen loss caused by SPS denitrification in Poyang Lake was estimated to be 1010t, which accounted for about 0.74% of the nitrogen input and 14% of nitrogen removal caused by bed-sediments. These estimations indicated that SPS would play an important role in nitrogen removal from waters.
Poyang Lake;suspended sediments;denitrification;potential
X524
A
1000-6923(2015)03-0846-10
姚晓龙(1988-),男,河北保定人,中国科学院南京地理与湖泊研究所硕士研究生,主要从事湖泊环境化学研究.
2014-06-26
国家重点基础研究发展计划(2012CB417005);国家自然科学基金项目(41271468,41203065)
* 责任作者, 副研究员, luzhang@niglas.ac.cn
