高效耐海水型厌氧氨氧化污泥的驯化
2015-11-18李智行陈晓波大连海洋大学海洋科技与环境学院辽宁大连603大连市市政设计研究院有限责任公司辽宁大连60
李智行,张 蕾*,陈晓波,李 航,李 旦(.大连海洋大学海洋科技与环境学院,辽宁 大连 603;.大连市市政设计研究院有限责任公司,辽宁 大连 60)
高效耐海水型厌氧氨氧化污泥的驯化
李智行1,张 蕾1*,陈晓波2,李 航1,李 旦1(1.大连海洋大学海洋科技与环境学院,辽宁 大连 116023;2.大连市市政设计研究院有限责任公司,辽宁 大连 116021)
针对部分含海水废水生物脱氮效能较低的问题,研究了梯度盐度海水对淡水厌氧氨氧化污泥的驯化过程.考察了不同海水盐度对厌氧氨氧化反应动力学、厌氧氨氧化菌细胞形态和反应器中菌群变化的影响.结果表明,梯度盐度废水可以成功驯化淡水厌氧氨氧化污泥,通过145d的驯化,其总氮去除速率为2.80kgN/(m3·d).在海水盐度由0提高至10‰、20‰和30‰的过程中厌氧氨氧化反应速率经历了升高、降低、再升高的过程,其中,海水盐度20‰在淡水厌氧氨氧化污泥的驯化过程中是一个临界点.驯化后,厌氧氨氧化菌细胞结构更加不规则,并在细胞壁上出现了类菌毛状结构,经16S rDNA PCR扩增测序鉴定该优势厌氧氨氧化菌为“Candidatus Kuenenia Stuttgartiensis”.驯化前后反应器中细菌菌群也发生改变.
厌氧氨氧化;海水;驯化;脱氮
近年来,一些沿海城市为缓解淡水资源日益紧缺的现状,开始推行海水直接利用或混合利用的方法,将其作为市政用水进行冲厕、街道洒水等,导致城市污水盐度增加,引发市政污水处理厂处理难题.此外,许多行业废水,如水产养殖废水、海产品加工废水,其中也含有大量的海水,盐度较高,难于处理[1-3].因此,开发能够耐受海水的高效菌种尤为必要.这种耐受海水的菌种可来源于2种途径,一是海洋生物资源的开发,二是淡水污泥的海水驯化.第1种途径由于对地理等特殊条件的要求往往受限,第2种途径就显得尤为重要.
厌氧氨氧化(anammox)工艺是一种近年来研究较多的新型生物脱氮工艺,该工艺依托自养型厌氧氨氧化菌,以氨为电子供体,亚硝酸盐为电子受体,产生N2.由于能同时去除氨和亚硝酸盐,无须外加有机碳源,且能够改善硝化反应产酸、反硝化反应产碱均需中和的情况,其运行费用可比传统生物脱氮工艺节省近40%[4].目前发现的厌氧氨氧化菌包括6个属,其中淡水环境中的厌氧氨氧化菌有5个属,海水环境中的厌氧氨氧化菌有1个属[5-6].
众多学者采用添加NaCl模拟盐度废水进行了厌氧氨氧化工艺影响的研究.金仁村等[7]、Ma等[8]、Chen等[9]对淡水厌氧氨氧化污泥进行短期的盐度冲击,发现低浓度的盐(0,5,10g/L NaCl)可使厌氧氨氧化活性提高,而高浓度的盐(20,30,50g/L NaCl)则明显抑制厌氧氨氧化活性.Liu等[10]、Kartal等[11]、Windey等[12]对淡水厌氧氨氧化污泥进行长期的盐度驯化,发现通过梯度提高盐度淡水厌氧氨氧化污泥最终可适应高达30g/L的盐度环境,然而当盐度继续升高至30g/L以上,淡水厌氧氨氧化污泥受到可逆抑制.经盐度驯化后微生物群落发生演变,但优势厌氧氨氧化菌依然是淡水型厌氧氨氧化菌“Candidatus Kuenenia Stuttgartiensis”.然而由于海水本身成分复杂,包括多种有机和无机的、溶解态和悬浮态的物质,其含量约为 30‰ ,其中各组分的含量相差悬殊,难以人工模拟[13].研究表明,不同类型的无机离子对厌氧氨氧化的抑制程度不一[7],而有机物同样会对厌氧氨氧化产生影响[14-16],但截止到目前,关于有机物对厌氧氨氧化作用机理的研究还比较少,无机物和有机物协同作用的研究更是未有报道,以往仅采用添加NaCl模拟盐度条件并据此展开的盐度对厌氧氨氧化影响的研究事实上并不完善,不能直接应用于含海水废水的实际处理.因此本研究针对含海水废水生物脱氮效率低的问题,期望通过梯度盐度海水驯化淡水厌氧氨氧化污泥,使其耐受海水盐度,并具有较好的脱氮效果.在研究过程中考察了不同海水盐度对厌氧氨氧化反应动力学、厌氧氨氧化菌细胞形态和反应器内菌群变化的影响.
1 材料与方法
1.1 试验装置及其运行
有机玻璃制作的上流式厌氧反应器构型及流程如图1所示.该反应器有效容积9L(内径为95mm、高度为400mm),主体反应区添加无纺滤布为载体,反应器上方设三相分离系统,保证出水、产气和污泥有效分离.反应器主体外部利用水浴夹层保证反应温度为37℃,控制水力停留时间(HRT)为0.45d.反应器在本试验前已采用低盐模拟废水进行厌氧氨氧化菌富集,该反应器的总氮去除速率维持在1.35kgN/(m3·d)左右,通过优势菌群鉴定,反应器中的厌氧氨氧化菌为“Candidatus Kuenenia”,为典型的淡水型厌氧氨氧化菌.
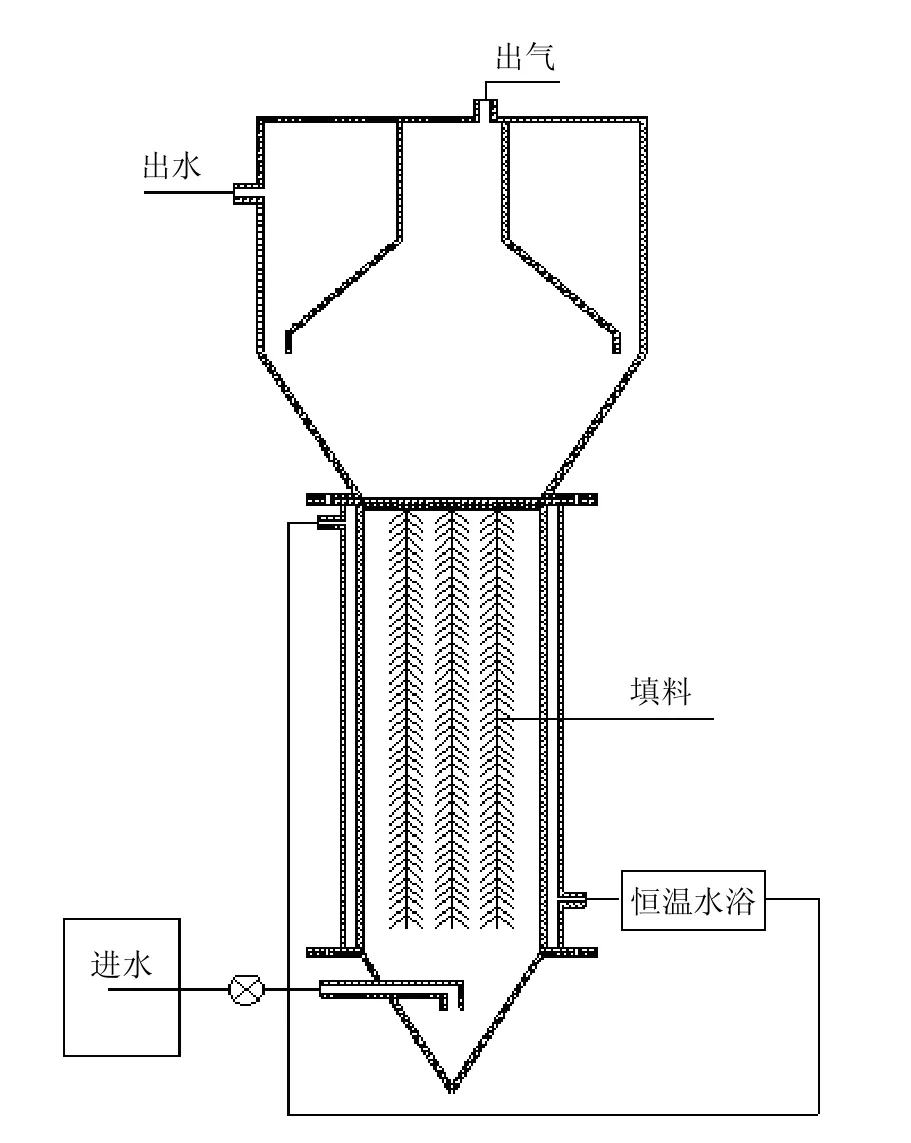
图1 反应装置流程示意Fig. 1 Schematic diagram of the reactor
试验采用梯度盐度海水对淡水厌氧氨氧化污泥进行驯化,在驯化过程中,保证不同盐度海水驯化初期进水基质浓度相近,且每个盐度下驯化时间相同,通过逐步提高进水基质浓度的方法提高总氮去除速率.同时通过对每个海水盐度下基质代谢动力学参数的比较考察不同盐度海水对厌氧氨氧化反应的影响.
1.2 模拟废水
模拟废水中的溶剂是比例不同的自来水和盐度为30‰的砂滤海水混合液,保证混合液中海水盐度分别为0、10‰、20‰和30‰.基质和由NH4Cl和NaNO2按照一定比例提供.此外,该模拟废水中(g/L)还含有KH2PO40.01,CaCl2·2H2O 0.00565, MgSO4·7H2O 0.3, NaHCO31和微量元素浓缩液I、II各1.25mL[17].微量元素浓缩液I、II组成见表1[18].以NaOH溶液或盐酸溶液控制进水pH值在7.0~7.5.
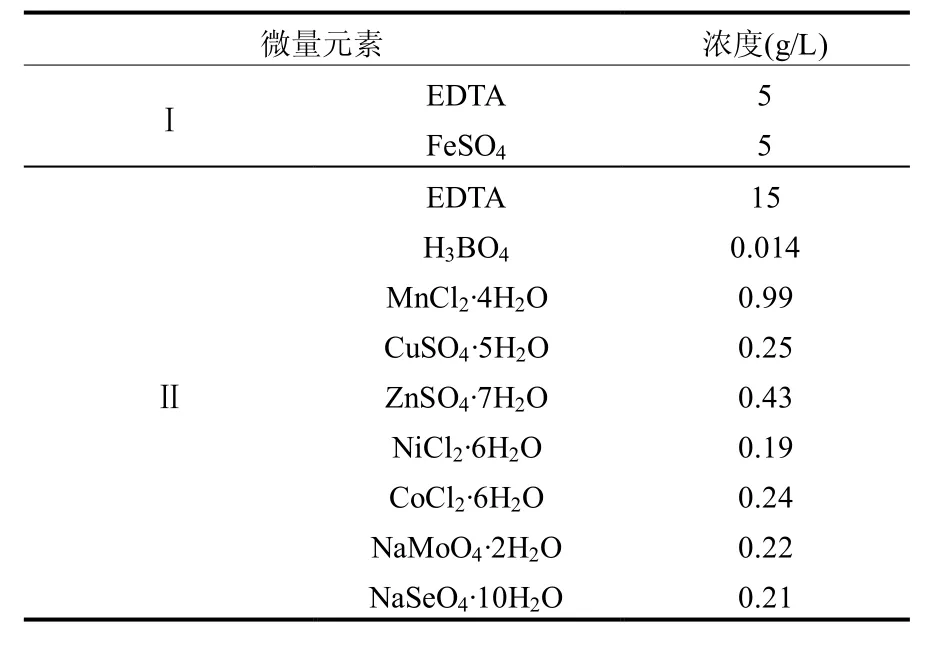
表1 微量元素浓缩液的组成Table 1 Composition of trace elements
1.3 厌氧氨氧化污泥比活性测定
1.4 样品透射电镜观察
从反应器中取污泥样,置于2.5%的戊二醛溶液中,4℃固定过夜,经0.1mol/L、pH 7.0磷酸缓冲液漂洗后,再用1%锇酸溶液固定1~2h,继续用磷酸缓冲液漂洗.经过50%、70%、80%、90%、95%和100%五种浓度的乙醇溶液脱水处理后,用纯丙酮处理20min.接着,分别用体积比为1:1和3:1的包埋剂与丙酮的混合液处理样品1h和3h,最后用包埋剂处理样品过夜.将渗透处理的样品包埋起来,70℃加热过夜,即得到包埋好的样品.样品在Reichert超薄切片机中切片,获得70~90nm的切片,用柠檬酸铅溶液和醋酸双氧铀50%乙醇饱和溶液各染色15min,再用JEM-2000EX型透射电镜(日本JEOL公司)观察结果.
1.5 DNA提取、聚合酶链式反应(PCR)、变性梯度凝胶电泳(DGGE)及测序
将反应器在海水盐度为0和30‰阶段后期的污泥样品进行DNA提取及细菌通用引物扩增.采用上海生能博彩公司环境样品DNA提取试剂盒v2.2进行DNA提取,然后以细菌通用引物PRBA338f和PRUN518通过PCR扩增样品中细菌的DNA片段.反应条件为:94℃预变性10min;94℃变性30s,55℃退火30s,72℃延伸1min,进行30个循环;最后在72℃下延伸7min[17].将PCR产物在35%~65%的变性液梯度条件下进行DGGE,电泳条件为先在120V电压下预电泳20min,然后在200V电压下电泳3.5h,在Bio-Rad凝胶成像系统中对DGGE结果进行观察.对优势菌条带进行割胶,然后进行测序(宝生物工程有限公司).对测序结果进行BLAST比对后,在MEGA4.0软件中采用最大简约法建立系统发育树.
同时对海水盐度30‰阶段后期的污泥样品采用厌氧氨氧化菌特异性引物AMX368f和AMX1480r进行扩增,并对PCR产物直接测序,然后进行BLAST比对.
1.6 测定项目与方法
2 结果与讨论
2.1 海水驯化期厌氧氨氧化污泥脱氮性能
图2为淡水厌氧氨氧化污泥在驯化过程中的脱氮性能.在海水盐度为0时(1~15d),淡水污泥正处于脱氮性能提高期,在该期最末阶段(13~15d)进水和浓度分别为290mg/L和390mg/L,总氮去除速率稳定于1.35kgN/(m3·d),总氮去除效率保持在90%左右.

图2 厌氧氨氧化菌驯化过程中脱氮性能Fig.2 Performance of nitrogen removal during the acclimation of anammox bacteria
继续提高海水盐度至20‰ (61~103d),并保持进水和浓度与海水盐度10‰的初期浓度一致,总氮去除速率为1.25kgN/(m3·d)左右,比海水盐度10‰初期略有下降.提高进水和浓度至480mg/L和580mg/L后,出水出现积累抑制现象,总氮去除速率最低降至0.51kgN/(m3·d),总氮去除效率仅为72%.经过15d恢复后,总氮去除速率为1.21kgN/(m3·d),去除效率恢复至85%.
由此可见,梯度盐度海水驯化可使淡水厌氧氨氧化污泥在海水盐度30‰条件下具有较高的脱氮性能.
2.2 盐度驯化期厌氧氨氧化反应基质代谢动力学
研究表明,亚硝酸为厌氧氨氧化菌的限制性基质,且对厌氧氨氧化菌会产生基质自抑制作用,当浓度为70mg/L时,即可抑制厌氧氨氧化菌的代谢[20].因此本试验通过控制出水浓度,采用Haldane模型[式(1)]对不同海水盐度下反应器出水浓度与总氮去除速率建立代谢动力学关系(图3)[21].通过拟合得到各海水盐度下的最大总氮去除速率(即厌氧氨氧化反应速率),比较不同海水盐度下最大总氮去除速率与海水盐度为0条件下最大总氮去除速率之间的差异率i[式(2)],考察不同海水盐度对厌氧氨氧化反应基质代谢的影响(表2).

图3 不同海水盐度Haldane模型中基质代谢动力学Fig.3 Metabolic kinetics of substratewith Haldane model under different seawater contents TNRR:总氮去除速率;:出水亚硝酸氮浓度

式中: TNRR为总氮去除速率, kg/(m3·d); TNRRmax为最大总氮去除速率, kg/(m3·d); S为出水浓度, mg/L; KS为半饱和常数, mg/L; KIH为基质抑制动力学常数, mg/L.
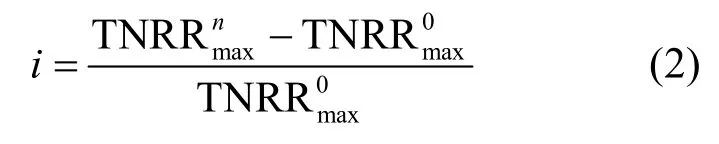
式中: i为不同海水盐度下最大总氮去除速率与0海水盐度下最大总氮去除速率之间的差异率;为10‰、20‰、30‰海水盐度下最大总氮去除速率为0海水盐度下最大总氮去除速率.

表2 不同海水盐度下最大总氮去除速率的差异Table 2 Discrepancy of the maximum total nitrogen removal rate under different seawater contents
比较不同海水盐度下的i值(表2)可以看出海水盐度仅在海水盐度20‰阶段对厌氧氨氧化反应产生不利影响,其TNRRmax比0海水盐度阶段降低了19.4%;而在海水盐度10‰和30‰阶段,其TNRRmax反而比0海水盐度阶段分别提高了90.9%、84.1%.因此,在本试验中,厌氧氨氧化反应速率在低盐度(10‰)下升高,在中盐度(20‰)下降低,而在高盐度(30‰)下又再次升高.
以往研究曾发现厌氧氨氧化反应速率在低盐度时升高、高盐度时降低.例如,金仁村等[7]试验中观察到了类似的现象,0, 5(5‰), 10 (10‰),20g/L (20‰)不同浓度NaC1的作用下,最大去除速率分别为5.04, 7.30, 6.88,4.24mg/(g VSS·h);最大去除率分别为6.99, 10.55, 9.60, 5.15mg/(g VSS·h).关于低盐度时厌氧氨氧化反应速率升高的具体原因,有待进一步研究.对于高盐度时厌氧氨氧化反应速率的降低,一般认为可能是由于在面对外界较高渗透压的情况下,微生物的代谢受阻所致[22].在此次试验中,当海水盐度由20‰升高至30‰后,反应速率提高.产生这一现象的原因可能包括:①经过驯化后,污泥的比活性增加;②长时间驯化厌氧氨氧化菌量增长,导致表观的总氮去除速率增加.本试验通过血清瓶批次试验测定了驯化前后厌氧氨氧化污泥的比活性.结果表明,海水盐度30‰和20‰条件下厌氧氨氧化污泥的比基质转化速率分别为0.70和1.02mg N/(g VSS·h).生物量在经过30‰海水盐度驯化后由0.78g VSS/g载体增加至0.82g VSS/g载体.由此可见,海水盐度由20‰增至30‰阶段,污泥比活性降低,而生物量增加,所以由菌量增长引发的表观总氮去除速率增加可能是反应器厌氧氨氧化速率提高的主要原因.需要注意的是,活性的降低幅度尚不能由生物量增加所弥补.这是因为血清瓶内的微观环境并不能完全等价于反应器内的宏观环境,二者运行模式的不同导致了其内部环境间的差异,包括pH值、溶解氧以及基质浓度等均对反应器的脱氮性能至关重要.另外,生物量也与反应器脱氮效能密切相关.研究表明,高菌体浓度可降低单位污泥负荷,增加生长因子,从而可减轻厌氧氨氧化过程中可能发生的抑制作用,提高反应器运行的稳定性[23-25].因此,反应器脱氮效能不能笼统地等价于比基质转化速率与生物量的简单乘法运算.此外,金仁村等[7]发现,在30g/L NaCl作用下,淡水厌氧氨氧化菌活性相对20g/L时降低了37.2%;而Ma等[8]则发现,盐度冲击会对淡水厌氧氨氧化菌的生长形成抑制作用,当盐度冲击负荷高于10g/L (20g/L和30g/L)时,反应器内生物量急剧减少.本试验中虽然也观察到了类似的活性降低现象,但其降低幅度仅为31.4%;反应器内的生物量不仅没有减少,在经过30‰海水盐度驯化后反而增长了5.1%. Ma等[8]、Kartal等[11]均在其研究过程中发现过类似现象.这表明,原有淡水厌氧氨氧化菌本身并不具有对高海水盐度的固有抗性,但通过梯度提高海水盐度对淡水污泥进行驯化后,厌氧氨氧化菌的耐海水盐度性能增强,代谢和繁殖的受抑制程度降低,最终可以适应高达30‰的海水盐度环境.海水盐度20‰很可能是淡水厌氧氨氧化污泥驯化过程中的一个临界点,这是因为淡水厌氧氨氧化菌为非嗜盐菌,而该盐度则是整个驯化过程中第一次超出非嗜盐菌最佳生长盐浓度(<11.7‰)的分界点[11,26].
2.3 海水盐度驯化对厌氧氨氧化菌形态的影响
采用梯度盐度海水对淡水厌氧氨氧化污泥进行驯化后,反应器内颗粒污泥呈厌氧氨氧化菌所特有的砖红色[17].采用透射电镜对原有淡水厌氧氨氧化菌及海水盐度30‰阶段获得的耐海水型厌氧氨氧化菌的细胞形态进行观察.结果表明,二者的形态发生显著变化(图4).原有淡水厌氧氨氧化菌细胞大小1 μm左右,细胞呈月牙形或镰刀形,表面有火山口形状,细胞内部大部分被厌氧氨氧化体占据,具有典型的厌氧氨氧化菌结构[16].海水盐度30‰阶段获得的耐海水型厌氧氨氧化菌细胞大小无明显变化,细胞形状更加不规则,细胞壁外出现类菌毛状结构,这种结构曾在“Candidatus Scalindua spp.”这种海洋环境中的厌氧氨氧化菌有过报道[27].
2.4 海水盐度驯化对菌群变化的影响
利用PCR-DGGE对驯化前后反应器中的细菌菌群变化进行分析,可以看出驯化前后细菌优势菌群发生明显变化(图5).对驯化前后样品中优势菌条带(1#、2#、3#、4#、5#、6#)进行割胶测序,后在BLAST数据库进行比对,并建立系统发育树(图6).

图4 盐度驯化前后厌氧氨氧化菌形态变化Fig.4 Morphology of the non-acclimated and acclimated anammox bacteria

图5 盐度驯化前后菌群16S rDNA基因序列变性梯度凝胶电泳图谱变化Fig.5 Denaturing gradient gel electrophoresis (DGGE)profiles for the 16S rDNA gene fragments of the nonacclimated and acclimated bacterial community
驯化前样品中的优势菌种主要为1#和2#条带,其中1#与Candidatus Kuenenia sp. clone(JN182853)的相似度为99%, 2#与Denitratisoma Oestradiolicum clone (KF810120)的相似度为100%.因此在淡水反应器中主要存在厌氧氨氧化菌和反硝化细菌.经梯度盐度海水驯化后的样品中的优势菌种主要为3#、4#、5#、6#条带,其中3#与一种盐碱土壤中获取的uncultured bacterium clone (JQ427623)的相似度为99%, 4#、5#与自养型脱氮除硫反应器中的uncultured Rhodocyclaceae bacterium clone (GQ324225)的相似度为96%, 6#与盐沼地中的uncultured bacterium clone (JN684694)的相似度为99%.由此可见,驯化后反应器中细菌主要为不可培养细菌,优势菌与高盐环境中的细菌和一些脱氮细菌有较高的相似性.然而由于进行DGGE试验的PCR产物序列较短(仅236bp),不能够用于对反应器中细菌的鉴定.采用厌氧氨氧化细菌特异性引物对驯化后的样品进行16SrDNA PCR扩增、测序(1073bp),对反应器中厌氧氨氧化细菌进行进一步分析.

图6 驯化前后优势菌的系统发育树Fig.6 Phylogenetic tree of the dominant bacteria in the non-acclimated and acclimated sludge
通过BLAST比对,结果显示该序列与厌氧氨氧化菌Candidatus Kuenenia Stuttgartiensis基因组片段(CT573071)的相似度为99%,可认为该菌为Ca. K. Stuttgartiensis. Ca. K. Stuttgartiensis为淡水环境中的厌氧氨氧化菌,目前未见报道其具有菌毛状结构,这与形态观察结果不一致,这一现象需要进一步研究.
3 结论
3.1 淡水厌氧氨氧化污泥经过驯化后,可以在30‰海水盐度下取得较好的脱氮性能,总氮去除速率可达2.80kgN/(m3·d).
3.2 厌氧氨氧化基质代谢动力学表明当海水盐度由0升高至10‰、20‰及30‰的过程中,厌氧氨氧化反应速率经历了升高、降低、再升高的过程.
3.3 在海水盐度30‰阶段获得的高效耐海水型厌氧氨氧化菌细胞结构发生改变,细胞形状更加不规则,且细胞壁上出现类菌毛状结构.经16S rDNA PCR扩增测序鉴定该优势厌氧氨氧化菌为Candidatus Kuenenia Stuttgartiensis.
[1]孙晓杰,徐迪民,于德爽.海水冲厕污水的短程硝化试验研究 [J].中国给水排水, 2007,23(3):40-43.
[2]于德爽,彭永臻,张相忠,等.海水盐度对短程硝化反硝化的影响[J]. 工业水处理, 2003,23(1):50-54.
[3]Chowdhury P, Viraraghavan T, Srinivasan A. Biological treatment processes for fish processing wastewater- A review [J]. Bioresour. Technol., 2010,101(2):439-449.
[4]Hu Z Y, Lotti T, van Loosdrecht M, et al. Nitrogen removal with the anaerobic ammonium oxidation process [J]. Biotechnol. Lett.,2013,35(8):1145-1154.
[5]van Niftrik L, Jetten M S M. Anaerobic ammonium-oxidizing bacteria: unique microorganisms with exceptional properties [J]. Microbiol. Mol. Biol. Rev., 2012,76(3):585-596.
[6]Khramenkov S V, Kozlov M N, Kevbrina M V, et al. A novel bacterium carrying out anaerobic ammonium oxidation in a reactor for biological treatment of the filtrate of wastewater fermented sludge [J]. Microbiol., 2013,82(5):628-636.
[7]金仁村,马 春,郑 平,等.盐度对Anammox的短期影响研究[J]. 高校化学工程学报, 2013,27:322-329.
[8]Ma C, Jin R C, Yang G F, et al. Impacts of transient salinity shock loads on Anammox process performance [J]. Bioresour. Technol.,2012,112:124-130.
[9]Chen H, Ma C, Ji Y X, et al. Evaluation of the efficacy and regulation measures of the anammox process under salty conditions [J]. Sep. Purif. Technol., 2014,132:584-592.
[10]Liu C L, Yamamoto T, Nishiyama T, et al. Effect of salt concentration in anammox treatment using non woven biomass carrier [J]. J. Biosci. Bioeng., 2009,107(5):519-523.
[11]Kartal B, Koleva M, Arsov R, et al. Adaptation of a freshwater anammox population to high salinity wastewater [J]. J. Biotechnol., 2006,126(4):546-553.
[12]Windey K, De Bo I, Verstraete W. Oxygen-limited autotrophic nitrification-denitrification (OLAND) in a rotating biological contactor treating high-salinity wastewater [J]. Water Res., 2005, 39(18):4512-4520.
[13]陈 敏.化学海洋学 [M]. 北京:海洋出版社, 2009:13-21.
[14]孙佳晶,张 蕾,张 超,等.有机物作用的厌氧氨氧化菌代谢特性研究进展 [J]. 化工进展, 2012,31(8):1834-1837.
[15]操沈彬,王淑莹,吴程程,等.有机物对厌氧氨氧化系统的冲击影响 [J]. 中国环境科学, 2013,33(12):2164-2169.
[16]李泽兵,刘常敬,赵白航,等.多基质时厌氧氨氧化菌、异养反硝化污泥活性及抑制特征 [J]. 中国环境科学, 2013,33(4):648-654.
[17]张 蕾.厌氧氨氧化性能的研究 [D]. 杭州:浙江大学, 2009.
[18]郑 平,徐向阳,胡宝兰.新型生物脱氮理论与技术 [M]. 北京:科学出版社, 2004:90-91.
[19]国家环境保护总局.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2002:258-281.
[20]Strous M, Kuenen J G, Jetten M S M. Key physiology of anaerobic ammonium oxidation [J]. Appl. Environ. Microbiol.,1999,65(7):3248-3250.
[21]李伟刚,于德爽,李 津.ASBR反应器厌氧氨氧化脱氮II:反应动力学 [J]. 中国环境科学, 2013,33(12):2191-2200.
[22]Schmid M, Twachtmann U, Klein M, et al. Molecular evidence for genus level diversity of bacteria capable of catalyzing anaerobic ammonium oxidation [J]. Syst. Appl. Microbiol., 2000,23(1):93-106.
[23]Strous M, Fuerst J A, Kramer E H M, et al. Missing lithotroph identified as new planctomycete [J]. Nature, 1999,400(6743):446-449.
[24]Isaka K, Date Y, Sumino T, et al. Growth characteristic of anaerobic ammonium-oxidizing bacteria in an anaerobic biological filtrated reactor [J]. Appl. Microbiol. Biotechnol., 2006, 70(1):47-52.
[25]Tang C J, Zheng P, Chen T T, et al. Enhanced nitrogen removal from pharmaceutical wastewater using SBA-ANAMMOX process [J]. Water Res., 2011,45(1):201-210.
[26]吴月红.盐环境细菌群落结构分析和多相分类学研究 [D]. 杭州:浙江大学, 2009.
[27]van Niftrik L, Geerts W J C, van Donselaar E G, et al. Linking ultrastructure and function in four genera of anaerobic ammonium-oxidizing bacteria: cell plan, glycogen storage, and localization of cytochrome c proteins [J]. J. Bacteriol., 2008,190(2):708-717.
Acclimation of a highly-efficient and seawater tolerant anammox sludge.
LI Zhi-xing1, ZHANG Lei1*, CHEN Xiao-bo2, LI Hang1, LI Dan1(1.Department of Marine Science and Environmental Engineering, Dalian Ocean University,Dalian 116023, China;2.Dalian Municipal Design and Research Institute CO., LTD, Dalian 116021, China). China Environmental Science, 2015,35(3):748~756
The performance of biological nitrogen removal in treating seawater-containing wastewater is not satisfying. Here we report the acclimation of a freshwater-origin anaerobic ammonium oxidation (anammox) sludge by using seawater with increasing salt concentrations. Nitrogen removal performance, morphological characteristics and dominant strains of the bacterial community in the reactor were investigated. After 145days of acclimation, this freshwater-origin anammox sludge was fully adapted to seawater, with a total nitrogen removal rate (TNRR) reaching 2.80kgN/(m3·d). The anaerobic ammonium oxidizing rate first increased, then decreased, and then increased again when the seawater content was gradually increased from 0‰ to 30‰. A seawater content of 20‰ was the critical point during the acclimation. In terms of morphological characteristics, cell shape of the acclimated anammox bacteria was irregular and pilus-like appendages were developed on the cell wall. Change in the bacterial community composition after acclimation was also observed through DGGE.The dominant anammox strain was identified as “Candidatus Kuenenia Stuttgartiensis” based on the sequence of the 16S rDNA gene.
anammox;seawater;acclimation;nitrogen removal
X703.1
A
1000-6923(2015)03-0748-09
李智行(1989-),男,河南新乡人,大连海洋大学硕士研究生,主要从事废水生物脱氮研究.
2014-07-31
国家自然科学基金资助项目(41106097);辽宁省高校杰出青年学者成长计划资助项目(LJQ2012065)
* 责任作者, 副教授, zhanglei@dlou.edu.cn
