大孔树脂分离纯化柚子皮多酚研究
2015-11-18夏昊云汤小芳许晨东陈飞
夏昊云,汤小芳,许晨东,陈飞
(南京理工大学泰州科技学院,江苏泰州225300)
大孔树脂分离纯化柚子皮多酚研究
夏昊云,汤小芳,许晨东,陈飞
(南京理工大学泰州科技学院,江苏泰州225300)
以柚子皮为原料,采用乙醇浸提法提取、大孔树脂分离纯化其中的多酚类物质,建立了一套简单易行的柚子皮多酚提取、分离纯化的方法。比较了S-8,AB-8,D101 3种不同极性的大孔树脂对柚子皮多酚的吸附分离效果,研究了其对柚子皮多酚的静态与动态的吸附及解析性能。结果显示,AB-8树脂的吸附和解析性能良好,可用于柚子皮多酚的分离纯化。
柚子皮;多酚;大孔吸附树脂;静态吸附;动态吸附
日常生活中柚子皮经常作为废物而被丢弃,但是柚子皮不仅营养丰富,而且含有多种可以预防及治疗疾病的生理活性物质,其中多酚类是柚子皮中含量最为丰富的一类活性物质[1]。
目前,多酚的提取和分离纯化方法有溶剂萃取法[2]、超临界CO2萃取法[3]、超声波辅助提取法[4]、微波辅助提取法[5]、树脂层析分离法[6-9]等,大孔树脂吸附法属于层析分离法,其利用不同组分在给定的两相中具有不同的分配系数而使得混合物实现分离与测定。实验室或工业化采用层析柱分离纯化多酚可以有利于固定相的再生。
文中研究了3种不同极性的大孔树脂对柚子皮多酚的吸附及解析性能,优化其分离纯化工艺,对柚子皮中的多酚类物质进行分离纯化,合理开发利用柚子皮,延长产业链,达到变废为宝、废物利用的目的。
1 实验方法
1.1 柚子皮多酚的提取流程(图1)
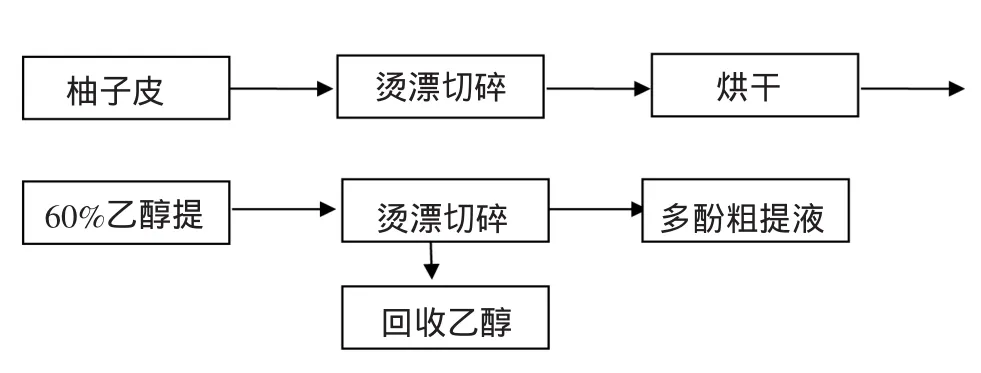
图1 柚子皮多酚的提取流程
1.2 福林酚试剂法测定柚子皮总多酚含量[10]
1.3 大孔树脂的预处理
选用极性大孔树脂S-8,弱极性树脂AB-8及非极性树脂D101,常温下在无水乙醇中密封浸泡8 h,使其充分溶胀,然后用无水乙醇冲洗至无白色浑浊后用蒸馏水洗至中性。再用5%的盐酸溶液浸泡8 h后用蒸馏水冲洗至中性,最后用5%的氢氧化钠溶液浸泡8 h后,用蒸馏水冲洗至中性。
1.4 大孔吸附树脂的静态吸附研究
1.4.1 最佳树脂的选择[11]
将不同型号预处理后的树脂用滤纸吸干,准确称取1.0 g,放入250 mL锥形瓶中,加入100 mL已知浓度的柚子皮多酚粗提液,避光振荡24 h,达到吸附平衡后取上层清液,测量多酚浓度。剩余物过滤,树脂用蒸馏水冲洗2次,滤纸吸干,在相同条件下用100 mL 70%的乙醇进行解析实验,解析平衡后测定解析液的多酚浓度。以吸附率、解析率为指标进行综合评价,从中筛选出性能最好的树脂进行后续试验。吸附率、解析率的计算公式如下:
吸附率=(C0-C1)/C0
式中:C0——吸附前溶液中多酚浓度,mg/mL;
C1——吸附后溶液中多酚浓度,mg/mL。
解析率=C2V2/(C0-C1)×V1
式中:C2——解吸液中多酚浓度,mg/mL;
V2——解析液体积,mL;
V1——吸附液体积,mL。
1.4.2 静态吸附与解析试验
通过静态吸附试验可以得出在静态环境下吸附达到平衡所需要的时间,解析试验能够确定解析剂的最佳浓度,以及考察温度对解析试验的影响。
(1)吸附试验:准确称取预处理后的干树脂1.0 g至锥形瓶中,按照1∶10的料液比,加入已知浓度的柚子皮多酚粗提液,密封,室温下以120 r/min的振荡速度进行吸附,每隔半小时取样,测量吸光度,绘制多酚静态吸附曲线。
(2)解析试验:准确称取吸附达到饱和的树脂10.0 g至锥形瓶中,按照1∶10的料液比,加入不同浓度的乙醇溶液,密封,室温下以120 r/min的振荡速度进行解析,定时从上层清液中取样测量吸光度,考察解析剂浓度对解析率的影响。
1.5 动态吸附与洗脱试验
1.5.1 动态吸附条件的选择
将处理好的AB-8大孔树脂10 g装入玻璃柱(柱长径比约20∶1)中,然后以一定流速将100 mL已知浓度的柚子皮多酚粗提液上柱进行吸附,收集流出液,测量其中多酚浓度,以吸附率为指标,对上柱流速、料液浓度等影响因素进行考察,绘制动态吸附曲线。
1.5.2 洗脱曲线
树脂吸附达到饱和后,用一定量的蒸馏水洗去树脂同时吸附的糖和水溶性半纤维素等杂质。然后用不同浓度乙醇溶液以不同流速进行洗脱,分段收集洗脱液,测量多酚含量,考察乙醇浓度和洗脱流速对多酚洗脱的影响,并绘制洗脱曲线。
2 试验结果与讨论
2.1 最佳树脂的选择
大孔吸附树脂的吸附性能取决于吸附剂与吸附物质之间的氢键和范德华力,与其被吸附物的溶解度、表面性质和孔结构等特性有关[12]。
经过比较发现弱极性和非极性树脂对柚子皮多酚的吸附效果较好。从吸附量、解析率2个因素综合考虑,AB-8树脂的吸附率和解析率都较高,因此选择AB-8树脂进行进一步研究。
2.2 静态吸附动力学曲线
从图2中可以看出,树脂吸附速率随时间的延长逐渐下降,2 h后基本达到吸附平衡,属于快速吸附,饱和吸附量可达2.1 mg/g。
2.3 解析剂浓度的影响
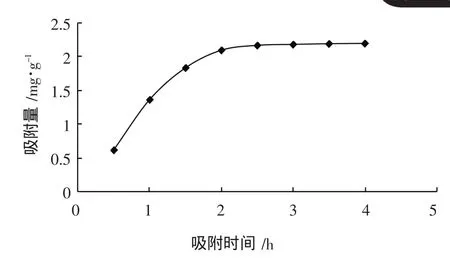
图2 静态吸附动力学曲线
随着乙醇浓度的增加,多酚解析率逐渐提高,当乙醇浓度为70%时,解析率最大达到80%左右,当乙醇浓度进一步升高时,解析率趋于平衡。乙醇浓度太低,不能破坏树脂与多酚形成的氢键,多酚解析率低,乙醇浓度增大,溶液极性与多酚极性相差增大,根据极性相似相溶原理,多酚解析率趋于平衡,所以试验中采用70%乙醇作为解析剂。
2.4 大孔吸附树脂的动态吸附研究
2.4.1 上柱流速对吸附率的影响
随着流速的增加,大孔树脂的吸附率随之降低。但流速过慢,则吸附时间较长,不利于利用,当流速增大时,柚子皮多酚还没有完全被大孔树脂吸附就因流速过快而流出层析柱。所以综合考虑,在流速为1 mL/min下,吸附柚子皮多酚效果最佳。
2.4.2 料液浓度对吸附率的影响
根据吸附平衡理论,浓度减小,达到平衡时所用粗提液体积增大,残留在流出液中的多酚增多,吸附率降低;但浓度太高时,会发生多层吸附,并堵塞微孔,降低内孔利用率,吸附率也将下降。随着料液中多酚含量增加,大孔树脂的吸附能力较低,说明提取溶液中多酚含量较高时,其他物质含量也较高,大孔树脂对多酚的吸附受到影响,吸附效率降低。因此,综合考虑,多酚最佳浓度为2~4 mg/mL。
2.4.3 动态吸附曲线的研究
AB-8树脂的动态吸附曲线见图3。
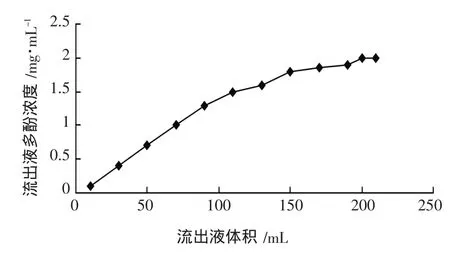
图3 AB-8树脂的动态吸附曲线
如图3所示,当流出液体积达到10 mL时开始有多酚泄漏,随着流出液体积的增大,流出液中的多酚浓度逐渐增加,当流出液体积达到200 mL时,流出液中多酚浓度几乎不再改变,即基本达到吸附平衡。因此,选用200 mL作为上样体积。
2.4.4 动态解析曲线的研究
柚子皮多酚的动态洗脱曲线,如图4所示。从图4可知,流出液体积达到10 mL时开始有多酚流出。并且随着流出液体积增加,洗脱液中的多酚浓度快速上升,当流出液体积达到25 mL左右,可达到最大值约为6.3 mg/mL;随后流出液体积再增大,多酚浓度降低。当流出液体积60 mL左右时,多酚浓度已接近为零,可认为此时柚子皮多酚基本洗脱完全。因此选用60 mL作为洗脱剂使用体积。
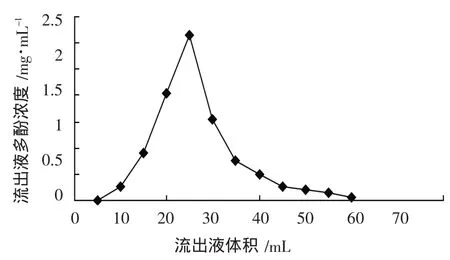
图4 AB-8树脂的动态洗脱曲线
3 结论
(1)AB-8树脂对柚子皮多酚具有良好的吸附和解析性能,适于分离纯化柚子皮多酚。
(2)根据静态吸附试验,AB-8大孔树脂吸附柚子皮多酚2 h左右即可达到饱和,饱和吸附量为2.1 mg/g。乙醇为洗脱剂的最适宜浓度为70%。
(3)根据动态吸附试验,可知当上样流速为1mL/min,上柱液中柚子皮多酚浓度为2 mg/mL时,柚子皮多酚的吸附量达到最大,约为6.3 mg/mL。以体积分数为70%的乙醇为洗脱剂时,可使柚子皮多酚基本洗脱完全。
[1]张清安,范学辉.多酚类物质抗氧化活性评价方法研究进展[J].食品与发酵工艺,2011,37(11):169-170.
[2]Fausto Gironi,Vincenzo Piemonte.Temperature and solvent effects on polyphenol extraction process from chestnut tree wood[J].Chemical Engineering Research and Design,2011,89(7):857-862.
[3]Nicola De Zordi,Angelo Cortesi,Ireneo Kikic,et al.The supercritical carbon dioxide extraction of polyphenols from Propoils:A central composite design approach[J].The Journal of Supercritical Fludies,2014,95:491-498.
[4]Jorge E Wong Paz,Diana B Muniz Marquez,Guillermo C G Martinez Avila,et al.Ultrasound-assisted extraction of polyphenols from native plants in the Mexican desert[J]. Separation and Purification Technology,2014,128:89-95.
[5]Guowen Zhang,Mingming Hu,Li He,et al.Optimization of microwave-assisted enzymatic of polyphenols from waste peanutshellsandevaluationofitsantioxidantand antibacteriaactivitiesinvitro[J].FoodandBioproducts Processing,2013,91(2):158-168.
[6]许先猛,董文宾,张增帅,等.苹果渣多酚大孔树脂分离及抗氧化性研究[J].中国食品添加剂,2014(1):140-146.
[7]陶莎,黄英,康玉凡,等.大孔吸附树脂分离纯化红小豆多酚工艺及效果[J].农业工程学报,2013,29(23):276-285.
[8]吕春茂,宋雨涵,孟宪军,等.大孔树脂纯化寒富苹果渣多酚工艺优化[J].食品工业科技,2012(6):300-308.
[9]李佳彦,聂波,张壮,等.大孔树脂富集泽兰中酚酸类成分[J].中国实验方剂学杂志,2010,16(6):22-23.
[10]郭娟,艾志录,崔建涛,等.苹果渣中多酚物质的福林法测定[J].食品工业科技,2006,27(2):178-180.
[11]张守文,王红,张娜.大孔树脂分离纯化燕麦麸皮多酚的研究[J].农产品加工(学刊),2013(3):21-24,43.
[12]刘子放,王振江,唐翠明,等.桑椹花青素的大孔树脂分离纯化[J].广东蚕业,2008,44(4):31-33.
Adsorption and separation of pomelo peel polyphenols by macroporous adsorption resins
XIA Haoyun,TANG Xiaofang,XU Chendong,CHEN Fei
(Nanjing University of Science and Technology,Taizhou Institute of Science and Technology,Taizhou 225300,China)
Alcohol-water was used as solvent to extract polyphenols from pomelo peel.Three kinds of different macroporous reins were studied to adsorb polyphenols by static adsorption and dynamic adsorption.Results indicated that:macroporous resin AB-8 had the best properties of adsorption and desorption.It can be used for the separation and purification of pomelo peel polyphenols.
pomelo peel;polyphenols;macroporous adsorbent resins;static adsorption;dynamic adsorption
X799.3
A
1674-0912(2015)10-0038-03
2015-09-06)
夏昊云(1980-),女,硕士研究生,讲师,研究方向:痕量分析及其应用研究。
