邻苯二甲酸二异壬酯致小鼠肝组织氧化损伤的研究
2015-11-17代园园龚金锋王绪杨湖北科技学院基础医学院湖北咸宁43700华中师范大学生命科学学院环境生物医学实验室湖北武汉430079
陆 杰,代园园,罗 慧,龚金锋,王绪杨,武 阳,,杨 旭,马 萍,*(.湖北科技学院基础医学院,湖北 咸宁 43700;.华中师范大学生命科学学院环境生物医学实验室,湖北 武汉 430079)
邻苯二甲酸二异壬酯致小鼠肝组织氧化损伤的研究
陆 杰1,代园园1,罗 慧1,龚金锋1,王绪杨1,武 阳1,2,杨 旭2,马 萍1,2*(1.湖北科技学院基础医学院,湖北 咸宁 437100;2.华中师范大学生命科学学院环境生物医学实验室,湖北 武汉 430079)
研究邻苯二甲酸二异壬酯对小鼠肝细胞的氧化损伤.以昆明小鼠为受试动物,随机分为5组,包括1个阴性对照组、4个邻苯二甲酸二异壬酯染毒组,染毒组按0.5,5,50,500mg/kg4个剂量水平,灌胃染毒小鼠14d.以肝组织匀浆测定活性氧(ROS)、还原型谷胱甘肽(GSH)、丙二醛(MDA)和8-羟基脱氧鸟苷(8-OHdG)的含量;以肝组织细胞测定DNA-蛋白质交联(DPC)系数.随着邻苯二甲酸二异壬酯染毒剂量的升高,肝组织的ROS、MDA、8-OHdG含量和DPC系数逐渐上升,GSH含量逐渐降低,各指标呈一定的剂量-效应关系.染毒剂量为50mg/kg时, ROS、GSH、8-OHdG含量和DPC系数差异有统计学意义(P< 0.05, P< 0.01);染毒剂量为500mg/kg时,上述指标差异均有统计学(P< 0.05,P< 0.01).同时对小鼠肝组织形态进行光镜观察,结果表明,随着染毒剂量的加大,小鼠肝细胞的病理损伤越严重.较高剂量(≥50mg/kg)的邻苯二甲酸二异壬酯能造成小鼠肝组织的氧化损伤.
活性氧;还原型谷胱甘肽;丙二醛;8-羟基脱氧鸟苷;DNA-蛋白质交联;氧化损伤
邻苯二甲酸二异壬酯(DINP)属于邻苯二甲酸酯类化合物,是一种新型替代增塑剂,现广泛应用于各类软质聚氯乙烯产品、橡胶产品和涂料的工业生产中.作为邻苯二甲酸酯类物质中重要的类型,DINP可以通过皮肤接触、进食、饮水和空气吸入等多种途径进入人体[1-2],对于DINP毒性的研究已经受到环境科学学者们的广泛关注.Boberg等[3]研究发现DINP的剂量高于300mg/(kg·d)时对Wistar大鼠有抗雄性激素作用,具有生殖毒性.Kaufmann等[4]研究了DINP的致癌性,发现DINP在大鼠体内能诱导过氧化物酶的生成,进而诱导肝肿瘤的产生.Saillenfait等[5]对Sprague-Dawley大鼠进行DINP的口服染毒实验,发现DINP能导致其胚胎发育毒性和产后畸形.2005年,欧盟规定儿童可放进口中的玩具及儿童护理用品,其塑料所含的3类邻苯二甲酸盐(DINP、DIDP及DNOP),浓度不得超过0.1%[6].有关邻苯二甲酸酯类物质的毒理学研究己有诸多报道,但有关DINP的毒性机理研究相对较少,国内未见相关报道.DINP在啮齿类动物和人体内的吸收、分布、代谢和排泄已经得到阐明[7],但国内外有关DINP氧化损伤的研究并不多见,大都是以研究人的体液(如尿液,乳汁,唾液,血清等)的氧化代谢物为主[8-9].本研究以SPF级雄性昆明小鼠为实验材料,采用DINP体内染毒方法,通过检测其肝组织匀浆测定活性氧、还原型谷胱甘肽、丙二醛、8-羟基脱氧鸟苷的含量,并以肝组织细胞测定DNA-蛋白质交联系数的变化以及通过肝组织切片观察,探讨DINP对小鼠肝细胞氧化损伤的机制,为全面探讨DINP的毒性效应及分子机制提供参考.
1 材料与方法
1.1 实验材料
1.1.1 主要仪器与试剂 Power wave XS酶标仪(美国Bio-Tek仪器有限公司),FLx 800荧光酶标仪(美国Bio-Tek仪器有限公司),F-4500型荧光分光光度计(日本日立公司),5415R低温冷冻离心机(德国Eppendorf公司),RM2245切片机(德国LEICA公司),HH-42三用电热恒温水箱(长源实验仪器厂,北京);DCFH-DA荧光染料(>99.9%,Sigma公司),蛋白酶K(Sigma公司),小鼠8-羟基脱氧鸟苷ELISA检测试剂盒(济南朋远生物技术有限公司,济南),还原型谷胱甘肽试剂盒(南京建成生物工程研究所,南京),Hoechst33258荧光染料(Sigma公司),三羟基氨基甲烷盐酸盐(Tris-HCL,分析纯,Amresco分装), 5,5′-二硫代二硝基苯甲酸(DTNB,分析纯,国药集团化学试剂有限公司),硫代巴比妥酸(TBA,分析纯,国药集团化学试剂有限公司),邻苯二甲酸二异壬酯(DINP,≥99.6%,Sigma公司).
1.1.2 实验动物 选用湖北省实验动物研究中心提供的SPF级雄性昆明小鼠30只(合格证号:No. 42000600001226),体重为(33.15±1.15)g,饲养1周后实验,实验动物使用许可证号:SYXK(鄂)2013-0071.实验过程中,小鼠饲养于无菌笼内,保持温度在20~25℃内,笼内相对湿度为50%~70%,以商业鼠粮饲养小鼠,及时补充饮用水,并避免其接触其它干扰致病源,小鼠可自由进食进水.
1.2 实验方法
1.2.1 动物分组和染毒 国际所规范的DINP可接受的日摄入量(ADI)上限在0.02~0.14mg/kg之间.在ADI水平的基础上,Lington等[10]研究表明,DINP的未观察到有害效应的水平(NOAEL)为15mg/kg,而Moore[11]的研究表明DINP的NOAEL可达88mg/kg.因此,考虑到DINP剂量的不确定性,模拟评估DINP最大的风险剂量,并参照Gray等[12]和McKee等[13]文中提及的500mg/kg作为本实验最高的染毒剂量, 0.5mg/kg作为本实验最低的染毒剂量.
30只昆明小鼠随机分为5组,包括1个阴性对照组、4个DINP染毒组,每组6只.染毒组的染毒剂量分别为0.5,5,50,500mg/kg,以生理盐水稀释成0.05,0.5,5,50mg/mL4种浓度的使用液,稀释过程中加与DINP等量的吐温80助溶;因吐温80只是作为DINP的助溶剂,量很小,对生物体无毒无副作用,所以阴性对照组只是给予生理盐水.稀释液现用现配,使用时在旋涡混悬仪上充分混匀.均经口灌胃给予,灌胃量为10mL/kg,每天1次,连续染毒14d,分别于实验前称小鼠体重.
1.2.2 肝组织切片的制备和观察 染毒结束后用颈椎脱臼法处死小鼠,立即取肝组织,肝组织用4%的多聚甲醛固定,常规脱水,石蜡切片,HE染色,普通光学显微镜下观察肝组织的病理组织学变化.
1.2.3 肝组织匀浆和悬液的制备 将肝组织在冰冷的PBS(pH7.5)中漂洗,滤纸拭干,分成2部分,一部分肝组织加PBS制成10%匀浆液,低温离心后取上清,用于ROS、GSH、MDA和8-OHdG的检测.另一部分肝组织剪成糜状,过滤后将滤液离心去上清,再用 PBS重悬细胞,用于DPC系数的检测.
1.2.4 ROS含量的测定 取上清液4µL,加入396µL PBS作100倍稀释.取100µL稀释液于酶标板中排列,并加入100µL荧光染料DCFA染色,避光反应5min,用荧光酶标仪检测.
1.2.5 蛋白质含量和GSH含量的测定 蛋白质含量按照Folin酚法测定,GSH含量的测定严格按照试剂盒操作说明进行.GSH含量(µmol/ gprot)=[(测定OD值-空白OD值)/(标准OD值-空白OD值)]×标准管浓度×样本稀释倍数÷待测匀浆蛋白浓度(gprot/L).
1.2.6 MDA含量的测定 取500µL上清液于试管中,并加入2mL0.6%TBA,沸水浴15min.取上清1mL于EP管中,10000×g离心5min.取上清100µL于酶标板中排列,用全波长酶标仪检测,分别在450,532,600nm波长下测定吸光值(以加PBS的为参照),按照公式计算MDA浓度(µmol/ L)=6.45(A532-A600)-0.56A450,式中:A为吸光度.
1.2.7 8-OHdG含量的测定 8-OHdG含量的测定严格按照试剂盒操作说明进行.以0,3,6,12,24,48ng/mL等标准品浓度为横坐标,450nm处OD值为纵坐标,绘制标准曲线,根据标准曲线来确定样品中8-OHdG的含量.
1.2.8 DPC系数的测定 DPC采用KCl-SDS沉淀法进行检测[14].首先向样品中加入SDS,使之与DPC及蛋白质结合,然后加入KCl溶液使DPC和蛋白质沉淀,而游离的DNA留在上清液中.将上清液转移后,再向沉淀中加入蛋白酶K除去蛋白质,使DPC中的DNA游离出来,用荧光法测定此DNA的含量A(交联DNA)以及原液中DNA的含量B(游离DNA),计算DPC系数η[η= A/(A+B)].
1.3 统计分析
2 结果
2.1 小鼠体重和肝组织的脏器系数
小鼠体重和肝组织的脏器系数见表1,与对照组比较,各剂量组小鼠体重和脏器系数差异无统计学意义(P > 0.05).
表1 DINP染毒小鼠的体重和脏器系数(n=6,± s)
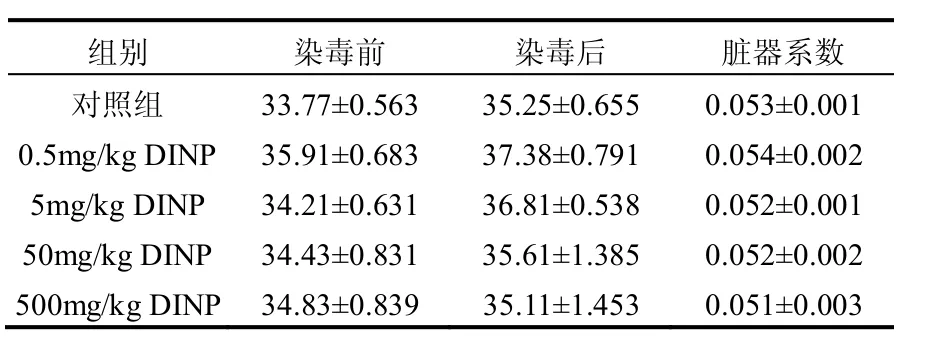
表1 DINP染毒小鼠的体重和脏器系数(n=6,± s)
组别 染毒前 染毒后 脏器系数对照组 33.77±0.563 35.25±0.655 0.053±0.001 0.5mg/kg DINP 35.91±0.683 37.38±0.791 0.054±0.002 5mg/kg DINP 34.21±0.631 36.81±0.538 0.052±0.001 50mg/kg DINP 34.43±0.831 35.61±1.385 0.052±0.002 500mg/kg DINP 34.83±0.839 35.11±1.453 0.051±0.003
2.2 小鼠肝组织形态的光镜观察结果
从图1可看出,空白对照组肝组织结构及细胞形态正常,中央静脉及周围放射状肝细胞索清晰,肝索和肝窦比例正常.0.5mg/kg剂量组肝小叶结构完整,肝索和肝窦比例较正常.5mg/kg剂量组肝窦变窄,肝索增宽;肝细胞轻度水肿,体积增大、胞浆疏松化.50mg/kg剂量组肝小叶结构有所紊乱,肝窦宽窄不一,肝索拥挤、扭曲、变形;肝细胞损伤明显,可见病理性核分裂像.500mg/kg剂量组肝小叶结构紊乱;肝索、肝窦结构不清;肝细胞结构破坏,坏死明显.结果表明,随着染毒剂量的加大,小鼠肝细胞的病理损伤越严重.
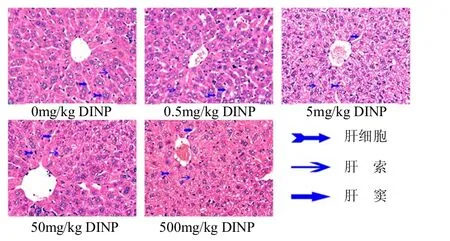
图1 不同DINP处理组肝组织切片图(10×40, HE染色)Fig.1 Liver slices of different DINP groups (10×40, HE dyed)
2.3 小鼠肝组织ROS含量的变化
ROS含量是反映机体氧化应激水平的指标,由图2可以看出,随着染毒剂量的升高,ROS含量逐渐上升,呈一定的剂量-效应关系.与对照组比较,0.5,5mg/kg剂量组差异无统计学意义,50,500mg/kg剂量组差异有统计学意义(P< 0.05).较高剂量的DINP能造成ROS含量的上升.
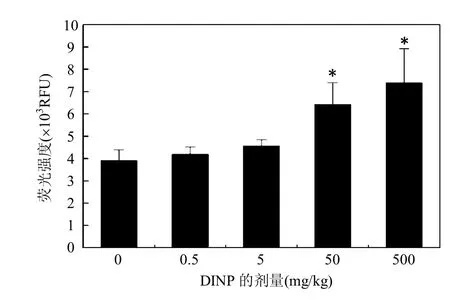
图2 不同DINP处理组小鼠肝脏ROS含量Fig.2 ROS content in mouse liver of different DINP groups
2.4 小鼠肝组织GSH含量的变化
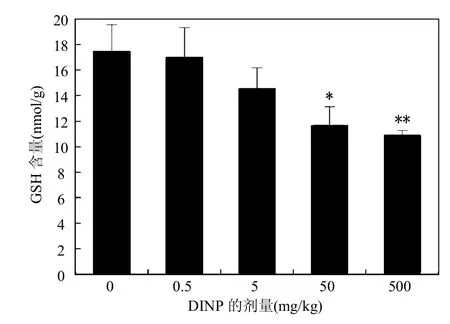
图3 不同DINP处理组小鼠肝脏GSH含量Fig.3 GSH content in mouse liver of different DINP groups
GSH是GPx(谷胱甘肽过氧化物酶)催化过氧化物还原的必需底物,可反映机体抗氧化应激的水平,由图3可以看出,随着DINP染毒剂量的升高,GSH含量逐渐下降,呈一定的剂量-效应关系.与对照组比较,0.5,5mg/kg剂量组差异无统计学意义,50,500mg/kg剂量组差异有统计学意义(P<0.05, P<0.01).在较高剂量的DINP作用下,小鼠肝的GSH含量下降明显.
2.5 小鼠肝组织MDA含量的变化
由图4可见,与对照组比较,不同剂量的DINP均能使小鼠肝MDA含量有不同程度的升高.0.5,5,50mg/kg剂量组差异无统计学意义,500mg/kg剂量组差异有统计学意义(P < 0.01),这表明小鼠肝组织的脂膜已受到损伤.
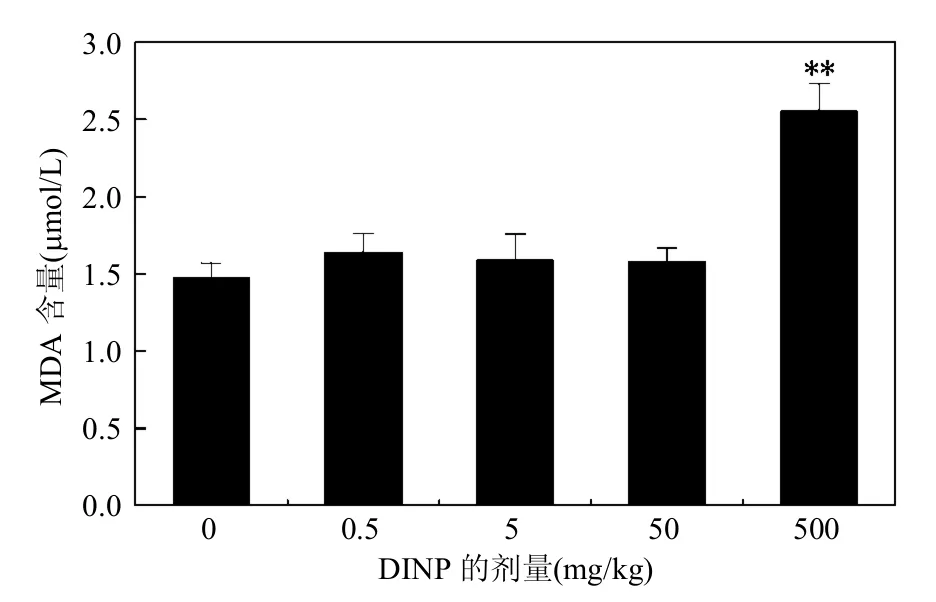
图4 不同DINP处理组小鼠肝脏MDA含量Fig.4 MDA content in mouse liver of different DINP groups
2.6 小鼠肝组织8-OHdG含量的变化
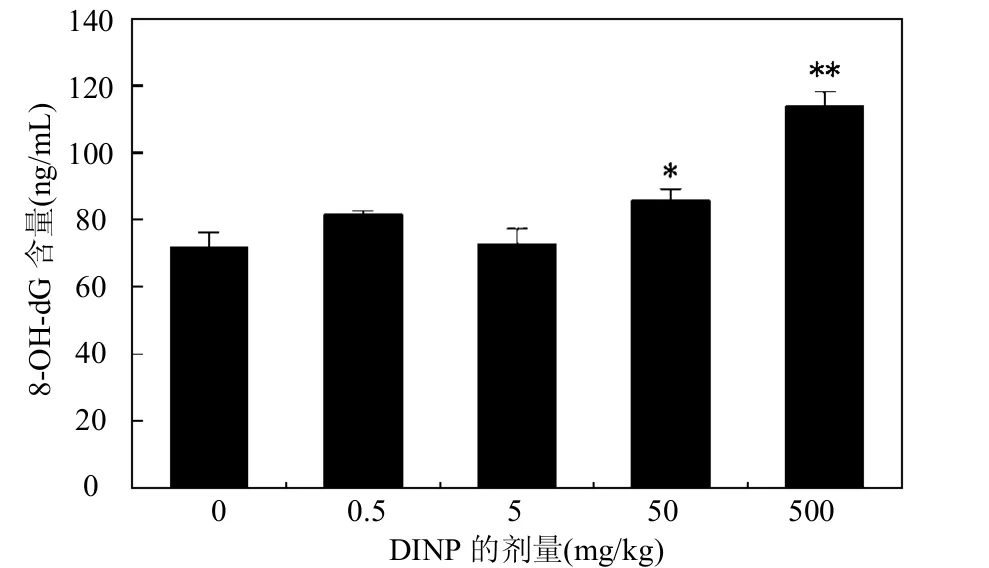
图5 不同DINP处理组小鼠肝脏8-OHdG含量Fig.5 8-OHdG content in mouse liver of different DINP groups
由图5可见, 与对照组比较,不同剂量的DINP能使小鼠肝8-OHdG含量有不同程度的升高.0.5,5mg/kg剂量组差异无统计学意义,50,500mg/kg剂量组差异有统计学意义(P< 0.05, P<0.01),在较高剂量的DINP作用下,小鼠肝脏的8-OHdG含量升高明显.
2.7 小鼠肝脏DPC系数的变化
用KCl-SDS沉淀法检测DPC系数,如图6所示,随着DINP染毒剂量的升高,DPC系数逐渐上升,呈一定的剂量-效应关系.0.5,5mg/kg剂量组差异无统计学意义,50,500mg/kg剂量组差异有统计学意义(P< 0.05, P< 0.01).
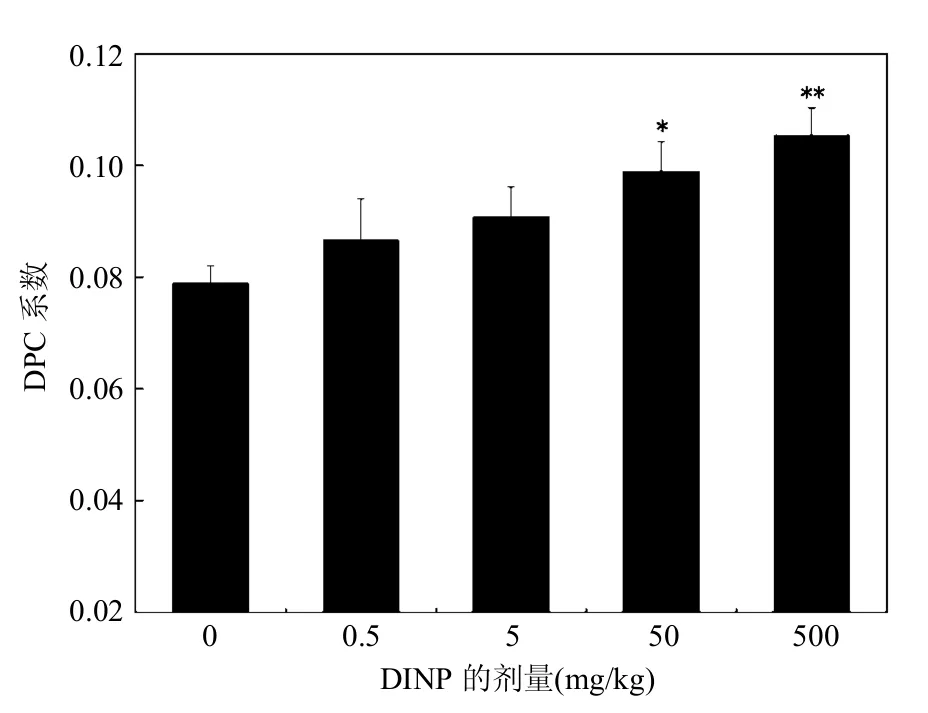
图6 不同DINP处理组小鼠肝脏DPC系数Fig.6 DPC coefficients in mouse liver of different DINP groups
3 讨论
细胞中ROS含量是反映细胞内氧自由基水平的主要指标[15].ROS在机体正常代谢状态下含量很低,在胞内信号转导的氧化还原调控中起重要作用[16];但过量活性氧物质(主要是ROS)的产生会破坏细胞内氧化和抗氧化之间的平衡,从而诱导机体产生氧化应激作用,氧化应激是许多疾病的重要发病机制[17-18].还原型的GSH可以和ROS结合形成硫代半缩醛,并通过抗坏血酸-谷胱甘肽循环生成具更强抗氧化作用的抗坏血酸[19].还原型的GSH是ROS的主要清除剂,它的消耗能反应机体的受氧化损伤程度[20-21],在评价氧化损伤中具有重要意义.本研究中,随着DINP染毒剂量的升高,ROS含量逐渐上升,GSH含量逐渐下降.与对照组比较,50,500mg/kg剂量组差异有统计学意义(P<0.05,P<0.01).说明在较高剂量DINP诱导之下小鼠肝组织细胞内产生了过量的ROS,受到ROS攻击,细胞的抗氧化能力下降.
过量的ROS还可使脂质发生过氧化反应,改变细胞膜的结构,使膜成分之间形成交联和聚合,影响膜受体、膜蛋白酶和离子通道的功能,甚至导致细胞死亡.脂质过氧化反应的主要代谢产物是MDA,其水平的高低代表脂质过氧化的强度[22-23].在本研究中,500mg/kg剂量组MDA含量与对照组差异有统计学意义(p < 0.01),这表明小鼠肝组织的脂膜已受到损伤.
8-OHdG是活性氧自由基攻击DNA 分子中的鸟嘌呤第8位碳原子而产生的一种氧化性加合物,它是活性氧基团引起的DNA 氧化损伤修饰产物之一.8-OHdG在体内稳定存在,为代谢终产物,且只能通过DNA 氧化损伤途径形成,是目前国际上公认的一种新型评价DNA氧化损伤和氧化应激状态敏感的生物标志物,测定机体8-OHdG含量对评估体内氧化损伤和修复程度有重要意义[24-25].ROS对细胞的氧化损伤作用还会引起DNA-蛋白质交联,DNA-蛋白质交联难以修复,对参与DNA复制、转录和修复的蛋白质活动起阻碍作用,增加了染色体畸变和姊妹染色单体交换[26].本研究中,不同剂量的DINP能使小鼠肝8-OHdG含量和DPC系数有不同程度的升高,与对照组比较,50,500mg/kg剂量组差异有统计学意义(P<0.05, P<0.01),说明较高剂量的DINP能使小鼠肝8-OHdG的形成以及DNA和蛋白质交联的增多,造成肝组织的DNA损伤.
4 结论
4.1 通过对肝组织进行病理学观察发现,随着DINP染毒剂量的升高,小鼠肝细胞的病理损伤越严重.染毒剂量为50mg/kg时,肝小叶结构有所紊乱,肝窦宽窄不一,肝索扭曲和变形;肝细胞损伤明显,可见病理性核分裂像.染毒剂量为500mg/kg时,肝小叶结构紊乱;肝索、肝窦结构不清;肝细胞结构破坏,坏死明显.
4.2 在较高剂量DINP诱导之下小鼠肝组织细胞内产生了过量的ROS,破坏了自身的氧化与抗氧化平衡,使细胞的抗氧化能力下降,间接引起了小鼠肝组织的脂质过氧化反应和8-OHdG的形成,以及DNA和蛋白质交联的增多,造成肝组织的氧化损伤和病理损伤.
[1]Allen D,陈悌递,初 征.增塑剂的选择与邻苯二甲酸酯的替代品 [J]. 塑料助剂, 2009,74(2):10-15.
[2]赵永富,郑 正,汪昌保,等.高能辐射去除饮用水中邻苯二甲酸酯的影响因素 [J]. 中国环境科学, 2013,33(3):430-435.
[3]Boberg J, Christiansen S, Axelstad M, et al. Reproductive and behavioral effects of diisononyl phthalate (DINP) in perinatally exposed rats [J]. Reprod Toxicol., 2011,31(2):200-209.
[4]Kaufmann W, Deckardt K, Mckee RH, et al. Tumor induction in mouse liver: di-isononyl phthalate acts via peroxisome proliferation [J]. Regul. Toxicol. Pharmacol.,2002,36(2):175-183.
[5]Saillenfait A M, Sabate J P, Gallissot F. Developmental toxic effects of diisobutyl phthalate, the methyl-branched analogue of di-n-butyl phthalate, administered by gavage to rats [J]. Toxicol. Lett., 2006,165(1):39-46.
[6]王立鑫,杨 旭.邻苯二甲酸酯毒性及健康效应研究进展 [J].环境与健康杂志, 2010,27(3):276-281.
[7]McKee R H, El-Hawari M, Stoltz M, et al. Absorption, disposition and metabolism of di-isononyl phthalate (DINP) in F-344rats [J]. Journal of Applied Toxicology, 2002,22(5):293-302.
[8]Zhang T, Sun H, Kannan K. Blood and urinary bisphenol A concentrations in children, adults, and pregnant women from China: Partitioning between blood and urine and maternal and fetal cord blood [J]. Environmental Science and Technology,2013,47(9):4686-4694.
[9]Frederiksen H, Skakkebaek N E, Andersson A M. Metabolism of phthalates in humans [J]. Molecular Nutrition and Food Research,2007,51(7):899-911.
[10]Lington A W, Bird M G, Plutnick R T, et al. Chronic toxicity and carcinogenic evaluation of diisononyl phthalate in rats [J]. Fundamental and Applied Toxicology, 1997,36:79-89.
[11]Moore M R. Oncogenicity study in rats with di (isononyl)phthalate including ancillary hepatocellular proliferation and biochemical analyses [R]. Covance Laboratories, 1998,Submitted under TSCA Section 8E; NTIS No.OTS0556283-2.
[12]Gray L E, Ostby J, Furr J, et al. Perinatal exposure to the phthalates DEHP, BBP, and DINP, but not DEP, DMP, or DOTP,alters sexual differentiation of the male rat [J]. Toxicological Sciences, 2000,58(2):350-365.
[13]McKee R H, El-Hawari M, Stoltz M, et al. Absorption, disposition and metabolism of di-isononyl phthalate (DINP) in F-344rats [J]. Journal of Applied Toxicology, 2002,22(5):293-302.
[14]Ma P, Wu Y, Zeng Q, et al. Oxidative damage induced by chlorpyrifos in the hepatic and renal tissue of Kunming mice and the antioxidant role of vitamin E [J]. Food and Chemical Toxicology, 2013,58:177-183.
[15]Raha S, Robinson B H. Mitochondria, Oxygen free radicals, disease and ageing [J]. Trends Biochem. Sci., 2000,25(10):502-508.
[16]Finkel T. Signal transduction by reactive oxygen species [J]. The Journal of Cell Biology, 2011,195:7-15.
[17]Govindasamy R, Rahuman A A. Histopathological studies and oxidative stress of synthesized silver nanoparticles in Mozambique tilapia (Oreochromis mossambicus) [J]. Journal of Environmental Sciences, 2012,24(6):1091-1098.
[18]Lin A J, Zhang X H, Chen M M, et al . Oxidative stress and DNA damages induced by cadmium accumulation [J]. Journal of Environmental Sciences, 2007,19:596-602.
[19]Valko M, Rhodes C J, Moncola J, et al. Free radicals, metals and antioxidants in oxidative stress-induced cance [J]. Chemico-Biological Interactions, 2006,160:1-40.
[20]Ma P, Luo Q, Chen J, et al. Intraperitoneal Injection of Magnetic Fe3O4-nanoparticle induces hepatic and renal tissue injury via oxidative stress in mice [J].International Journal of Nanomedicine,2012,7:4809-4818.
[21]刘锋明,刘旭东,闵安娜,等.邻苯二甲酸丁基苄酯对小鼠学习和记忆能力的影响 [J]. 中国环境科学, 2013,33(6):1106-1112.
[22]武 阳,常 青,杨 旭.不同浓度甲醛致大鼠肝细胞DNA氧化损伤作用 [J]. 环境科学学报, 2009,29(11):2415-2419.
[23]孙雪梅,刘碧云,鲁志营,等.焦性没食子酸对铜绿微囊藻的氧化胁迫效应研究 [J]. 中国环境科学, 2013,33(10):1835-1841.
[24]武 阳,常 青,杨 旭.8-羟基脱氧鸟苷在污染物遗传毒性研究中的应用分析 [J]. 公共卫生与预防医学, 2009,20(1):57-59.
[25]Kasai H. Analys is of a form of oxidative DNA damage,8-hydroxy-2-deoxyguanosine, as amarker of Cellular oxidative stress during carcinogenesis [J]. Mut. Res., 1997,387:147-163.
[26]Hong Y C, Lee K H. Enhancement of DNA damage and involvement of reactive oxygen species after exposure to bitumen with UVA irradiation [J]. Mutation Research, 1999,426(1):63-69.
Oxidative damage of mouse liver tissue induced by diisononyl phthalate.
LU Jie1, DAI Yuan-yuan1, LUO Hui1,GONG Jin-feng1, WANG Xu-yang1, WU Yang1,2, YANG Xu2, MA Ping1,2*(1.College of Basic Medical, Hubei University of Science and Technology, Xianning 437100,China;2.Laboratory of Environment Biomedicine, School of Life Science,Central China Normal University, Wuhan 430079, China). China Environmental Science, 2015,35(1):285~290
To investigate the oxidative damages of diisononyl phthalate on mouse liver cells, Kunming mice were randomly grouped into five groups and orally administered with drugs daily for fourteen days; the groups included one solvent control group, four diisononyl phthalate groups. The exposure doses of diisononyl phthalate groups were 0.5, 5, 50 and 500mg/kg respectively. Some liver tissues were then made into homogenates for the measurement of ROS (reactive oxygen species),GSH (glutathione), 8-hydroxy-2-deoxyguanosine (8-OHdG) and MDA (Malondialdehyde) contents. Meanwhile, DPC(DNA-protein Crosslink) coefficients were detected from liver cell suspension. The liver contents of ROS, MDA, 8-OHdG and DPC coefficients increased gradually in a dose-dependent manner, whereas GSH content decreased accordingly. In the exposure group with the dose of 50mg/kg, ROS, GSH, 8-OHdG contents and DPC coefficients were significantly higher than those of the control group (P<0.05, P< 0.01); There were significant differences in levels of each biomarker between 500mg/kg group and control group (P< 0.05,P< 0.01). Meanwhile liver tissues were sliced for physiological observation,the results showed that tissue injury were severed gradually with the increase of exposure concentration. diisononyl phthalate at certain doses (≥50mg/kg) can induce oxidative stress in mice liver.
reactive oxygen species;glutathione;malondialdehyde;8-hydroxy-2-deoxyguanosine;DNA-protein crosslinks;oxidative stress
X503.22
A
1000-6923(2015)01-0285-06
陆 杰(1992-),男,湖北咸宁人,湖北科技学院本科生,主要从事环境毒理学研究.
2014-04-07
湖北省大学生创新训练计划项目(201310927010);湖北省自然科学基金项目(2014CFB284);国家自然科学基金重点项目(51136002)
* 责任作者, 教授, mping68@126.com
