组织多肽特异性抗原与血管内皮生长因子与乳腺癌患者病理分级关系研究
2015-11-17陈道宝杨红健陈波俞星飞封伟亮
陈道宝,杨红健,陈波,俞星飞,封伟亮
(浙江省肿瘤医院 乳腺外科,浙江 杭州 310022)
乳腺癌是因为乳腺上皮细胞遭到雌酮及雌二醇的刺激而出现乳腺小叶上皮高度增生或不典型增生的恶性疾病,为女性最常见的恶性肿瘤之一[1],多发于中年女性,近年来男性乳腺癌的发病率逐渐升高,据调查统计[2],我国乳腺癌患者占全身各种恶性肿瘤的7%~10%,在一些大城市中乳腺癌的发病率已上升为第一位。目前临床上采取手术为主、放化疗为辅的综合治疗方法[3]。早期诊断治疗对乳腺癌早期防治有非常重要的作用,目前常用的乳腺癌标志物如CA153、CEA、CA125等对乳腺癌的敏感性很低,即使乳腺癌Ⅲ期患者CA153、CEA、CA125的敏感性也只有50%以下[4]。研究发现[5],组织多肽特异性抗原(TPS)及血管内皮生长因子(VEGF)是肿瘤细胞增殖活性的特异性标志物,能够特异性反应细胞增殖和血管新生的程度。本研究通过观察乳腺癌患者TPS、VEGF表达水平,来探究TPS、VEGF与乳腺癌临床病理特征的关系,现报道如下。
1 资料与方法
1.1 一般资料 选取2012年1月~2014年4月收入浙江省肿瘤医院诊断为乳腺癌的女性患者68例作为实验组,诊断为乳腺纤维瘤的女性患者36例作为对照组,年龄在30~70岁,实验组平均年龄(50.6±12.4)岁,其中35例病灶位于左侧乳腺,33例病灶位于右侧乳腺;浸润性导管癌为57例,非浸润导管癌11例;对照组平均年龄(51.2±11.7)岁,19例患者病灶位于左侧乳腺,17例患者病灶位于右侧。2组患者的年龄、文化程度、家庭背景等一般资料差异无统计学意义,具有可比性。
1.2 诊断标准 根据乳腺肿瘤临床治疗指南确定乳腺癌诊断标准[6]:①患者患侧乳头不明原因的出现乳汁或者液体分泌;②患侧乳头及皮肤发现改变,如酒窝症、橘皮样改变、乳头内陷;③患侧乳房能触及不规则、活动度差的肿块;④乳腺癌彩超示乳房内肿块边界不清,回声不均,有钙化或液化灶,胸大肌和皮下脂肪与肿块的边界不清;⑤乳腺癌钼靶X线示边缘牛角状或毛刺状改变的肿块影,肿块周围组织可见粗大的血管影;⑥病理活检及术后病理是诊断乳腺癌的金标准。
1.3 纳入标准 符合乳腺癌的诊断标准,患者年龄在30~70岁;术前检查中未发现腋窝淋巴结肿大的证据;患者以及家属对本研究具体情况了解知情并自愿参与和签署知情同意书;本研究已获得本医院的伦理学相关机构批准授权。
1.4 排除标准 ①精神、神志异常不能配合者;②患有严重心、肝、肾、肺、脑疾病者;③患有肺癌、肝癌、肾癌、脑癌等其他恶性肿瘤者;④患有艾滋病、梅毒、病毒性肝炎、结核等传染病者;⑤患有再障、白血病等血液性疾病者;⑥近3个月服用抗肿瘤药物或者接受过肿瘤治疗的患者。
1.5 方法 实验组和对照组于手术前、后抽取空腹肘静脉血3mL加入含EDTA-K2抗凝剂的真空管中混匀,根据乳腺肿瘤临床治疗指南[6],实验组患者予以乳腺癌改良根治术,对照组患者予以乳腺纤维瘤切除术,实验组患者在术后第5日清晨空腹抽取静脉血3mL加入含EDTA-K2抗凝剂的真空管中混匀。所有静脉血均分离血清,置于-20℃的冰箱里保存待测。采用ELISA检测法检测两组患者血清中TPS和VEGF水平,TPS超过4.5 ng/mL时为阳性,VEGF超过125 ng/mL时为阳性。TPS试剂盒为美国BPB Biomedicals公司提供,VEGF试剂盒由美国R&D公司提供。
1.6 统计学方法 使用统计学软件SPSS17.0进行统计学分析,正态计量资料用“±s”表示,组间比较采用t检验;计数资料用以例数或者百分比或率表示,用χ2检验处理,相关性分析采用Spearman相关,P<0.05表示差异有统计学意义 。
2 结果
2.1 2组患者血清中TPS、VEGF水平比较 实验组患者血清中TPS、VEGF阳性率及水平显著高于对照组,差异有统计学意义(P<0.05),见表1。
表1 术前2组患者血清中TPS、VEGF水平比较情况(±s)Tab.1 Comparison of TPS、VEGF before operation(±s)
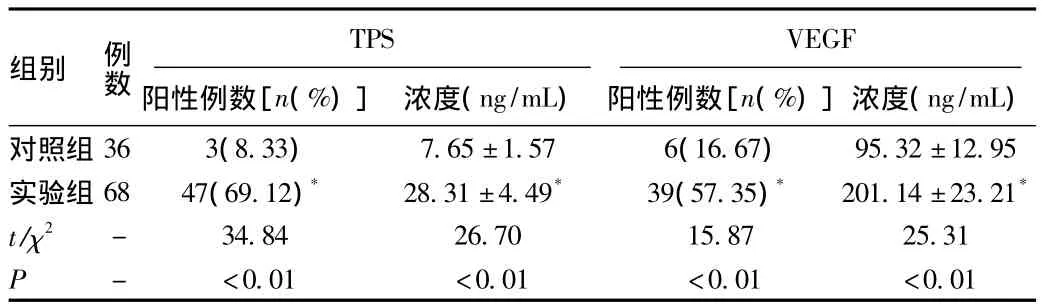
表1 术前2组患者血清中TPS、VEGF水平比较情况(±s)Tab.1 Comparison of TPS、VEGF before operation(±s)
*P<0.01,与对照组比较,compared with control group
组别 例数TPS阳性例数[n(%)]浓度(ng/mL)VEGF阳性例数[n(%)]浓度(ng/mL)对照组36 3(8.33) 7.65±1.57 6(16.67)95.32±12.95实验组68 47(69.12)* 28.31±4.49* 39(57.35)* 201.14±23.21*t/χ2 - 34.84 26.70 15.87 25.31 P - <0.01 <0.01 <0.01 <0.01
2.2 术后实验组血清中TPS、VEGF水平比较 术后治疗后血清中TPS、VEGF水平均明显低于术前水平,差异有统计学意义(P<0.01),见表2。
表2 实验组血清中TPS、VEGF水平比较情况(±s,ng/mL)Tab.2 Comparison of TPS,VEGF of experiment group(±s,ng/mL)
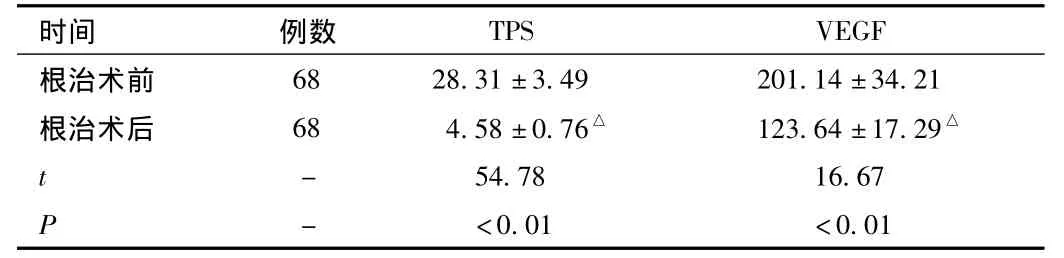
表2 实验组血清中TPS、VEGF水平比较情况(±s,ng/mL)Tab.2 Comparison of TPS,VEGF of experiment group(±s,ng/mL)
△P<0.01,与根治术后比较,compared with after operation
?
2.3 不同期别乳腺癌患者血清中TPS、VEGF水平比较TPS、VEGF水平0期与Ⅰ期比较差异有统计学意义(P<0.05),Ⅰ~Ⅲ期 TPS、VEGF水平随着乳腺癌期别浓度升高,其余两两比较,TPS、VEGF水平具有明显差异,差异有统计学意义(P<0.05),如表3。
表3 不同时期乳腺癌患者血清中TPS、VEGF水平比较(±s,ng/mL)Tab.3 Comparison of TPS,VEGF at different times of breast cancer patients(±s,ng/mL)

表3 不同时期乳腺癌患者血清中TPS、VEGF水平比较(±s,ng/mL)Tab.3 Comparison of TPS,VEGF at different times of breast cancer patients(±s,ng/mL)
#P<0.05,与0期比较,compared with grade 0;*P<0.05,与Ⅰ期比较,compared with gradeⅠ;△P<0.01,与Ⅱ期比较,compared with gradeⅡ
TNM分期 例数TPS VEGF 0 11 8.26±1.09 113.58±12.94Ⅰ19 13.94±2.18# 154.28±24.25#Ⅱ25 34.57±3.32#* 205.75±18.42#*Ⅲ13 51.95±4.15#*△ 275.31±21.63#*△
2.4 乳腺癌患者TPS、VEGF表达与临床分期的相关性 乳腺癌患者TPS与临床分期的相关性(r=0.876,P<0.01),乳腺癌患者VEGF表达与临床分期的相关性(r=0.903,P<0.01)。
2.5 乳腺癌患者血清中TPS、VEGF表达与临床病理特征的关系比较 68例原发性乳腺癌患者,肿瘤直径≤2 cm与肿瘤直径>2 cm比较,血清中TPS表达无统计学差异,VEGF表达水平在肿瘤直径≤2 cm组明显低于肿瘤直径>2 cm组,差异有统计学意义(t=29.33,P<0.05);腋下淋巴结转移组与腋下淋巴结无转移组患者血清中TPS和VEGF浓度差异有统计学意义,(t值分别为49.76,19.54,P<0.05);TPS和VEGF浓度在淋巴结转移数目≤3个和>3之间没有差异,TPS浓度水平在雌激素受体阴性、孕激素受体阴性中明显高于雌激素和孕激素阳性组(t值分别为26.58,20.59,P<0.05);VEGF浓度水平在雌激素受体、孕激素受体阴性组和阳性组中差异无统计学意义,见表4。
表4 乳腺癌患者血清中TPS、VEGF表达与临床病理特征的关系比较(±s,ng/mL)Tab.4 Comparison of TPS,VEGF of clinicopathological characteristics(±s,ng/mL)
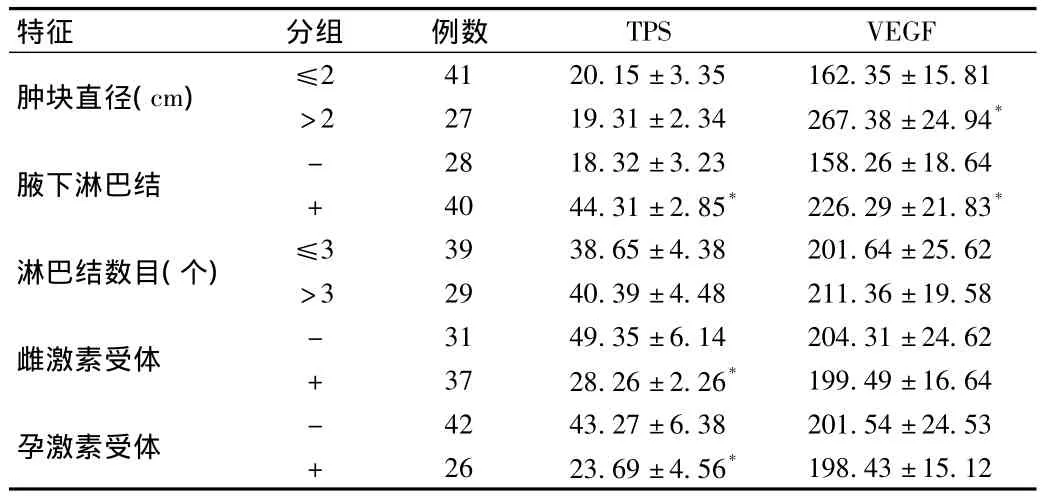
表4 乳腺癌患者血清中TPS、VEGF表达与临床病理特征的关系比较(±s,ng/mL)Tab.4 Comparison of TPS,VEGF of clinicopathological characteristics(±s,ng/mL)
*P<0.05,相同特征的两两比较,compared with the same features
特征 分组 例数TPS VEGF肿块直径(cm) ≤2 41 20.15±3.35 162.35±15.81>2 27 19.31±2.34 267.38±24.94*腋下淋巴结 - 28 18.32±3.23 158.26±18.64+ 40 44.31±2.85* 226.29±21.83*淋巴结数目(个) ≤3 39 38.65±4.38 201.64±25.62>3 29 40.39±4.48 211.36±19.58雌激素受体 - 31 49.35±6.14 204.31±24.62+ 37 28.26±2.26* 199.49±16.64孕激素受体 - 42 43.27±6.38 201.54±24.53+ 26 23.69±4.56*198.43±15.12
3 讨论
乳腺癌在女性恶性肿瘤的发病率为第一,严重威胁女性生命健康。乳腺作为多种内分泌激素的靶器官,常因雌酮及雌二醇激素刺激而引起乳腺上皮细胞增生,再加上环境、饮食等因素延长或加强对乳腺上皮的刺激,使增生恶性改变,从而出现乳腺癌[7]。乳腺癌好发于中年妇女,年轻女性乳腺癌发病率较小,但近年来随着人民饮食习惯、环境因素、工作压力等原因,年轻女性乳腺癌的发病率呈逐年上升的趋势。乳腺癌早期诊断是预防乳腺癌、治疗及提高女性生活质量的重要途径,但目前临床常用乳腺癌肿瘤标志物的敏感性较差,无法作为早期诊断和筛查乳腺癌的依据,研究表明[8],TPS能够特异性反映肿瘤细胞的增生程度,VEGF能够反映新生血管的重要调节因子,通过检测患者TPS、VEGF水平能够反映机体肿瘤的发生。
本研究结果显示,与手术前相比,乳腺癌进行根治术后患者血清中TPS、VEGF水平明显降低(P<0.05),手术切除了病变的乳腺,阻止了乳腺上皮细胞的大量增殖恶变,从而减少了TPS的表达,释放入血的TPS也随之减少;恶性病灶的切除,患者机体内没有新生物的需要新生血管进行营养供应,体内的VEGF的分泌也随之减少,因此,乳腺癌根治术后患者血清中TPS、VEGF表达水平明显降低,甚至降至正常水平。
组织多肽特异性抗原(TPS)是位于细胞角蛋白18片段上的M3抗原决定簇,细胞角蛋白在上皮细胞及上皮源性恶性细胞中大量存在,而不存在其他组织细胞中,因此TPS能够特异性反应上皮来源恶性肿瘤增殖活跃程度[9]。当上皮源性恶性细胞大量增殖,TPS将大量表达并大量释放入血,血清中TPS含量的高低反映上皮源性恶性细胞的增殖分裂程度,在上皮源性恶性肿瘤的诊断、评估和预后提供了重要的依据[10]。血管内皮生长因子(VEGF)是肝素结合活性的同源二聚体多肽,具有强大的血管渗透功能,在肿瘤细胞生长和新生血管建立过程中提供营养,并能促进内皮细胞分裂和血管重建,加速肿瘤新生血管的形成,血清中VEGF水平增高为肿瘤的生长、浸润和转移提供重要的诊断依据[11]。本研究结果示,乳腺癌患者血清中TPS、VEGF水平高水平表达,提示TPS、VEGF可作为乳腺癌早期诊断的肿瘤标志物。乳腺癌为乳腺上皮细胞增生恶变,乳腺上皮细胞增殖时释放大量的TPS入血,新生物需要营养供应,刺激新生瘤体分泌VEGF生成新血管为新生物提供营养。
实验研究结果显示,随着TNM分期的增加,患者血清中TPS和VEGF表达水平也随之升高,说明血清中TPS和VEGF与乳腺癌的临床分期关系密切。TNM分期越早,说明肿瘤越局限,TNM分期越晚则肿瘤的范围越大,细胞分裂增殖越活跃,也需要大量的营养供应,因此TPS和VEGF高水平表达,提示肿瘤分期越晚,同时也提示患者预后越差。
研究显示[12],血清中TPS水平与肿瘤大小无关,而VEGF表达水平与肿瘤大小关系密切。TPS水平的表达取决于肿瘤细胞生物学的活性,即使肿瘤负荷小,若肿瘤细胞分裂增殖活跃,TPS仍可处于一个高水平的表达;肿瘤的生长、浸润和转移需要新生血管的营养供应,当肿瘤的直径大于2 mm时就需要新生血管进行营养供应,肿瘤直径越大则需要更多的新生血管进行营养支持,VEGF能够促进肿瘤新生血管的构建,故VEGF表达水平能够反映肿瘤负荷的敏感性指标[13]。淋巴转移是乳腺癌主要的转移方式,腋窝淋巴结是乳腺癌最常见转移的浅表淋巴结,腋窝淋巴结转移与否是评价乳腺癌预后的重要指标之一[14]。研究结果显示[15],TPS和VEGF水平在有淋巴转移组中明显高于无淋巴结转移组,提示TPS和VEGF表达水平与腋窝淋巴结转移关系密切,同时乳腺癌患者血清中TPS和VEGF水平高表达,提示患者有腋窝淋巴结转移的可能,预后较差;本研究结果显示,雌激素受体和孕激素受体阴性组TPS水平明显高于阳性组,说明TPS水平与雌激素和孕激素关系密切。研究发现[16],雌激素和孕激素受体阳性乳腺癌患者相对于激素受体阴性患者肿瘤分化较好,恶性度较低,转移发生率较低,内分泌治疗敏感。高分化肿瘤细胞分离增殖活跃度较低,分泌释放入血的TPS水平较低,故乳腺癌患者TPS水平可对乳腺癌治疗进行评估具有一定的指导意义。
综上所述,乳腺癌患者血清中TPS和VEGF水平呈现高表达,可用作乳腺癌早期诊断的肿瘤标志物;血清中TPS水平在淋巴结转移、雌激素受体阳性、孕激素受体阳性中呈高表达,提示TPS水平可作为乳腺癌评估和预后的重要指标;血清中VEGF水平在肿瘤大小及淋巴结转移中呈现高表达,提示VEGF水平可作为肿瘤负荷和预后的评估指标。
[1]徐兵河.乳腺癌内科治疗的现状及展望[J].癌症进展,2004,2(1):10-15,22.
[2]李霓,郑荣寿,张思维.中国城乡女性乳腺癌发病趋势分析和预测[J].中华预防医学杂志,2012,46(8):703-707.
[3]宣立学,张保宁.保乳术在乳腺癌治疗中的应用[J].中国实用外科杂志,2003,23(10):589-591.
[4]鲁传翠,张珏,陈建中.乳腺浸润性导管癌患者联合检测 CA27-29和CA15-3的临床分析[J].标记免疫分析与临床,2014,21(5):535.
[5]薛永飞,任中海,沈艳丽.癌相关抗原153,癌胚抗原,p53抗体及组织多肽特异性抗原在老年乳腺癌患者血清中的表达及其临床意义[J].中国老年学杂志,2014,3:118.
[6]乳腺癌HER2检测指南(2009版)[J].中华病理学杂志,2009,38(12):836-840.
[7]杨玲,李连弟,陈育德.中国乳腺癌发病死亡趋势的估计与预测[J].中华肿瘤杂志,2006,28(6):438-440.
[8]王淑玉,宋玉,马运华.四种肿瘤标志物诊断乳腺癌的价值探讨[J].山东医药,2012,52(7):85-86.
[9]高洪波,巩平,李娜.组织多肽特异性抗原 (TPS)临床研究进展[J].现代肿瘤医学,2010,18(3):602-605.
[10]郑航,何本夫,罗荣城,等.组织多肽特异性抗原在乳腺癌中的临床研究[J].第一军医大学学报,2004,23(8):823-825.
[11]李志刚,黄桂林.青年乳腺癌VEGF-C和VEGFR-3的表达及其与临床病理关系的研究[J].临床和实验医学杂志,2012,11(11):821-822.
[12]顾咸庆,杨雪琴,杨宇馨,等.APE1和VEGF在非小细胞肺癌组织中的表达及其与肿瘤血管生成和预后的关系[J].重庆医学,2012,41(11):1047-1050.
[13]李静,桂琳,金强,等.血管内皮生长因子与血液肿瘤的相关性研究[J].蚌埠医学院学报,2012,37(3):364-367.
[14]黄玉钿,张声,郑曦,等.抑癌基因PTEN和血管内皮生长因子-C表达与乳腺癌淋巴管密度的相关性及其临床意义[J].中国免疫学杂志,2012,27(9):783-786.
[15]吴世凯,宋三泰.对乳腺癌雌孕激素受体检测的认识[J].中华乳腺病杂志 (电子版),2012,6(3):39-41.
[16]周力恒,殷文瑾,陆劲松,等.雌激素受体阳性孕激素受体表达不同的乳腺癌患者肿瘤特征比较[J].中华医学杂志,2007,39:2764-2767.
