苝酐衍生物功能化空心纳米金电致化学发光铅离子传感器的研究
2015-11-16李雪陈安懿卓颖袁若
李雪+陈安懿+卓颖+袁若


摘 要 基于目标物循环放大策略及苝酐衍生物功能化纳米探针,构建了超灵敏的电致化学发光(ECL)传感器用于Pb2+检测。将发卡型DNA底物链通过分子自组装固载于沉积纳米金的玻碳电极表面,当目标物Pb2+及脱氧核酶(DNAzyme)存在时,底物链被剪切,在电极上留下单链DNA,同时释放出的Pb2+和DNAzyme可进入下一个循环,继续对未剪切的底物链进行剪切。剪切得到的单链DNA可与辅助探针H1的一端杂交,H1的另一端可与标记有苝酐衍生物功能化空心纳米金的发夹探针H2杂交。随着Pb2+浓度的增加,更多的信号探针被捕获,使得电极上产生的ECL信号逐渐增强。在Pb2+不存在时,底物链不能被剪切,信号探针不能被捕获,ECL信号低。本传感器在1×10
2 ~1×106 mol/L的浓度范围内对Pb2+有良好的线性响应,检出限为1×1012 mol/L(S/N=3)。传感器对常见的金属离子表现出良好的选择性。
关键词 电致化学发光; Pb2+; S2O28/O2; 苝酐衍生物; 空心纳米金
1 引 言
Pb2+是一种广泛分布在环境及水体中的重金属污染物,摄入过量Pb2+对人体尤其是儿童的神经系统、免疫系统造成损伤,导致智力发育延迟[1,2]。目前,在国家标准方法[3,4]的基础上,已发展了许多新的Pb2+检测方法,包括流动注射火焰炉原子吸收光谱法[5,6]、电感耦合等离子发射法[7,8]、荧光光谱法[9]、表面增强拉曼散射光谱法[10]等。然而,这些检测方法通常需要精密的仪器、熟练的技术人员,不适于推广使用。因此,发展低成本、简单灵敏的Pb2+检测方法具有重要实际意义。
电致化学发光(ECL)是一种背景信号低、灵敏度高、可控性强、选择性好、动力学响应范围宽、重现性好、检出限低的分析检测技术。近年来,ECL技术在环境分析领域受到广泛关注。例如,Huang等[11]基于“T-Hg2+-T”的特异性结合和四氟硼酸二(2,2′-联吡啶)(二吡啶并吩嗪)合钌 [Ru(bpy)2(dppz)](BF4)2(bpy=bipyridine,dppz=dipyrido [3,2-a:2′,3′-c] phenazine)嵌入DNA骨架,构建了一个简单灵敏的检测Hg2+的ECL生物传感器;Qiu等[12]基于点击反应 “铜催化叠氮-炔丙基反应”,通过炔丙基功能化的钌掺杂的二氧化硅纳米颗粒与修饰在金电极上的叠氮化合物的反应,设计了一个检测Cu2+的高灵敏高选择性的ECL传感器。现有的ECL发光体系[13~15]主要有Ru(bpy)2+3及其衍生物、Luminol及其衍生物、量子点和S2O2
8/O2体系。其中,S2O2
8/O2发光体系是近年来发展起来新的发光体系,具有反应试剂价廉易得的优点,已被用于检测凝血酶[16]、促甲状腺激素(TSH)[17]等生物大分子。但是基于S2O2
8/O2的ECL体系检测Pb2+的方法还未见报道。
研究发现苝酐衍生物功能化空心纳米金能极大增强S2O2
8/O2体系的ECL信号[18]。本研究利用以Pb2+为辅酶因子的脱氧核酶实现目标物循环,将苝酐衍生物功能化空心纳米金标记在发夹型探针H2上作为信号探针,构建了一种超灵敏的ECL传感器用于Pb2+的检测。首先在玻碳电极表面沉积纳米金,固定含有Pb2+特异性识别位点的发夹型DNA底物链H0。在Pb2+存在时, H0被剪切,在电极上留下单链DNA片段,同时目标物被释放, 对余下底物链进行循环剪切。剪切后留在电极上的单链DNA片段能够打开发夹型辅助探针H1,进而结合信号探针H2-HGNPs-PTCA-L-Cys。Pb2+浓度越大,传感器表面的捕获信号探针越多,在S2O2
8底液中的ECL信号越强。
2 实验部分
2.1 仪器与试剂
MPI-E型电致化学发光分析系统(西安瑞迈分析仪器有限责任公司);CHI660C电化学工作站(上海辰华仪器有限公司);S4800 扫描电子显微镜(日本日立有限公司)。电致化学发光采用三电极系统:玻碳电极(GCE, Φ=4.0 mm)及其修饰电极作工作电极,铂丝为对电极,Ag/AgCl(饱和KCl)参比电极。
苝四甲酸二酐(3,4,9,10-perylenete-tracarboxylic dianhydride,PTCDA,纯度98%, 辽宁联港染料化工有限公司);L-半胱氨酸L-Cys,纯度99%),6-巯基己醇(MCH,纯度97%, 购于北京百灵威科技有限公司);氯金酸(HAuCl4· 2O,纯度99.9%)为沈阳有色金属研究院试剂;N-(3-二甲基氨丙基)-N-2-乙基碳二亚胺盐酸盐(EDC,纯度99%),N-羟基琥珀酰亚胺(,NHS,纯度98%)购于上海共价化学科技有限公司;Pb(NO3)2(纯度99%),三羟甲基氨基甲烷(Tris,纯度99.5%),柠檬酸钠(纯度99%),NaBH4(纯度97%),六水合氯化钴(CoCl2·6H2O,纯度99%),Na2S2O8(纯度98%),NaOH(纯度98%, 购于成都科龙化工。实验用水均为 Milli-Q 超 纯水(电阻率 18.2 MΩ cm)。核酸序列由上海生工生物工程有限公司合成,如表1 所示。
2.2 实验方法
2.2.1 空心纳米金(HGNPs)的制备 参考文献[19]方法制备空心纳米金。在N2氛围中,持续搅拌,以1 min的时间间隔依次将200 μL柠檬酸钠溶液(0.1 mol/L)、200 μL 新制的NaBH4溶液(1 mol/L)、50 μL CoCl2·6H2O溶液(0.5 mol/L),加入到50 mL去离子水中。45 min后,以2 min的时间间隔加3次1% HAuCl4溶液(每次50 μL),反应15 min,移去开N2氛围直到溶液颜色由黑褐色变为深蓝色离心并用去离子水洗涤沉淀3次,最终所得沉淀加1 mL去离子水分散,4℃保存备用。endprint
2.2.2 苝四甲酸和L-半胱氨酸复合物(PTCA-L-Cys)的制备 称取苝四甲酸二酐(PTCDA) 0.09 g,加6 mL NaOH 溶液(1 mol/L)溶解,用HCl调至pH 4~6,加入新制的1mL EDC-NHS溶液(0.04 mol/L EDC, 0.01 mol/L NHS),4℃下活化100 min。再加入L-Cys 0.1 g, 持续搅拌36 h,溶液离心,用去离子水洗涤3次,所得沉淀用5 mL 去离子水分散,4℃保存备用。
2.2.3 信号探针(H2-HGNPs-PTCA-L-Cys)的制备 取2 mL HGNPs溶液,搅拌下加入PTCA-L-Cys溶液 10 μL,10 min后加入10 μL核苷酸序列 H2,在4℃下搅拌过夜,收集溶液,4℃保存备用。
2.2.4 ECL传感器制备过程 首先将玻碳电极(GCE)用Al2O3粉抛光,清洗后晾干。浸入1% HAuCl4溶液, 0.2 V恒电位沉积30 s,得到纳米金修饰电极(depAu/GCE)。滴加10 μL 发夹型底物链H0 (1×10
6 mol/L) 孵育过夜,通过H0的3′端氨基与纳米金形成的AuN键[20]作用固定H0链,得到H0修饰电极(H0/depAu/GCE);随后电极表面用1×10
3 mol/L MCH封闭0.5 h,得到MCH修饰电极(MCH 0/depAu/GCE)。
3 结果与讨论
3.1 传感器的工作原理
在组装的传感器表面滴加上样品溶液(含1×10
6 mol/L 脱氧核酶(DNAzyme)和不同浓度的Pb(NO3)2标准溶液的pH 8.0的Tris-HCl(0.1 mol/L))孵育1 h。当Pb2+存在时,以Pb2+为辅酶因子的脱氧核酶(DNAzyme)可以对嵌入腺嘌呤核苷的发夹型底物链H0在Pb2+特异性识别位点进行剪切[10],从而在电极表面留下能打开辅助探针H1的单链DNA片段,并释放出目标物Pb2+和脱氧核酶(DNAzyme),使之进入下一个剪切循环。经过N次循环剪切后,用超纯水清洗电极表面,再与辅助探针H1孵育1 h,最后与信号探针H2孵育1 h,然后在S2O2
8溶液中进行ECL检测,ECL信号大小与Pb2+浓度成正比。传感器工作过程如图1所示。
3.2 HGNPs和HGNPs-PTCA-L-Cys复合物的SEM表征
图2A为 HGNPs的SEM图像,可以看到HGNPs的边缘比中心要亮很多,是表面光滑的空心球体;图2B为HGNPs-PTCA-L-Cys复合物的SEM图像,可以清楚的看到球体表面被一些小颗粒覆盖,不再是光滑的球面,表明空心纳米金的表面被PTCA-L-Cys功能化。
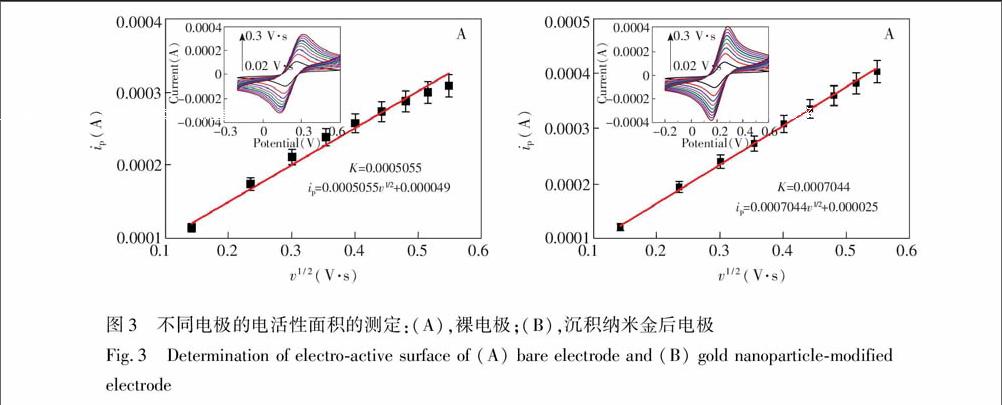
3.3 电极表面电活性面积表征
当玻碳电极表面修饰上物质时,其电活性面积会发生变化。电活性面积的计算的依据是Randles-Sevcik方程[21]:
ip=2.69×105n3/2D1/2v1/2Ac(1)
式中ip为峰电流(A),n为电子转移数,D为扩散系数(在25℃ 时为6.7±0.2×106 cm2/s),v为电位扫描速率(V/s),A为电极表面积(cm2),c为被测物质的浓度(mol/L)。如图3所示,采用循环伏安法(CV)对裸电极(图3A)与沉积纳米金(图3B)后的电极在pH为7.4的磷酸盐缓冲溶液中(含有5×103 mol/L的[Fe(CN)6]3/4和0.1 mol/L KCl),以0.035 V/s的梯度从0.02~0.3 V/s在
0.2~0.6 V的电位范围内进行实验。得到的还原峰电流值(ip)与扫速的平方根(v1/2)在0.02~0.3 V/s的梯度扫速有良好的线性响应,裸电极和沉积纳米金的电极的线性方程分别为: ip=0.0005055υ1/2+0.000049和ip=0.0007044v1/2+0.000025。根据Randles-Sevcik方程计算,得到电活性面积分别为14.5 mm2和20.2 mm2,由此表明, 纳米金成功的修饰在了电极上。
3.4 修饰电极的CV表征
ECL传感器的构建过程采用循环伏安法(CV)表征。如图4所示,裸电极上显示了一对准可逆的氧化还原峰(曲线a)。在裸电极上沉积金(depAu)后,由于纳米金能够增加电极的有效表面积,峰电流增大(曲线b);接着将发卡型底物链H0孵育在电极上,电极表面的负电荷增多,阻碍探针与电极间的电子转移,峰电流值下降(曲线c);滴加MCH封闭非特异性结合位点,进一步了阻碍电子传递,电流继续下降(曲线d)。与含有脱氧核酶(DNAzyme)和不同浓度Pb2+的样品溶液孵育后,发生剪切反应,使得发卡型底物链H0变为较短的DNA单链片段,电极表面的负电荷减少,对[Fe(CN)6]3/4
的排斥作用减弱,探针与电极间的电子转移阻碍减小,电流略有增加(曲线e); 与H1育后,它的一端与电极上残留的单链DNA片段发生杂交,生成双链DNA,电极表面物质量增加,且负电荷增多,进一步阻碍探针与电极间的电子转移,峰电流降低(曲线f)加入纳米信号探针H2-HGNPs-PTCA-L-Cys孵育后,H1的另一端与有标记物的H2杂交生成DNA双链,更进一步阻碍电子传递,峰电流也随之降低(曲线g)。
3.5 修饰电极的ECL表征
采用ECL对传感器的组装过程做了表征(图5)。电致化学发光参数设置为:光电倍增管高压800 V,扫描速率0.2 V/s,扫描电位
1.5~0 V,放大级数为3级。如图5A所示,裸玻碳电极在表现出明显的ECL信号(曲线a);在电极表面沉积纳米金后,电极的有效比表面积增加,ECL响应信号增强(曲线b);修饰上H0后,由于负电性DNA阻碍电子传递,ECL响应信号降低(曲线c);接着用MCH封闭非特异性结合位点,进一步阻碍了电子的传递,使得ECL响应信号继续降低(曲线d)。将上述电极与DNAzyme和Pb2+孵育后,发卡型底物链被剪切,在电极上留下单链DNA片段,,ECL信号强度略有增加(曲线e);加入H1与,与电极上残留的单链DNA片段发生杂交,生成双链DNA进一步阻碍电子传递,ECL响应信号降低(曲线f)。加入信号探针H2-HGNPs-PTCA-L-Cys为最佳,由于苝四甲酸复合物功能化的空心纳米金能增强过硫酸根体系的ECL信号,ECL信号极大增加(曲线g)。图5B对比了在H2上标记空心纳米金和PTCA-L-Cys功能化空心纳米金产生的ECL信号。当信号探针H2上标记了HGNPs时,ECL信号明显增强;而标记PTCA-L-Cys- HGNPs后,ECL信号显著增强,从而提高了Pb2+检测的灵敏度。endprint
图5 不同修饰电极的ECL表征。0.1 mol/L PBS (pH 7.4,含0.1 mol/L K2S2O8)底物溶液,电位范围为1.5~0 V时。A为电极的修饰过程表征: a. GCE,b.depAu/GCE,c. H0/depAu/GCE,d. MCH 0/depAu/GCE,e. DNAzyme+Pb2+/MCH 0/depAu/GCE,f. H1/DNAzyme+ Pb2+/MCH 0/depAu/GCE,g. H2-HGNPs 1/DNAzyme+Pb2+/MCH 0/depAu/GCE, h. H2-HGNPs-PTCA- L-Cys 1/DNAzyme+ Pb2+/MCH 0/depAu/GCE; B为不同信号标记物的ECL信号对比。
Fig.5 ECL characterization of different electrodes in 0.1 mol/L K2S2O8 . (A) modification process of electrode. a. GCE, b. depAu/GCE, c. H0/depAu/GCE, d. MCH 0/depAu/GCE, e. DNAzyme+Pb2+/MCH 0/depAu/GCE, f. H1/DNAzyme +Pb2+/MCH 0/depAu/GCE, g. H2-HGNPs-PTCA-L-Cys 1/DNAzyme+ Pb2+/MCH 0/depAu/GCE;(B) comparison of ECL signals with different singal label. Potential scan range is from
1.5 V to 0 V.
3.6 ECL传感器的响应性能
配制不同浓度的Pb2+标准溶液,在其它条件不变的情况下进行ECL检测。实验结果如图6所示,以ECL强度变化值ΔI对Pb2+浓度的对数值lgc作图,可见Pb2+浓度在1012~106 mol/L范围内与ECL响应信号呈现良好的线性关系,线性方程为ΔI=451.5lgc/(mol/L)+ 6861(r=0.9908),检出限为10
12 mol/L(S/N=3)。将本方法和其它的Pb2+检测方法进行了对比(表2),可以看出,本实验中设计的Pb2+ ECL传感器具有较宽的检测范围,可用于检测微量Pb2+。
电感耦合等离子体发射光谱法
Inductively coupled plasma optical emission spectrometry,ICP OES2.4×107~2.4×106
荧光光谱法 Fluorescent spectrometry, FL3.3×1010~8.0×109表面增强拉曼散射法 Surface-Enhanced Raman Scattering, SERS109~105致化学发光 Electrochemiluminescence, ECL1012~106This work
3.7 ECL传感器的稳定性
对不同浓度的Pb2+标准溶液进行ECL检测,如图7所示,从a到g的曲线依次代表浓度从1×10
12~1×106 mol/L的Pb2+标准溶液,每个浓度下选取连续3圈扫描得到的ECL信号强度基本没有变化,说明我们制备的ECL传感器具有较好的稳定性。
图6 传感器在不同铅离子浓度下的ECL信号(从下向上: 10
12 mol/L,1011 mol/L,1010 mol/L,109 mol/L,108 mol/L,107 mol/L,106 mol/L),插图为线性关系曲线。
Fig.6 ECL signal of sensors in different concentrations of lead ions (from bottom to up: 1012 mol/L, 1011 mol/L, 1010 mol/L,109 mol/L,108 mol/L, 107 mol/L, 6 mol/L). Inset shows the linear calibration curve.
3.8 ECL传感器的选择性
如图8所示,在各干扰离子浓度均为104 mol/L时,106 mol/L Pb2+的ECL响应信号远高出其它金属离子,表明所构建的传感器具有良好的选择性。
4 结 论
本研究通过Pb2+引发脱氧核酶剪切底物核酸链,实现目标物循环,并基于苝酐衍生物功能化空心纳米金信号探针,建立了一种Pb2+ ECL传感器。该传感器具有价廉、灵敏度高、选择性高的特点,其检测线性范围为1×1012~1×106 mol/L,而且一些常见的金属离子对此Pb2+传感器不会造成干扰,可望用于实际样品中微量Pb2+的检测。
References
1 GAO Xiao-Xia, JIA Yu-Hua, YANG Jin-Feng, LI Ji-Shan, YANG Rong-Hua. Chinese J. Anal. Chem., 2013, 41(5): 670-674
高晓霞, 贾玉华, 杨金凤, 李继山, 杨荣华. 分析化学, 2013, 41(5): 670-674
2 He Q W, Mille E W, Wong A P, Chang C J. J. Am. Chem. Soc., 2006, 128: 9316-9317
3 GB 5009.12—2010. Determination of Lead in Foods. National Food Safety Standard. National Standards of the People′s Republic of Chinaendprint
食品中铅的测定. 食品安全国家标准. 中华人民共和国国家标准. GB 5009.12-2010
4 GB 5749-2006. Standards of Drinking Water Quality. National Standards of the People′s Republic of China
生活饮用水卫生标准. 中华人民共和国国家标准. GB 5749-2006
5 HE Xiao-Min, WANG Min, WANG Xiao-Dong, XUE Ai-Fang, LI Sheng-Qing, CHEN Hao. Spectroscopy and Spectral Analysis, 2007, 27(11): 2353-2356
贺小敏, 王 敏, 王小东, 薛爱芳, 李胜清, 陈 浩. 光谱学与光谱分析, 2007, 27(11): 2353-2356
6 Tarley C R T, Andrade F N, de Oliveira F M, Corazza M Z, de Azevedo L F M, Segatelli M G. Anal.Chim. Acta, 2011, 703: 145-151
7 dos Santos J, dos Santos A B, Herrmann A B, Kulik S, Baika L M, Tormen L, Curtius A J. Brazilian Archives of Biology and Technology, 2013, 56: 127-134
8 ZHAO Ai-hong WANG Jian-hua SONG Zhi-gang FAN Guang-hua LIU Chun-Xiao. Spectroscopy and Spectral Analysis, 2006, 26(11): 2137-2139
赵爱红 王建华 宋志刚 樊广华 刘春晓. 光谱学与光谱分析, 2006, 26(11): 2137-2139
9 Tang M L, Wen G Q, Luo Y H, Kang C Y, Liang A H, Jiang Z L. Luminescence. 2015, 30: 296-302
10 Fu C C, Xu W Q, Wang H L, Ding H, Liang L J, Cong M, Xu S P. Anal. Chem., 2014, 86(23): 11494-11497
11 Huang R F, Liu H X, Gai Q Q, Liu G J, Wei Z. Biosens. Bioelectron., 2015, 71: 194-199
12 Qiu S Y, Gao S, Zhu X, Lin Z Y, Qin B, Chen G N. Analyst, 2011, 136: 1580-1585
13 Liu Z Y, Qi W J, Xu G B. Chem. Soc. Rev., 2015, 44: 3117-3142
14 Cao Y L, Yuan R, Chai Y Q, Mao L, Niu H, Liu H J, Zhuo Y. Biosens. Bioelectron., 2012, 31: 305-309
15 Yao W, Wang L, Wang H Y, Zhang X L. Electrochim. Acta, 2008, 54: 733-737
16 Ma M N, Zhang X, Zhuo Y, Chai Y Q, Yuan R. Nanoscale, 2015, 7: 2085-2092
17 LiuY T, Zhang Q Q, Wang H J, Yuan Y L, Chai Y Q, Yuan R. Biosens. Bioelectron., 2015, 71: 164-170
18 Zhuo Y, Zhao M, Qiu W J, Gui G F, Chai Y Q, Yuan R, J.Electroanal. Chem., 2013, 709: 106-110
19 Gui G F, Zhuo Y, Chai Y Q, Liao N, Zhao M, Han J, Zhu Q, Yuan R, Xiang Y. Biosens. Bioelectron., 2013, 47: 524-529
20 Swearingen C B, Wemette D P, Cropek D M, Lu Y, Sweedler J V, Bohn P W. Anal. Chem., 2005, 77(2): 442-448
21 Li Q, Zheng J Y, Yan Y L, Zhao Y S, Yao J N. Adv. Mater., 2012, 24: 4745-4749endprint
