野生型枯草芽孢杆菌N4的spizizen转化法优化
2015-11-11
野生型枯草芽孢杆菌N4的spizizen转化法优化
李春艳1,冯凤兆1,冯露1,成毅1,成小松2
(1.东北农业大学资源与环境学院,哈尔滨150030;2.哈尔滨医科大学第一临床医学院,哈尔滨150001)
摘要:采用经典Spizizen方法将已构建的大片段重组质粒pHT01-nit(nit为腈水解酶基因)转化野生型枯草芽孢杆菌Bacillus subtilis N4,无法获得转化子。研究对Spizizen方法进行改进,分别在感受态制备及转化过程中加入有机溶剂及溶菌酶,并对有机溶剂种类、浓度,溶菌酶浓度,质粒与感受态共培养时间进行优化,提高转化效率,构建Bacillus subtilis N4-pHT01-nit。经IPTG诱导,通过SDS-聚丙烯酰胺凝胶电泳(Polyacryamide gel electro⁃phoresis, PAGE)验证nit在野生型枯草芽孢杆菌Bacillus subtilis N4中的表达。结果表明,最优条件为在感受态制备过程中添加4%的Tween-80,转化过程中添加5 μg·mL-1溶菌酶,感受态与质粒共培养时间为1 h,条件优化后可得到37个转化子·μg-1DNA。在SDS-PAGE上可以看到与腈水解酶分子质量一致的蛋白条带。说明该优化后的方法效果明显,适合于大片段重组质粒转化野生型枯草芽孢杆菌。
关键词:野生型枯草芽孢杆菌;spizizen转化法;有机溶剂;溶菌酶;SDS-PAGE
网络出版时间2015-1-27 16:01:07
[URL]http://www.cnki.net/kcms/detail/23.1391.S.20150127.1601.014.html
李春艳,冯凤兆,冯露,等.野生型枯草芽孢杆菌N4的spizizen转化法优化[J].东北农业大学学报, 2015, 46(2): 78-82.
枯草芽孢杆菌(Bacillus subtilis)是革兰氏阳性好氧细菌,内生抗逆孢子,细胞壁不含内毒素,无致病性,直接分泌多种蛋白到培养基中,有些枯草芽孢杆菌还能形成生物膜,因此常被用作一些重要工业酶制剂的生产菌,亦可应用到环境污染的治理中[1-2]。自枯草芽孢杆菌168菌株被Spizizen[3]发现可用作转化菌株以来,枯草芽孢杆菌生理生化及遗传学研究工作不断深入,其属于革兰氏阳性菌,相对大肠杆菌,其转化工作较为困难。常用原生质体转化法、Spizizen转化法、电转化法进行枯草芽孢杆菌转化。原生质体转化法尽管条件温和,转化设备要求低,但在原生质体制备时,对破壁温度、破壁时间以及溶菌酶用量等条件有严格要求,试验操作繁琐,且转化效率较低[4];目前,转化效率较高当属电转化法,但该方法对转化设备要求高,操作中影响转化因素较多,需进行条件摸索,不易在短期内掌握[4]。传统Spizizen转化方法[3]基本能够满足WB600、WB800和168等模式菌株的转基因要求,但由于某些野生型枯草芽孢杆菌较低的膜通透性,使得胞内胞外物质不能顺利进出[5],因此利用Spizizen方法转化某些野生型枯草芽孢杆菌达不到要求转化效率。目前国内外针对野生型枯草芽孢杆菌的转化报道较少,不同枯草芽孢杆菌形成感受态条件差别很大,转化质粒大小也会影响转化效率,一般质粒越小越利于转化。魏艳等报道针对1株野生型枯草芽孢杆菌有机溶剂转化方法[5],但其转化的质粒DNA片段较小,而对大片段质粒DNA转化野生型枯草芽孢杆菌尚无报道,因此建立一种适合转化大片段质粒DNA的野生型枯草芽孢杆菌转化方法尤为重要。
本研究以野生型B. subtilis N4为研究对象,在Spizizen转化法的基础上,在制备感受态和转化过程中,通过添加不同浓度的Tween-80、丙酮、煤油、甲醇等有机溶剂和溶菌酶,并探讨质粒与感受态共培养时间,实现野生型B. subtilis N4的DNA转化,获得大片段质粒DNA转化野生型枯草芽孢杆菌的方法,并进行诱导表达加以验证,以满足后续实验操作需要,同时也对其他野生型枯草芽孢杆菌的转化有一定借鉴作用。
1 材料与方法
1.1供试菌株、质粒及试剂
菌株:B. subtilis N4为东北农业大学微生物实验室筛选并保存。质粒:PHT01-nit(9.1 kb)由实验室构建并保存于大肠杆菌DH5α中,外源片段为1.1 kb腈水解酶基因(nit),大肠杆菌-枯草芽孢杆菌穿梭质粒PHT01约8 kb,购自MoBiTec(Goettingen, Ger⁃many)。所用抗生素工作浓度:N4菌株(氯霉素5 μg·mL-1);大肠杆菌DH5α(氨苄青霉素50 μg·mL-1)。
有机溶剂Tween-80购自天津市进化化工试剂有限公司;煤油购自天津市致远化学试剂有限公司;丙酮和甲醇购自天津市科密欧化学试剂有限公司;溶菌酶购自Amresco;限制性内切酶AatⅡ和XbaⅠ购自大连宝生物工程有限公司。
1.2培养基及溶液
LB固体培养基:用于转化子筛选,主要成分有NaCl 10 g、酵母膏5 g、蛋白胨10 g、琼脂20 g、蒸馏水1 000 mL,pH 7.0~7.2,并添加氯霉素至终浓度为5 μg·mL-1;LB液体培养基:用于转化子培养,主要成分有NaCl 10 g、酵母膏5 g、蛋白胨10 g、蒸馏水1 000 mL,pH 7.0~7.2,并添加氯霉素至终浓度为5 μg·mL-1;
10×最低盐溶液:用于GMⅠ和GMⅡ溶液配制,MgSO4·7H2O 0.2 g,柠檬酸钠(Na3C6H5O7·2H2O)1 g,(NH4)2SO42 g,KH2PO46 g,K2HPO4·3H2O 18.34 g,在蒸馏水中依次溶解,加水至100 mL;L-trp溶液:用于GMⅠ溶液和GMⅡ溶液配制,2 mg·mL-1,贮于棕色瓶内,113℃灭菌30 min,用黑纸包裹;GMⅠ溶液:用于枯草芽孢杆菌转化,1×最低盐溶液95 mL,5%水解酪蛋白0.4 mL,10%酵母汁1 mL,50%葡萄糖1 mL,2 mg·mL-1L-trp 2.5 mL(50 μg·mL-1);GMⅡ溶液:用于枯草芽孢杆菌转化,1×最低盐溶液97.5 mL,10%酵母汁0.04 mL,5%水解酪蛋白0.08 mL,50%葡萄糖1 mL,0.1 mol·L-1CaCl20.5 mL(0.5 mmol·L-1),0.5 mol·L-1MgCl20.5 mL(2.5 mmol·L-1),2 mg·mL-1L-trp 0.5 mL(5 μg·mL-1)。
10% SDS(W/V)溶液:称取10 g高纯度SDS于100~200 mL烧杯中,加入约80 mL去离子水,68℃加热溶解。滴加浓盐酸调节pH 7.2,将溶液定容到100 mL后,室温保存。
1.3质粒提取方法
质粒提取使用质粒提取试剂盒购自大连宝生物工程有限公司,因B. subtilis N4属于革兰氏阳性菌,故按试剂盒说明书提取质粒时,加入SolutionⅠ后,需加终浓度为5 mg·mL-1的溶菌酶裂解细胞[5],后续操作按试剂盒说明书进行。
1.4 B. subtilis N4菌株感受态细胞制备方法
接种斜面培养2 d的B. subtilis N4菌株于5 mL GMⅠ溶液,同时分别加入体积百分比为1%、2%、3%、4%、5%浓度的Tween-80、丙酮、煤油、甲醇,以传统spizizen转化法为对照,30℃、100 r·min-1摇床振荡培养过夜。第2天取2 mL过夜培养物转接到18 mL新鲜GMⅠ中,37℃、200 r·min-1振荡培养3.5 h。再取10 mL转接到90 mL GMⅡ中,37℃、100 r·min-1振荡培养90 min。8 000 r·min-1离心收集菌体。用10 mL上清液悬浮菌体,并加30%灭菌甘油至10%,混合均匀。以每管0.5 mL量分装到离心管中,-80℃保存备用。
1.5 B. subtilis N4菌株化学转化及转化子验证
取500 μL上述制备的感受态细胞于45℃水浴溶化。分别加入1、5、10 μg·mL-13个不同浓度的溶菌酶,以传统spizizen转化法为对照。加入1 μg供体PHT01-nit质粒于500 μL感受态细胞中。37℃、80 r·min-1振荡培养30 min。涂布含5 μg·mL-1氯霉素抗性平板,37℃培养过夜,次日记录菌落数。试验重复3次。用灭菌牙签随机挑取单菌落,然后接种到5 mL含氯霉素的LB液体培养基中,37℃、160 r·min-1振荡培养7 h。提取质粒后,用限制性内切酶AatⅡ和XbaⅠ双酶切验证。
1.6质粒PHT01-nit与B. subtilis N4感受态细胞共培养时间对转化效率的影响
分别选取质粒与感受态的共培养时间为0.5、1.0、1.5、2.0、2.5和3 h,37℃、80 r·min-1振荡培养,测定质粒与感受态共培养时间对B. subtilis N4转化效率的影响。
1.7腈水解酶基因(nit)的诱导表达
挑取对照菌(野生型B. subtilis N4)和重组菌(B. subtilis N4-PHT01-nit)各1个单菌落,分别接入5.0 mL不含氯霉素和含氯霉素的LB液体培养基中,37℃,200 r·min-1振荡培养过夜,作为种子液。培养过夜后,按1%接种量转种于装有50 mL不含氯霉素和含氯霉素的LB培养基的250 mL三角瓶中,37℃,200 r·min-1培养至OD600为0.7~0.8时开始诱导,此时加入诱导剂IPTG(体积浓度为1mmol·L-1),诱导24 h后取样。
各取B. subtilis N4和重组菌的培养液10 mL,离心(10 000 r·min-1、5 min)收集细胞,用约2 mL去离子水悬浮细胞,再次离心收集细胞,用去离子水悬浮细胞至原体积。取细胞液进行超声破碎(冰浴、超声1 s、间歇3 s、功率700 W、全程12 min)离心(14 000 r·min-1、15 min)获取粗酶液。各取20 μL粗酶液加入等体积2×SDS上样缓冲液,进行蛋白质电泳。
2 结果与分析
2.1有机溶剂对枯草芽孢杆菌B. subtilis N4转化效率的影响
比较不同浓度有机溶剂对转化效率的影响,图1a显示,添加4% Tween-80转化效率最高,得到17个转化子·μg-1DNA,添加3% Tween-80也能得到转化子,但转化效率很低,仅获得2个转化子。
图1b显示添加2%甲醇得到1个转化子,浓度增大或降低均得不到转化子;而添加各浓度的丙酮和煤油均未得到转化子。试验发现,Tween-80 对B. subtilis N4转化效率的影响最为显著和稳定,重复试验3次,均得到数目相近的转化子。传统spizizen转化组,野生型B. subtilis N4在氯霉素抗性平板上未得到转化子,说明野生型B. subtilis N4不能利用spizizen转化法进行转化。
2.2溶菌酶对枯草芽孢杆菌B. subtilis N4转化效率的影响
在感受态制备过程中添加4% Tween-80基础上,同时在转化过程中添加1、5、10 μg·mL-13个不同浓度的溶菌酶,测定溶菌酶对B. subtilis N4转化效率的影响,结果表明,传统spizizen转化组,野生型B. subtilis N4未得到转化子,同时加有Tween-80和5 μg·mL-1溶菌酶则能提高B. subtilis N4转化效率,如图1c所示由原来只加4% Tween-80的17个转化子·μg-1DNA提高到26个转化子·μg-1DNA。而添加1 μg·mL-1和10 μg·mL-1的溶菌酶对原转化效率几乎无影响,说明适量溶菌酶可以改善细胞通透性,有助于转化顺利进行。
2.3质粒PHT01- nit与B. subtilis N4感受态细胞共培养时间对转化效率的影响
由图1d可知,在添加4% Tween-80和5 μg·mL-1溶菌酶的基础上,质粒与感受态共培养1 h,转化效率最高,得到37个转化子·μg-1DNA,共培养时间达到2 h后转化效率为0。
2.4转化子验证
将从转化子中提取的质粒进行双酶切验证,结果均得到大小约为1.1和8.0 kb的两个片段(见图2),表明重组质粒PHT01-nit于野生型B. subtilis N4中转化成功。

图1 不同因素对转化效率的影响Fig. 1 Effect of different factors on transformation efficiency
2.5枯草芽孢杆菌表达载体PHT01-nit在蛋白水平的表达
对照菌(B. subtilis N4)和重组菌(B. subtilis N4-PHT01-nit)经过IPTG诱导表达,重组菌出现1条明显的蛋白条带,约40 ku,与腈水解酶基因nit表达的蛋白大小相符。结果如图3所示。
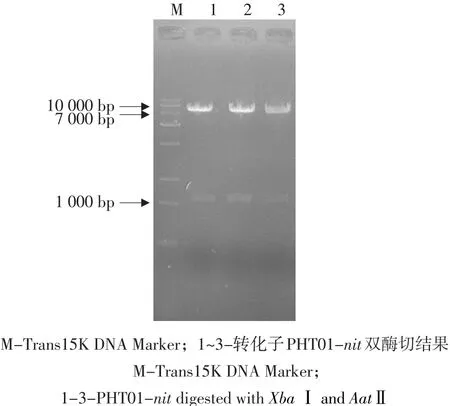
图2 转化子PHT01-nit双酶切鉴定/XbaⅠ, AatⅡFig. 2 PHT01-nit digested with XbaⅠand AatⅡ
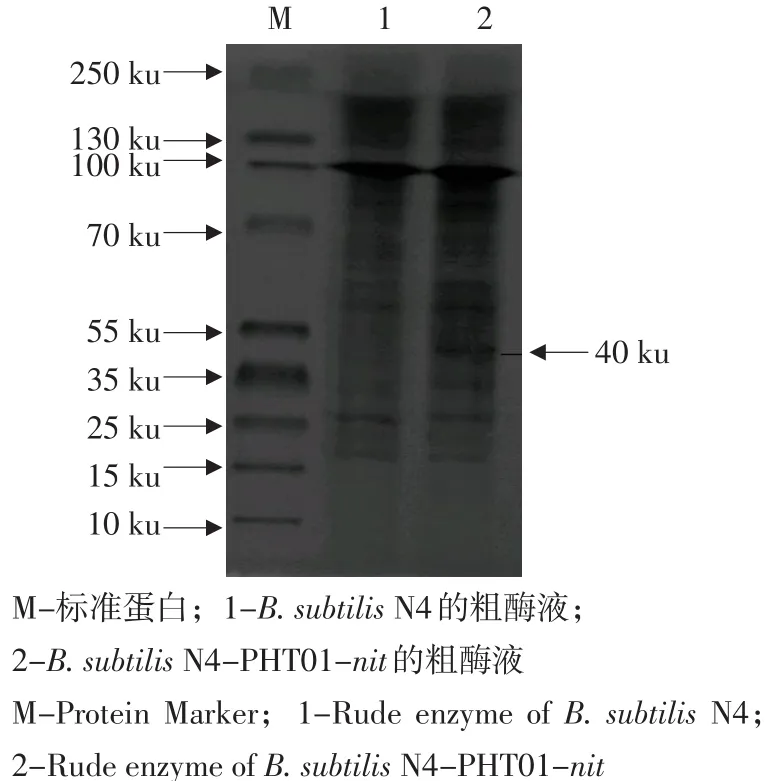
图3 B. subtilis N4-PHT01-nit SDS-PAGEFig. 3 SDS-PAGE results of B. subtilis N4-PHT01-nit
3 讨 论
本研究使用Tween-80、丙酮、煤油、甲醇等不同有机溶剂,探讨如何提高野生型B. subtilis N4的转化效率,目前对有机溶剂作用机制研究很多,李文华等认为复合物聚-β-羟基丁酸(Polyβ-hydroxybutyrate,PHB)存在于枯草芽孢杆菌中,PHB复合物是细菌通过细胞膜摄取外源DNA所不可缺少组分,PHB能与多聚磷酸以及Ca+形成柱状螺旋结构,构成细菌细胞膜上膜通道,有利于外源DNA进入[7]。Reusch研究显示细菌非感受态细胞膜上的PHB含量明显低于感受态细胞膜上的PHB[8-9]。在细菌体内,PHB是由甲醇、有机酸、糖类、CO2等有机小分子合成,因此推断在制备野生型B. subtilis N4感受态过程中加入的有机溶剂可能参与PHB合成,改变细胞膜结构而允许DNA片段进入细胞内。Nishida等研究表明[10-12],细胞膜上磷脂可以与有机溶剂发生静电反应,使膜的液相流动性提高,干扰细胞膜液晶结构,形成间隙,质粒DNA通过间隙进入细胞。Tween-80是典型的表面活性剂,可提高不饱和脂肪酸C18ϑ1ω9、C18ϑ2ω9, 12和C16ϑ1ω9在细菌细胞内含量[13-15],朱利中研究认为细胞膜脂肪酸组成受表面活性剂影响,表面活性剂可增大细胞膜上不饱和脂肪酸含量,提高细胞膜通透性,这是Tween-80处理过的细胞转化效率略高的原因[16]。
魏艳等曾利用有机溶剂改善细胞膜通透性方法,构建针对野生型枯草芽孢杆菌转化法,但其转化的质粒DNA片段较小,为3.6 kb[5]。而实验室转化的重组质粒PHT01-nit大小约9.1 kb,属于大片段质粒DNA,不易进入细胞,因此仅通过添加有机溶剂只得到17个转化子·μg-1DNA,转化效率略低。本研究在魏艳等研究基础上,在感受态制备过程中添加有机溶剂同时,在转化过程中添加适量溶菌酶以进一步提高野生型B. subtilis N4的转化效率。由N-乙酰胞壁酸和N-乙酰葡萄糖胺以β (1, 4)糖苷键连成的大分子肽聚糖是构成细菌细胞壁的主要成分,而N-乙酰胞壁酸酶俗称溶菌酶,可破坏细胞壁的双糖结构。故有学者提出为了便于外源DNA进入细胞,使用适当溶菌酶处理细胞壁使其变薄或形成空隙[6]。本研究结果显示,转化过程中加入5 μg·mL-1溶菌酶使转化效率提高到26个转化子·μg-1DNA,而添加1 μg·mL-1和10 μg·mL-1溶菌酶对转化效率没有影响,这可能是由于浓度过小的溶菌酶对细胞壁结构没有破坏作用,而过量溶菌酶会导致细胞内大量原生质外漏而影响转化[6],只有适量溶菌酶才能有效改善B. subtilis N4细胞的通透性,利于重组质粒PHT01-nit进入。
依据Spizizen[3]转化法,若达到有效转化,质粒与感受态共培养时间仅需30 min,但魏艳报道[5],细胞感受态状态可维持1 h,为获得最大转化效率,本研究比较质粒与感受态不同的共培养时间对转化效率影响,确定野生型B. subtilis N4转化最佳共培养时间为1 h。
4 结 论
a.通过改进spizizen转化法,在感受态制备过程中添加有机溶剂Tween-80,使重组质粒PHT01-nit转化野生型B. subtilis N4的转化效率由原来的0个转化子提高到17个转化子·μg-1DNA。
b.在感受态制备过程中添加4% Tween-80基础上,在转化过程中添加5 μg·mL-1溶菌酶,使重组质粒PHT01-nit转化野生型B. subtilis N4的转化效率由17个转化子·μg-1DNA提高到26个转化子·μg-1DNA。
c.通过比较重组质粒PHT01-nit和B. subtilis N4感受态不同的共培养时间对转化效率的影响,发现共培养时间在1 h时转化效率达到最大,得到37个转化子·μg-1DNA。优化Spizizen转化法,使其适用于大片段重组质粒转化野生型枯草芽孢杆菌。
d.重组菌Bacillus subtilis N4-pHT01-nit经IPTG诱导后,通过SDS-PAGE证明nit在野生型枯草芽孢杆菌N4中成功表达。
[参考文献]
[1]李明,双宝,李海涛,等.枯草芽孢杆菌的研究与应用[J].东北农业大学学报, 2009, 40(9): 111-114.
[2]武彩霞.高Lys蛋白基因和高Met蛋白基因在枯草芽孢杆菌中的共表达[D].哈尔滨:东北农业大学, 2013.
[3]Spizizen J. Transformation of biochemically deficient strains of Bacillus subtilis by deoxyribonucleate[J]. Proc Natl Acad Sci USA, 1958, 44: 1072-1075.
[4]陆雁,王青艳,朱绮霞,等.枯草芽孢杆菌高效转化及其转化子验证方法[J].广西科学院学报, 2012, 28(20): 117-119.
[5]魏艳,张丹,蔡恒,等.适用于野生型枯草芽孢杆菌转化有机溶剂方法的建立和优化[J].生物学通报, 2012, 46(12): 42-45.
[6]薛禹谷,董可宁,韩文珍.枯草芽孢杆菌转化育种中几个有关问题的探讨[J].微生物学报, 1977, 17(2): 108-113.
[7]李文化,谢志雄,陈向东,等.聚-β-羟基丁酸(PHB)在细菌建立感受态中的作用[J].微生物学杂志, 2002, 22(6): 30-32.
[8]Reusch R N. Poly-β-hydroxybutyrate/calcium polyphosphate complexes in eukaryotic membranes[J]. Experimental Biology and Medicine, 1989, 191(4): 377-381.
[9]Reusch R N. The role of short-chain conjugated poly-(R)-3-hy-
droxybutyrate (cPHB) in protein folding[J]. International Journal of Molecular Sciences, 2013, 14(6): 10727-10748.
[10]Nishida N, Jing D, Kuroda K, et al. Activation of signaling path⁃ways related to cell wall integrity and multidrug resistance by or⁃ganic solvent in Saccharomyces cerevisiae[J]. Current Genetics, 2014(60): 149-162.
[11]萨姆布鲁克, D W拉塞尔.分子克隆实验指南[M]. 3版.北京:科学出版社, 2002: 87-96.
[12] Xu Q, Cheng J, Ge Z, et al. Effects of organic solvents on meme brane of Taxus cuspidata cells in two-liquid-phase cultures[J]. Plant Cell, Tissue and Organ Culture, 2004, 79(1): 63-69.
[13]Zhang D, Zhu L Z. Effects of Tween 80 on the removal, sorption and biodegradation of pyrene by Klebsiella oxytoca PYR-1[J]. En⁃viron Pollut, 2012, 164: 169-174.
[14]Yu H, Zhu L, Zhou W. Enhanced desorption and biodegradation of phenanthrene in soil-water systems with the presence of anion⁃icnonionic mixed surfactants[J]. J Hazard Mater, 2007, 142(1/2): 354-361.
[15]Zhao B, Zhu L, Li W, et al. Solubilization and biodegradation of phenanthrene in mixed anionic-nonionic surfactant solution[J]. Chemosphere, 2005, 58(1): 33-40.
[16]朱利中.有机污染物界面行为调控技术及其应用[J].环境科学学报, 2012, 32(11): 2641-2649.
Li Chunyan, Feng Fengzhao, Feng Lu, et al. Optimization of the spizizen method for wild-type Bacillus subtilis N4 transformation [J]. Journal of Northeast Agricultural University, 2015, 46(2): 78-82. (in Chinese with English abstract)transformation
Optimization of the spizizen method for wild-type Bacillus subtilis N4
/LI Chunyan1, FENG Fengzhao1, FENG Lu1, CHENG Yi1, CHENG Xiaosong2(1. School of Resources and Environmental Sciences, Northeast Agricultural University, Harbin 150030, China; 2. School of First Clinical Medicine, Harbin Medical University, Harbin 150001, China)
Abstract:The constructed large recombinant plasmid could not be transformed into the wild-type Bacillus subtilis N4 by traditional spizizen method. In this study, we optimized the spizizen method by adding organic solvents and lysozyme in preparation and transformation of competent cells. The types and concentrations of organic solvent, the concentrations of lysozyme, co-culture time of plasmids and competent cells were studied for improving transformation efficiency to construct Bacillus subtilis N4 PHT01-nit. After IPTG induced, the expression of nit in wild type Bacillus subtilis N4 was validated by SDS-PAGE. Results showed that the highest transformation efficiency of 37 transformants·μg-1DNA could be obtained when 4% of the Tween-80 was added in preparation of competent cells, 5 μg·mL-1of lysozyme was added in transformation of competent cells, and plasmids were cultured with competent cells for 1 h. SDS-PAGE showed that the target protein band was consistent with nitrilase. This optimized spizizen method could be used for large plasmid DNA transformation into the wild-type Bacillussubtilis.
Key words:wild-type Bacillussubtilis; spizizen method; organic solvents; lysozyme; SDS-PAGE
作者简介:李春艳(1970-),女,教授,博士,博士生导师,研究方向为环境微生物。E-mail: chunyanli@neau.edu.cn
基金项目:国家自然科学基金资助项目(41271504)
收稿日期:2014-03-14
文章编号:1005-9369(2015)02-0078-05
文献标志码:A
中图分类号:Q785
