181例严重药品不良反应/事件报告分析
2015-11-11汤松张万智唐晓霞
汤松 张万智 唐晓霞
(1湖北省安陆市普爱医院药剂科,湖北安陆432600;2湖北省孝感市中心医院药学部,孝感432000)
181例严重药品不良反应/事件报告分析
汤松1张万智1唐晓霞2
(1湖北省安陆市普爱医院药剂科,湖北安陆432600;2湖北省孝感市中心医院药学部,孝感432000)
目的:了解药品不良反应(ADR)的发生特点,为ADR监测工作提供参考。方法:提取国家药品不良反应监测系统中孝感市2011-2014年上报的ADR/药品不良事件(ADE)报告8 258例,纳入严重ADR/ADE报告181例,对发生ADR/ADE的患者性别、严重程度、相关性、药品类别、给药途经、累及器官及临床表现、严重ADR/ADE发生的特点进行统计分析。结果:181例严重ADR/ADE报告,主要来自医疗机构(173例,95.58%)和临床医师(104例,57.46%);引起ADR/ADE的药物为抗菌药物(97例,53.59%)和中药注射剂(23例,12.71%);引起ADR的给药途径以静滴多见(133例,73.48%);在181例严重ADR/ADE中,严重过敏性反应80例(42.20%),皮肤及附件损害36例(19.89%)。前3位的药品分别为头孢哌酮-舒巴坦(14例)、参麦注射液(10例)和头孢呋辛(10例)。结论:2011-2014年孝感市ADR/ADE高发于儿童和老年人,抗菌药物和中药注射剂以及静脉滴注给药,过敏反应最常见,临床用药中应予以重视。
药品不良反应;药品不良事件;报告;监测
2004年我国已出台了《药品不良反应(ADR)报告和监测管理办法》,为防控ADR,降低用药风险提供了技术保障。随着ADR/药品不良事件(ADE)监测工作的不断深入,ADR/ADE报告的质量和数量已呈现逐年提高的趋势,但严重ADR的报告数量和质量仍不尽人意。为评价ADR/ADE报告,分析ADR/ADE的特点,为临床安全用药提供参考,现对孝感市2011-2014年严重ADR/ADE报告进行调查分析。
1 资料与方法
通过国家药品不良反应监测系统下载2011年1月至2014年12月孝感市ADR/ADE报告8 258份,评价为肯定、很可能和可能的共7 732份,评价为可能无关的报告69份,待评价的报告435份,无法评价的报告22份;其中评价为肯定、很可能和可能的严重ADR/ADE报告181份(2.34%)纳入分析。根据ADR/ADE因果关系评价方法对ADR报表中引起ADR/ADE的患者性别、严重程度、相关性、药品类别、给药途径、累及器官及临床表现、严重ADR发生的特点进行统计分析,并采用Excel 2003和SPSS 19.0联合进行数据处理,率的比较采用χ2检验,P<0.05为有统计学意义。
2 结果
2.1一般情况
181例严重ADR/ADE,医疗机构报告173例(95.58%);医师报告104例(57.46%),见表1。其中男82例,女99例,男女之比为1∶1.21;年龄最小者1岁,最大者83岁,平均年龄(42.88±23.05)岁,见表2。患者有ADR/ADE家族史的7例,无ADR/ADE家族史的62例,不详的112例;患者有ADR/ADE既往史的7例,无ADR/ADE既往史的83例,不详的91例。
2.2ADR/ADE相关性和病例转归
根据我国通常采用的ADR因果关系判断标准进行分析[1-2]。严重ADR/ADE相关性:肯定62例(34.25%),很可能73例(40.33%),可能46例(25.41%)。严重ADR/ADE病例转归:痊愈84例,好转89例,不详4例,未好转2例,有后遗症1例,死亡1例。
2.3ADR/ADE与药品种类、给药途径的关系
按《新编药物学》第17版的药品分类方法[3],对严重ADR/ADE报告中涉及的药品进行分类,结果见表3,给药途径的分布见表4。
2.4ADR/ADE累及的器官/系统及临床表现见表5。
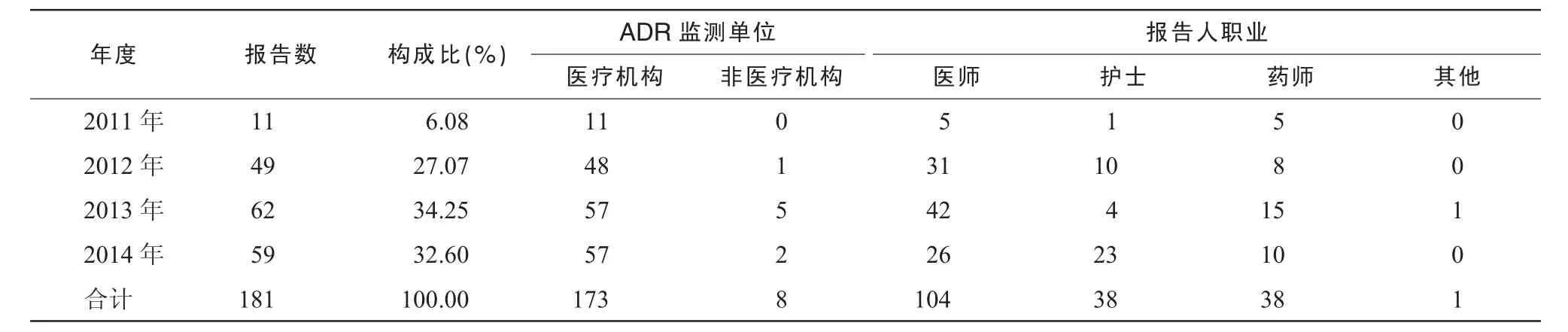
表1 2011-2014年孝感市严重ADR/ADE来源分布

表2 2011-2014年孝感市严重ADR/ADE年龄分布
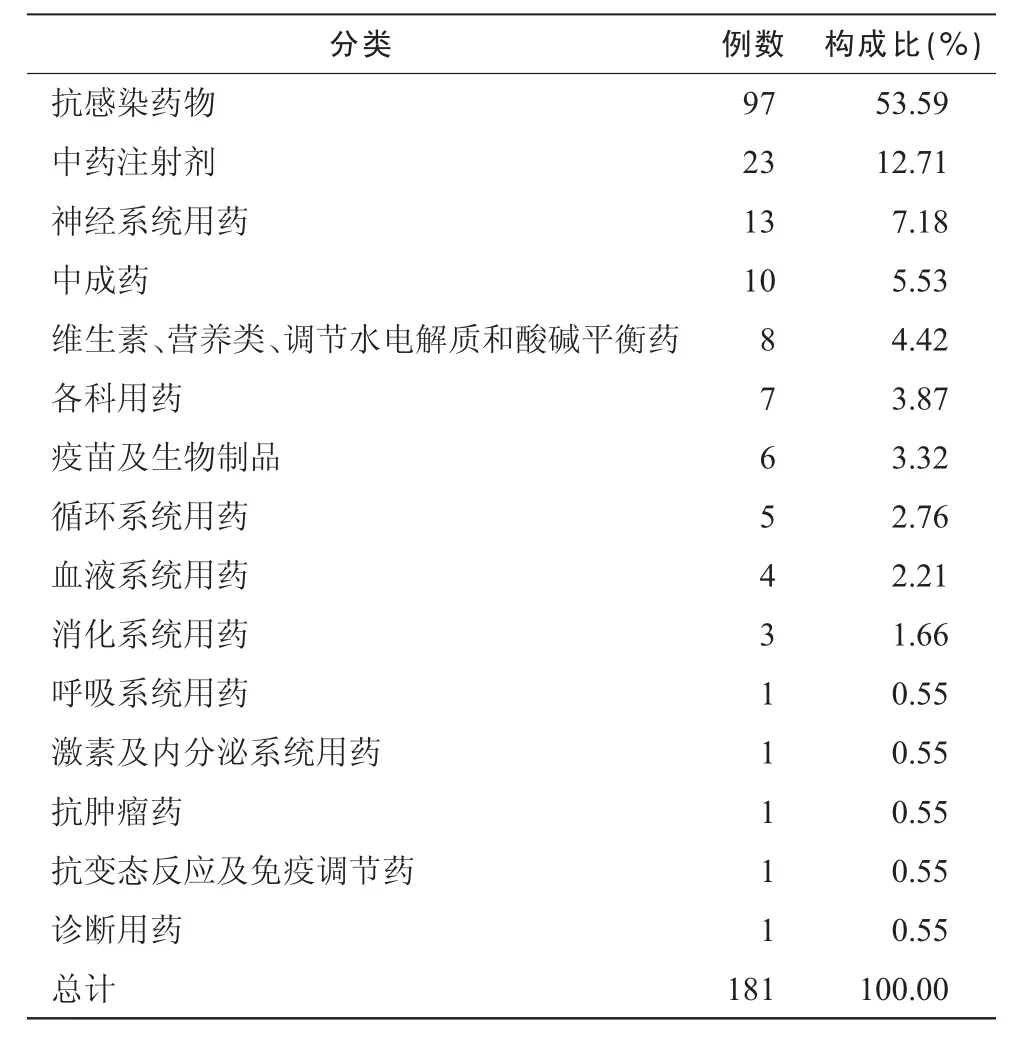
表3 引起ADR的药品种类

表4 2011-2014年孝感市严重ADR/ADE给药途径分布
2.5引发严重ADR/ADE的药物及临床表现
严重ADR/ADE的代表药物及临床表现见表6~7。
3 讨论
3.1ADR/ADE报告的来源及质量分析
表1数据显示,ADR/ADE报告主要来源于医疗机构和医务人员。本次分析的严重ADR/ADE报告181例(2.34%),低于2013年全国严重报告所占比例(4.3%)。从报告来源上看,主要报告人是医疗机构的医务人员,是否存在报告偏倚值得探讨。

表5 2011-2014年孝感市严重ADR/ADE累及器官/系统及临床表现

表6 2011-2014年孝感市严重ADR/ADE的代表药物及临床表现

表7 2011-2014年孝感市发生严重ADR/ADE频率高的药品
3.2性别、年龄、药物品种、给药途经对ADR/ADE的影响
本次分析的人口数据来源于孝感市2010年第六次全国人口普查主要数据公报。部分文献报告[4-6],ADR/ADE的发生与年龄、性别等因素有关。本次ADR/ADE数据显示,男女之比为1∶1.21,女性高于男性。年均百万人口报告例数儿童组(<15岁)和老年组(≥65岁)高于中青年组(≥15且<65岁)(P<0.05),提示儿童和老年人用药过程中尤其应关注ADR和药品的安全性。
与文献相似[7],抗菌药物和中药注射剂是ADR/ADE高发的药品,也从另一角度提示这几类药品的使用频率高。静脉给药是本次分析的ADR/ADE的主要给药途径,故控制静脉输液的使用对防止严重ADR/ADE具有重要意义。
3.3严重ADR/ADE分析
国家食品药品监督管理总局的《药品不良反应信息通报》第21期报导[8],头孢哌酮钠-舒巴坦钠的过敏性休克约占严重病例报告总数的38%。其他ADR还包括呼吸系统损害、皮肤及其附件损害、血液系统损害、肝肾功能损害和神经系统损害等。表5和表7均显示,过敏性反应是发生率最高的ADR/ADE,181例严重ADR/ADE中,过敏性反应80例(44.20%),主要表现为过敏性休克、喉水肿、过敏性紫癜、意识模糊或意识丧失,鉴于过敏性反应发生率高,药物皮试的可靠方法有限[2],临床用药的过程中应严密观察药物的过敏性反应,并准备好急救药品,做好抢救的思想准备和物质准备,规避药品风险。本次分析的严重ADR/ADE还包括严重的皮肤及附件的损害36例(19.89%),消化系统的不良反应15例(8.29%)。高发药品除头孢哌酮-舒巴坦外,还有参麦注射液、头孢呋辛、头孢曲松、左氧氟沙星、头孢孟多酯、头孢他啶等药品,其主要ADR也是以过敏反应为主。过敏反应发生的原因与药物在结构上的细微差别、生产和贮藏过程中引入的杂质有关,尤其是中药注射剂,其有效成分复杂,药物本身及生产过程中未完全除去的鞣质、多肽、蛋白质、色素等多种非有效成分,可能成为抗原或半抗原产生过敏反应[9-10]。抗菌药物是严重ADR/ADE的高发药品,国家ADR监测中心病例报告数据库统计显示,抗菌药ADE报告比例接近总体报告的50%;头孢呋辛、头孢曲松以及左氧氟沙星等喹诺酮类药品的ADE报告总数、严重报告数量在抗菌药中均占较高比例,死亡病例报告数量位居抗菌药首位,与其作为国家基本药物品种,临床使用量大密切相关[11-13],应引起临床医务人员的重视。
[1]杨华,魏晶,王嘉仡,等.药品不良反应/事件报告评价方法研究[J].中国药物警戒,2009,6(10):581-583.
[2]胡扬,张波,王兰,等.2008-2012年我院严重药品不良反应报告分析[J].药物流行病学杂志,2014,23(8):468-491.
[3]陈新谦,金有豫,汤光.新编药物学[M].17版,北京:人民卫生出版社,2011:11-14.
[4]曹军华,韩勇,陈东生.1 596例药品不良反应报告分析[J].药物流行病学杂志,2012,21(9):431-433.
[5]孙言才,刘斌,苏丹,等.12 249例药品不良反应报告中年龄分布的分析评价[J].药物流行病学杂志,2014,23(1):29-34.
[6]陶玲玲,高杰,金鸿宾.162例严重药品不良反应报告分析[J].医药导报,2013,32(12):1671-1673.
[7]胡耀梅,邵寅,蔡小曼.荆门地区1 814例药品不良反应报告分析[J].药物流行病学杂志,2014,23(1):42-45.
[8]国家食品药品监督管理总局.药品不良反应信息通报第21期警惕注射用头孢哌酮钠-舒巴坦钠、清开灵注射剂的严重不良反应[EB/OL].(2009-04-20)[2015-04-03].http://www.sda.gov. cn/WS01/CL0078/37315.html.
[9]李荣,蒋英蓝,曾敬怀,等.中药注射剂发生不良反应的相关性研究进展[J].中成药,2013,35(5):1059-1061.
[10]郭胜才.参麦注射液不良反应文献分析[J].中国药物应用与监测,2014,11(2):115-117.
[11]国家食品药品监督管理总局.药品不良反应信息通报第14期警惕头孢曲松钠的严重过敏反应、头孢曲松钠临床使用中应注意的问题[EB/OL].(2008-07-10)[2015-04-03].http://www. sda.gov.cn/WS01/CL0078/31220.html.
[12]国家食品药品监督管理总局.药品不良反应信息通报第56期警惕左氧氟沙星注射剂的严重不良反应[EB/OL].(2013-08-02)[2015-04-03].http://www.sfda.gov.cn/WS01/CL 0078/82939.html.
[13]国家食品药品监督管理总局.药品不良反应信息通报第58期关注氟喹诺酮类药品的严重不良反应[EB/OL].(2013-11-21)[2015-04-03].http://www.sda.gov.cn/WS01/CL 0078/94324.html.
Report Analysis of Serious Adverse Drug Reactions/Events of 181 Cases
Tang Song1,Zhang Wanzhi1,Tang Xiaoxia2
(1 Pharmacy of Pu Ai Hospital of Anlu City,Hubei Anlu 432600,China;2 Pharmacy of Xiaogan Central Hospital,Xiaogan 432000)
Objective:To investigate the occurrence characteristics of adverse drug reactions so as to provide a reference for ADR monitoring.Methods:About 181 cases of severe ADRs/ADEs were extracted from 8 258 ADR/ADE cases reported by Xiaogan City to the National Adverse Drug Reaction Monitoring System from 2011 to 2014.A statistical analysis was made on the patient’s sex,severity,relativity of ADR/ADE,related drug species,routeofadministration,involvingorgans,clinicalmanifestationsandoccurrencecharacteristicsofsevere ADRs/ADEs.Results:About 181 case reports of severe ADR/ADE were mainly from medical institutions(173 cases,95.58%)and clinical physicians(104 cases,57.46%),and ADRs/ADEs were mainly induced by antibacterials(97 cases,53.59%),Chinese medicine injections(23 cases,12.71%)and intravenous dripping(133 cases,73.48%). Among 181 cases of severe ADRs/ADEs,there were 80 cases of severe allergic reactions(42.20%)and 36 cases of skin and appendages disorders(19.89%).The top three drugs causing ADR were cefoperazone sulbactam(14cases),shenmai injection(10 cases)and cefuroxime(10 cases).Conclusion:From 2011 to 2014 the high incidence of ADR/ADE occurred in children and elderly people in Xiaogan city,and allergic reactions were mostly induced by antibacterial drugs,Chinese medicine injections and intravenous dripping.More attention should be paid to clinical medication.
Adverse Drug Reaction;Adverse Drug Event;Report;Monitoring
10.3969/j.issn.1672-5433.2015.10.010
2015-04-17)
汤松,男,主管药师。研究方向:临床药学。E-mail:466322893@qq.com
张万智,男,主任药师。研究方向:临床药学。通讯作者E-mail:13635816725@163.com
