紫薯内生真菌代谢产物抑菌、抗氧化活性研究
2015-11-07杨林石红霞薛鸿燕周小凯刘晓风
杨林,石红霞,薛鸿燕,周小凯,刘晓风
(1.兰州理工大学 生命科学与工程学院,甘肃 兰州 730050)
紫薯内生真菌代谢产物抑菌、抗氧化活性研究
杨林1,石红霞1,薛鸿燕1,周小凯1,刘晓风1
(1.兰州理工大学 生命科学与工程学院,甘肃 兰州 730050)
紫薯具有很高的营养价值,且含有丰富的内生菌,是抑菌及抗氧化等活性物质的重要来源。本研究采用滤纸片法和紫外分光光度法对紫薯块茎中分离得到的14株内生真菌的发酵产物,进行体外抑菌和抗氧化实验。实验结果表明:紫薯内生真菌发酵产物中乙酸乙酯萃取部位抑菌活性最强,正丁醇部位活性强于菌体甲醇提取部位,其中,菌株ZS107的乙酸乙酯部位对革兰氏阴性菌具有极显著的抑菌活性;抗氧化实验,结果表明ZS101和ZS102的乙酸乙酯部位Vc当量大于100mg/mL,ZS204的乙酸乙酯部位样品的DPPH自由基清除能力明显高于其他样品,清除羟基自由基能力较弱。紫薯内生真菌代谢产物,具有较好的抗菌及一定的抗氧化等活性,具有较高的研究价值。
紫薯 内生真菌 抑菌 抗氧化
紫薯(Solanum tuberodsum L.),为旋花科甘薯属草本植物,俗称紫山芋、黑薯,薯肉为紫色至深紫色,又称黑薯。具有通便、防癌、抗癌、清除自由基、抗衰老、抗突变、改善肝功能、降血压、预防动脉硬化等功能,是当前首推的无公害、绿色、有机保健食品[1]。目前对紫薯的研究都集中在对紫薯色素的提取及性质研究以及对紫薯花青素的研究,而对紫薯内生菌的研究尚未见报道。本研究结果表明,紫薯中含有较为丰富的内生真菌,是抗菌及抗氧化等活性物质的重要来源,为进一步从紫薯内生菌中分离筛选新药先导化合物提供了科学依据。
1、材料与方法
1.1 材料
内生真菌 于2014年,从新鲜无病害的紫薯块茎中分离得到的14株内生真菌,菌种保存于兰州理工大学生命科学实验中心。
试剂 DPPH(Aladdin chemistry Co.Ltd,96%,批号46046)、维生素C、水杨酸、无水乙醇、30% 过氧化氢,硫酸亚铁、铁氰化钾、磷酸氢二钠、磷酸二氢、三氯乙酸、氯化铁等试剂均为分析纯。
仪器 AB104-N电子天平(Mettle-Toledo);ES-2002H电子天平(长沙湘平);CARY 50 Probe UV-Visible spectrophotometer (VARIAN Australia RTY LTD),RE-52CS型旋转蒸发仪(上海亚荣),SHB-ⅢA型循环水式多用真空泵(郑州长城科工贸有限公司),DZF-6020型真空干燥箱(上海博迅实业有限公司)。
指示菌:G+性菌:金黄色葡萄球菌(Staphyloccocus aureus)、地衣芽孢杆菌(Bacillus licheniformis)、乳链球菌(Streptococcus uberi)和G-性菌:大肠杆菌(Escherichia coli)、绿脓杆菌(Pseudomonas aeruginosa)、肺炎克雷伯菌(Klebsiella pneumoniae),菌种引自兰州理工大学生命科学实验中心。
1.2 实验方法
1.2.1 代谢产物的发酵及处理
内生真菌接种于PDA培养基,28℃培养箱内活化3天,后接种于含200mL PDB培养基的500mL锥形瓶内。置于转速为160r/min的摇床中28℃下培养两周。发酵结束后,将菌体与菌液离心分离。菌液依次用等体积的乙酸乙酯、正丁醇萃取3次,分别合并有机相并回收溶剂,得乙酸乙酯萃取部位和正丁醇萃取部位;菌体50℃烘箱干燥,研钵研磨均匀后,用30倍体积甲醇回流提取3次,每次1h,过滤,滤液回收甲醇,得菌体甲醇提取部位。各于50℃干燥至恒重,备用[2]。
1.2.2 抑菌活性测定
抑菌活性测定采用滤纸片法[3]。样品用DMSO配制成5mg/mL样液。调节菌体浓度至106CFU/mL,取100μL涂布于牛肉膏蛋白胨培养基,并将直径5mm的无菌滤纸片置于带菌平板上,轻压使其与培养基表面接触,后用微量移液器吸取15μL样液滴于纸片上,溶剂DMSO为阴性对照,10U的硫酸链霉素或25U的青霉素钠为阳性对照,每个样品设3个平行。于37℃培养24h,十字交叉法测定各样品抑菌圈的大小。并对有较好抑菌效果的样品使用二倍稀释法[73]进行最小抑菌浓度的测定,样品用DMSO稀释为5mg/mL、2.5mg/mL、1.25mg/mL、0.625mg/mL、0.3125mg/mL、0.15625mg/mL浓度。
1.2.3 抗氧化活性测定
总还原力的测定 采用铁氰化钾还原法。将样品用DMSO配成1mg/mL溶液,取样液2.5mL,依次加入0.2mol/L pH=6.6的磷酸盐缓冲液2.5mL和l%铁氰化钾(K3Fe(CN)6)溶液2.5mL。50℃水浴中保温20min后快速冷却。再加10%三氯乙酸溶液2.5mL(如有沉淀离心除去),取上清液2.5mL,依次加入蒸馏水2.5mL和0.1%三氯化铁溶液0.5mL,振荡混匀,静置10min后,在700nm处测定其吸光度值,同时以阳性对照Vc做标准曲线,算出样品Vc当量[4]。
DPPH自由基清除活性的测定 采用水杨酸法,将样品用DMSO配成0.05mg/mL溶液。在同一具塞试管中加入0.025mg/mL的DPPH·乙醇溶液和样品溶液各2mL,摇匀,室温避光静置30min,用无水乙醇作参比溶液,在5l7nm处测量吸光度值A样品。用2mL无水乙醇代替样品,测定空白吸光度A空白。用2mL无水乙醇代替DPPH·乙醇溶液,测定吸光度值为A对照[5]。如下公式计算:
羟基自由基清除活性的测定:将样品用DMSO配成0.8mg/mL溶液。于10mL比色管中依次加入6mmol/L的硫酸亚铁水溶液1mL,6mmol/L的水杨酸·乙醇溶液1mL后,加入1mL样液,再加0.1%的过氧化氢1mL,用蒸馏水定容,摇匀后于37℃水浴30min, 510nm测吸光度值A样。用1mLDMSO溶液代替样品,测定空白吸光度A空白。用1mL水溶液代替H2O2,测定吸光度A对照 。按下式计算:

2、结果与分析
2.1 抑菌活性测定结果
42个样品中有17个样品对6种指示菌均表现出抑制活性,占总测试样品的40%;其中乙酸乙酯部位对6种指示菌均有抑制作用的有11个,正丁醇部位有4个,菌体甲醇部位有2个;有5个样品对6种指示菌有较强的抑制作用(抑菌圈直径10-20mm),分别是ZS102、ZS112、ZS204、ZS301的乙酸乙酯部位和ZS302的正丁醇部位;ZS107和ZS108的乙酸乙酯部位和ZS101、ZS102的正丁醇部位对6种指示菌均有很强的抑制作用(抑菌圈直径20-45mm),其中对金黄色葡萄球菌抑制作用最强的为ZS107的乙酸乙酯部位,抑菌圈直径为35mm,对地衣芽孢杆菌和乳链球菌抑制作用最强的为ZS108的乙酸乙酯部位,抑菌圈都为27mm,对大肠杆菌、绿脓杆菌、肺炎克雷伯菌抑制作用最强的均为ZS107的乙酸乙酯部位,抑菌圈直径分别为41mm、42mm、41mm。抑菌试验数据如表1所示:(+++++) <35mm;(++++++)40mm;(+++++++)<45mm③低活性:中<15mm:中等活性1 5mm≤中<20mm:高活性:中≥20 mm
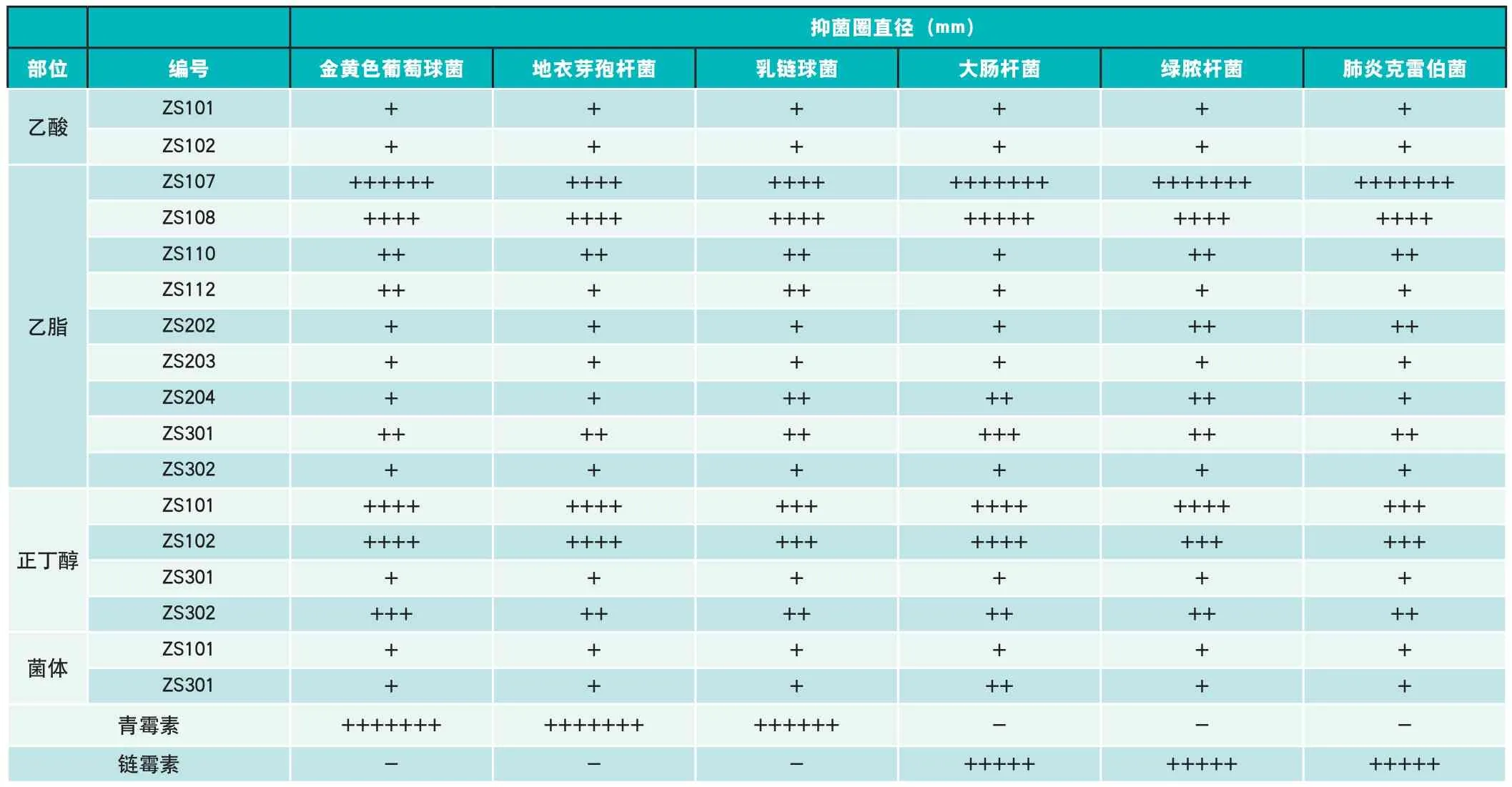
表1 紫薯内生真菌发酵产物抑菌活性测定结果
对抑菌圈直径大于20mm的样品进行最小抑菌浓度的测定结果表明,ZS107的乙酸乙酯部位对肺炎克雷伯菌的抑制效果最强,其最小抑菌浓度为0.15625mg/mL,ZS108的乙酸乙酯部位对地衣芽孢杆菌、绿脓杆菌、肺炎克雷伯菌的最小抑菌浓度均达到0.15625mg/mL,ZS301的乙酸乙酯部位对地衣芽孢杆菌的最小抑菌浓度达到0.15625mg/mL;ZS101的正丁醇部位对金黄色葡萄球菌和绿脓杆菌的最小抑菌浓度达到0.15625mg/mL,ZS102的正丁醇部位只有对肺炎克雷伯菌的最小抑菌浓度达到0.15625mg/mL,而ZS302的正丁醇部位除了对乳链球菌和大肠杆菌的最小抑菌浓度为2.5mg/mL为对其余4个指示菌的最小抑菌浓度都达到0.15625mg/mL, 最小抑菌浓度测定结果如表2:

表2 紫薯内生真菌最小抑菌浓度MIC测定结果(mg/mL)
2.2 抗氧化活性测定结果
2.2.1 总还原力测定结果
42个样品中表现出有还原总力的有41个,其中还原能力乙酸乙酯部位>正丁醇部位>菌体部位;Vc相当含量超过100的有2个样品,分别是ZS101和ZS102的乙酸乙酯部位;其中ZS102的乙酸乙酯部位最高,达到129.6μg/mL。如图1
所示:
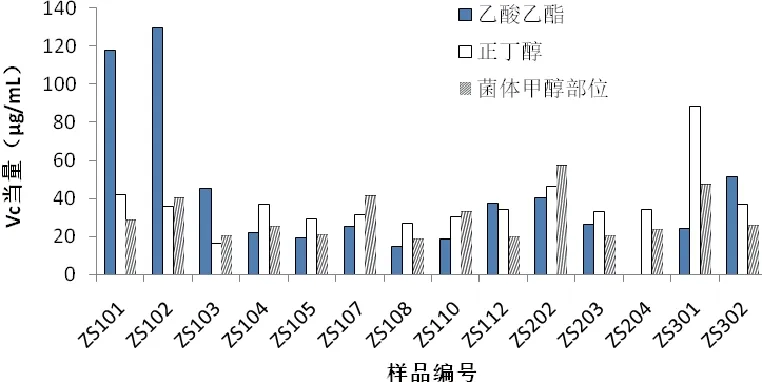
图1 紫薯内生真菌总还原力测定结果
2.2.2 清除DPPH.测定结果
42个样品表现出DPPH自由基清除活性的有26个,占总样品的61.9%;其中只有ZS204的乙酸乙酯部位的清除率大于50%(84.57%);其他样品对DPPH自由基的清除作用均较弱。Vc的清除率为96%。测定结果如图2所示:

图2 紫薯内生真菌对DPPH·自由基清除作用测定结果
2.2.3 清除羟基自由基测定结果
40个样品有一定的清除作用,清除率均小于50%,整体清除效果较差。对羟基自由基的清除作用最强的是ZS107的乙酸乙酯部位(40.23%)。整体来看,乙酸乙酯部位样品清除率高于正丁醇和菌体部位。如图3所示:

图3 紫薯内生真菌对羟基自由基的清除作用
3、结果及讨论
抑菌实验结果表明,大多数内生菌发酵产物对指示菌具有一定的抑菌活性,乙酸乙酯部位抑菌活性强于正丁醇部位,正丁醇部位强于菌体甲醇部位。其中,ZS107的乙酸乙酯部位对3种革兰氏阴性菌的抑菌效果极明显,抑菌圈均大于40mm,超过Vc的抑菌圈,有必要对该菌进行进一步研究,有望从中发现抑菌活性较好的化合物。


抗氧化结果表明,总还原能力测试中Vc相当含量高的样品较少,DPPH自由基清除实验中ZS204的乙酸乙酯部位的清除率较高。对羟基自由基的清除作用不太明显,说明紫薯内生真菌发酵产物的抗氧化活性较弱。

本研究为后续紫薯研究和利用作了一定的铺垫,也为从紫薯内生真菌代谢产物中分离得到抗氧化,抑菌作用的化合物提供依据。
[1]杨巍,黄洁琼,陈英,王和才,朱庆珍,徐家荣.紫薯的营养价值与产品开发.农产品加工学刊[J],2011,253(8):41-42
[2]Verraest, Peter, et al.Modiication of inulin with amidoxime groups and coordination with copper ions [J].Carbohydrate Polymers,1998,37:209-214
[3]张佳,王莹,张峰.滤纸片法测定黄花蒿提取物对霉菌的抑制活性[J].湖北农业科学,2009, 48(5):1153-1154
[4]L iang C H, Syu JL, Mau JL.Antioxidant properties of solid-state fermented adlay and rice by Phellinus linteus [J].Food Chemistry,2009,116(4): 841-845
[5]Aruomaoi.Nutrition and health aspects of free radical sand antioxidants [J].Food Chemistry Toxic,1994,32(7):671-683
[6]颜军,苟小军,邹全付等.分光光度法测定Fenton反应产生的羟基自由基[J].成都大学学报(自然科学版),2009,28(2):91-93
[7]Smirnoff N, Cumbes QJ, Hydroxyl radical scavenging activity of compatible solutes [J].Phytochemistry,1989,28(4):1057-1060
