米曲霉As-W6脂肪酶的分离纯化及酶学性质研究
2015-11-04王开萍李红卫唐正江刘国庆合肥工业大学生物与食品工程学院安徽合肥230009
王开萍,李红卫,吴 娱,唐正江,汤 飞,刘国庆(合肥工业大学生物与食品工程学院,安徽合肥230009)
米曲霉As-W6脂肪酶的分离纯化及酶学性质研究
王开萍,李红卫,吴娱,唐正江,汤飞,刘国庆*
(合肥工业大学生物与食品工程学院,安徽合肥230009)
米曲霉As-W6的脂肪酶发酵上清液经硫酸铵分级沉淀、透析、DEAE-52纤维素离子交换层析和Sephadex G-75葡聚糖凝胶过滤层析纯化后得到电泳纯的脂肪酶,纯化倍数为86.7倍,回收率为23.2%,相对分子质量为40.8 ku,酶学性质研究结果表明,该脂肪酶最适反应温度和最适pH分别为40℃和7,在40℃以下和pH6~8之间有较好的稳定性;Ca2+、Mg2+和丙酮能够明显促进提高脂肪酶的活性,而Cu2+、Fe2+、Mn2+和SDS对其有显著抑制作用;当大豆油作为底物时该脂肪酶的酶活力最高,表明其对大豆油具有显著的特异性。
米曲霉,脂肪酶,分离纯化,酶学性质
脂肪酶(acylglycerol hydrolases,EC 3.1.1.3)是一类能催化水解脂肪酸和油脂为甘油和游离脂肪酸的生物催化剂,广泛存于动物、植物各种组织和微生物中[1]。脂肪酶因具有巨大的生理意义和工业应用范围而受到广泛关注,近年来,脂肪酶已广泛应用于食品、药品、化妆品、洗涤剂、制革、有机合成等行业[2]。生物来源的脂肪酶具有比动植物更广的作用pH、作用温度范围,以及底物专一性,且微生物来源的脂肪酶一般都是分泌性的胞外酶,适合于工业化大生产和获得高纯度样品,因此微生物脂肪酶是工业用脂肪酶的重要来源[3]。最常用的脂肪酶生产菌有曲霉、根霉、毛霉、青霉菌属等[4-6]。米曲霉是脂肪酶生产者之一,且米曲霉脂肪酶具有良好的生物安全性,因而被广泛应用在脂肪酶生产行业或其他相关行业[7-8]。Aspergillus oryzae As-W6是本实验室筛选保存的一株产脂肪酶菌,产酶量高,培养要求简单,可进行大批量生产,国内外有关米曲霉产脂肪酶的研究相对较少,文献报道的米曲霉所产脂肪酶的温度、pH作用范围不大,稳定性不高[9-10]。本文对该米曲霉脂肪酶的分离纯化进行研究,提供了一种有关脂肪酶分离纯化的方法,该脂肪酶具有良好的温度稳定性和pH稳定范围,其具有良好的工业应用前景。
1 材料与方法
1.1材料与仪器
Aspergillus oryzae As-W6本实验室选育保存菌种;DEAE纤维素、Sephadex G-75葡聚糖凝胶、聚丙烯酰胺Marker Sigma公司;SDS-PAGE凝胶配制试剂盒上海碧云天生物技术有限公司;硫酸铵、甲醇、乙醇、丙醇、聚乙烯醇、橄榄油国药化学试剂有限公司,分析纯。
SW-CJ-1D型超净工作台苏州净化有限公司;SPX-150B型生化恒温培养箱上海博泰实验设备有限公司;752型紫外可见分光光度计上海光谱仪器有限公司;SYQ-DSX-280B型高压灭菌锅上海申安医疗器械厂;THZ-92B型摇床上海博泰实验设备有限公司;HH-2型数显恒温水浴锅金坛市杰瑞尔电气有限公司;TDL-50B型台式离心机上海安亭科学仪器厂;SBE-6003型电泳仪上海博彩生物技术有限公司;GmbH紫外凝胶成像系统美国Biostep公司。
1.2脂肪酶的发酵生产与制备
脂肪酶的发酵生产参照陈林林等[11]的报道。菌种在PDA培养基上活化后,用无菌水制成孢子悬浮液,每毫升含105~106个孢子。按2%的接种量接到发酵培养基(酵母浸膏1%,葡萄糖1%,(NH4)2SO40.1%,KH2PO40.1%,MgSO40.05%,KCl 0.05%,NaNO30.05%,橄榄油乳化液4%)中,在32℃,180 r/min发酵培养72 h。
1.3脂肪酶酶活的测定
脂肪酶酶活的测定采用聚乙烯醇橄榄油乳化液水解滴定法[12]。酶活力单位定义:在40℃,pH7.0条件下水解橄榄油乳化液,每分钟产生1 μmol游离脂肪酸所需要的酶量,即为1个脂肪酶活力单位(1U)。
1.4蛋白质含量的测定
蛋白质含量的测定采用Bradford法[13]测定,用牛血清蛋白(BSA)作为标准蛋白。
1.5脂肪酶的分离纯化
1.5.1硫酸铵沉淀参考舒正玉等[14]的方法加以改进,将发酵液用双层纱布过滤后,4℃,12000 r/min离心20 min得到发酵上清液,用0.45 mm的微孔滤膜过滤上清液除去橄榄油。收集滤液,将其作为酶液的粗提取,酶活被定义为100%,用来计算纯化过程中的回收率,回收率=每步总活力/原液总活力,比活力=总活力/总蛋白。先将粗酶液中加入硫酸铵细粉末至30%饱和度,去除杂蛋白沉淀,再向上清液中加入硫酸铵细粉末至80%饱和度,离心收集沉淀,透析脱盐后冷冻干燥保存备用。
就在族长即将暴怒时,一个声音从后方天葬院中传了出来:“我以天葬师之名,接受你的诉求,为了云浮的未来,敬祈天神!”
1.5.2离子交换层析将上述保存的酶溶解于0.05 mol/L,pH=7的Tris-HCl缓冲液中,然后上样于装有DEAE-52纤维素的层析柱中(1.8 cm×100 cm),以0~1.0 mol/L NaCl线性梯度洗脱,洗脱液流速为1.0 mL/min。在280 nm波长下,测定每管洗脱液的酶活力,收集合并有活性部分,真空冷冻干燥。
1.5.3凝胶过滤层析将上一步冷冻干燥的酶粉溶解于0.05 mol/L、pH=7的Tris-HCl缓冲液中,然后上样于装有Sephadex G-75葡聚糖凝胶的层析柱中(2.6 cm× 10 cm),以0~1.0 mol/L NaCl线性梯度洗脱,洗脱液流速为1.0 mL/min。按上述方法测定每管洗脱液的酶活性,收集合并有活性部分,真空冷冻干燥。
1.5.4脂肪酶分子量的测定采用聚丙烯酰胺不连续凝胶电泳法(SDS-PAGE)测定纯化酶的分子量,参照1970年Laemmli的方法[15],根据胶浓度与最佳分离分子量范围的关系,选取分离胶的浓度为12%,浓缩胶的浓度为5%,用考马斯亮蓝G-250染色。蛋白质标准Marker的分子质量为19~117 ku。
1.6酶学性质研究
1.6.1不同温度对脂肪酶活性及其稳定性的影响将反应体系分别置于在20、30、40、50、60℃的水浴中,分别测定脂肪酶的酶活力,确定最适反应温度。取同样浓度的脂肪酶分别置于20、25、30、35、40、45、50、55、60℃的水浴中保温4 h,每隔1 h取样测定残留酶活,用未经处理的酶液的酶活为100%。
1.6.2不同pH对脂肪酶活性及其稳定性的影响将酶液分别与等量的pH4~10的系列缓冲液混合,测定脂肪酶的酶活。系列缓冲液为:50 mmol/L醋酸盐缓冲液(pH4~5),50 mmol/L柠檬酸缓冲液(pH5~6),50 mmol/L磷酸盐缓冲液(pH6~8),50 mmol/L Tris缓冲液(pH8~9),50 mmol/L碳酸盐缓冲液(pH9~10)。脂肪酶在pH4~10条件下分别在40℃保温1 h后,测定脂肪酶残留酶活,以最适条件下的酶活为100%。
1.6.3不同金属离子对脂肪酶活性的影响在测酶活反应体系中,分别加入终浓度为1 mmol/L和5 mmol/L的Fe2+、Zn2+、Mg2+、Ca2+、Cu2+、Mn2金属盐离子,阴离子均为氯离子,30℃下放置30 min,分别测定脂肪酶的残留酶活,以不加金属离子的酶液作对照(100%)。
1.6.4不同有机溶剂对脂肪酶活性的影响将甲醇、乙醇、丙酮、EDTA、SDS、Tween-80 6种有机溶剂分别按1%、5%的量加入酶反应体系,然后反应30 min,分别测定脂肪酶的残留酶活,以未加入有机溶剂的酶液作为对照组(100%)。
1.6.5脂肪酶对不同底物的水解特异性参照Rigo等[16]的方法测定脂肪酶对不同底物的水解特异性,将橄榄油、大豆油、棕榈油、丁酸甲酯、辛酸甲酯、月桂酸甲酯、棕榈酸甲酯和硬脂酸甲酯作为脂肪酶水解反应的底物,分别测定脂肪酶的酶活,以橄榄油为底物测得的酶活为100%。
2 结果与分析
2.1脂肪酶的纯化
牛血清蛋白标准曲线如图1所示,y=5.93x-0.01,R2=0.9978,蛋白质浓度和吸光度呈良好的线性相关,根据标准曲线计算样品蛋白的含量。经硫酸铵分级沉淀、DEAE-52纤维素阴离子交换层析和Sephadex G-75凝胶过滤层析纯化后,脂肪酶蛋白纯化了86.7倍,回收率为23.2%,比活力为528.7。其中Sephadex G-75凝胶过滤层析效果最佳,这一步纯化了6.9倍,纯化结果见表1。采用聚丙烯酰胺不连续凝胶电泳法(SDS-PAGE)测定纯化酶的分子量,结果见图2,图中第1列为蛋白质标准Marker,第2列为粗酶液;第3列为纯酶。从图2中可以看出,第2列的粗酶液电泳所得的条带不止一条,除目标酶外还有三条颜色和清晰度均比较暗的条带,而纯化后的酶的条带如第3列所示,呈现明亮清晰的单一条带,目标蛋白位于34~49 ku之间,这说明目标脂肪酶得到了较好的纯化,回收率较高。通过Quantity One软件对凝胶图像分析计算,得出目标脂肪酶蛋白的分子量约为40.8 ku。

表1 米曲霉脂肪酶的纯化Table 1 Purification of lipase from Aspergillus oryzae As-W.6

图1 牛血清蛋白标准曲线Fig.1 The standard curve of BSA

图2 米曲霉脂肪酶的SDS-PAGE凝胶电泳分析图Fig.2 SDS-PAGE analysis of lipase
2.2米曲霉脂肪酶的最适温度及温度稳定性
在20~60℃下分别测定脂肪酶的酶活力,结果见图3,酶的最适反应温度为40℃,在温度不高于40℃时,酶活力随温度的升高而增加,当温度高于40℃时,酶活力会随着温度的升高而降低,当温度达到60℃时,酶活力仅为最适反应温度酶活力的8.6%。从图4中可以看出,该酶在35℃下保温4 h后还有83.2%的残余酶活,所以该酶在25~35℃具有较好的稳定性。

图3 温度对脂肪酶酶活力的影响Fig.3 Effect of temperature on enzyme activity

图4 脂肪酶的温度稳定性Fig.4 Heat stability of lipase
2.3脂肪酶的最适pH和pH稳定性
由图5可知,脂肪酶作用的最适pH为7,且在pH在6~7.5范围内,酶活力均在80%以上。将脂肪酶酶液加入上述不同pH的缓冲液中,在40℃下保温1 h后测定脂肪酶酶活,结果见图5。观察酶的pH稳定性曲线可知,在1 h的保温时间内,在pH<7时,pH的稳定性会随着pH的增大而增强;在pH>7时,pH的稳定性会随着pH的增大而减弱。在pH=4时保温1 h后,酶活力为保温前的酶活力的32.5%,但是在pH=10时保温1 h后,酶活力仅为保温前的酶活力的28.7%。由以上可知,该脂肪酶的最适反应pH为7,在pH 6~8时有较高的活力且在保温1 h后能保存70%以上的酶活。
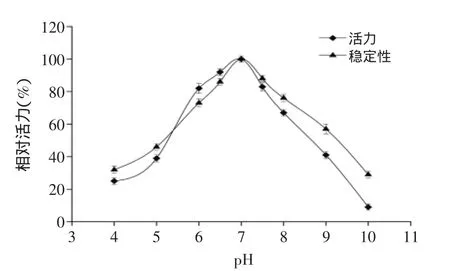
图5 pH对脂肪酶的酶活力和稳定性的影响Fig.5 Effect of pH on enzyme activity and stability
2.4金属离子对脂肪酶活性的影响
如图6所示,在常见的几种二价金属离子中,浓度为1 mmol/L的Ca2+、Mg2+和Zn2+均能够激活酶的活性,金属离子浓度增加为5 mmol/L时,Ca2+、Mg2+对酶活性的激活性降低,而Zn2+则抑制酶的活性,Cu2+、Fe2+、Mn2+对酶活性的抑制作用增强,这可能是由于金属离子浓度升高对酶活性起抑制作用。不同金属离子对酶活力的影响不同,其中Cu2+、Fe2+对酶活力的抑制作用极强,Mn2+对酶活力也有抑制作用。此外,酶活力会随着几种金属离子浓度的增加均有所降低。因此,可以选择适当浓度的Ca2+、Mg2+作为该酶的活化剂,提高该脂肪酶的活力。

图6 不同金属离子对脂肪酶活性的影响Fig.6 Effect of various metal ions on enzyme activity
2.5有机溶剂对脂肪酶活性的影响
如图7所示,在常见的几种有机溶剂中,甲醇(1%)、丙醇(1%)和Tween-80(1%)能够进一步激活酶的活性,而乙醇、SDS和EDTA则抑制酶的活性。不同浓度的有机溶剂对酶活力的影响不同,但当浓度为5%时,这6种有机溶剂均对酶的活性起抑制作用。和金属离子相比,有机溶剂对酶活力的影响较小。由此可知,该脂肪酶是一种金属酶,金属离子对酶活的影响非常明显。

图7 不同有机溶剂对酶活的影响Fig.7 Effect of various organic solvents on enzyme activity
2.6脂肪酶对不同底物的水解特异性
从图8中可以看出,该脂肪酶对植物油的水解酶活力明显高于几种甲酯酸,其中大豆油表现最为明显的特异性。在5种甲酯酸中,该脂肪酶对C12、C16、C18显现出较高的酶活力,其中在C12时达到最高酶活力,这表明该脂肪酶对于长链甲酯酸表现出较好的水解酶活力,这与Rigo报道的从青霉菌(Penicillium crustosum)中纯化得到的脂肪酶的性质相似[16]。

图8 脂肪酶水解不同底物的特异性Fig.8 Substrate specificity of enzyme
3 结论
Aspergillus oryzae As-W6的脂肪酶发酵上清液经硫酸铵分级沉淀、透析、DEAE-52纤维素离子交换层析和Sephadex G-75葡聚糖凝胶过滤层析纯化后得到电泳纯的脂肪酶,SDS-PAGE电泳结果分析计算出其相对分子质量为40.8 ku,该脂肪酶的最适反应温度和最适反应pH分别为40℃和7,在40℃以下和pH6~8之间具有较好的稳定性。该脂肪酶的酶学性质研究结果表明,Ca2+、Mg2+和丙酮能够明显促进提高脂肪酶的活性,其中Ca2+的活化效果最好,可使酶活提高30%,而Cu2+、Fe2+、Mn2+和SDS对其具有明显的抑制作用;此外该脂肪酶对大豆油表现出显著的特异性。
[1]王颖,陈吉祥,王冰,等.热稳定性脂肪酶生产菌的筛选及其酶学性质研究[J].食品工业科技,2014,35(19):156-161.
[2]Treichel H,Oliveira D,Marcio A,et al.A Review on Microbial Lipases Production[J].Food Bioprocess Tech,2010,3(2):182-196.
[3]徐岩,李建波,王栋.解脂假丝酵母脂肪酶的纯化及性质研究[J].无锡轻工大学学报,2001,20(6):257-260.
[4]Godtfredsen SE.Microbial lipases[M].Microbial Enzymes and Biotechnology,1990:255-274.
[5]Ghosh PK,Saxena RK,Gupta R,et al.Microbial lipases:production and applications[J].Sci Prog,1996,79:119-157.
[6]Rubin B,Dennis EA.Methods in Enzymology:Lipases,Part B:Enzyme Characterization and Utilization[M].Maryland Heights:Academic Press,1997:509-519.
[7]El-Atta H A,Aref I M,Khalil S A.Increased gum Arabic production after infestation of Acacia Senegal with Aspergillus flavus and Pseudomon pseudoalcaligenes Transmitted by Agrilus nubeculosus[J].Biotechnol,2011,10:159-166.
[8]Elbashiti T,Fayyad A,Elkichaoui A.Isolation and identification of Aspergillus oryzae and the production of soy sauce with new aroma[J].Pak J Nutr,2010,9:1171-1175.
[9]Contesini FJ,Lopes DB,Macedo GA,et al.Aspergillus sp.[10]Jing Zhou,Wen-Wei Chen,Zheng-Bao Jia,et al.Purification and Characterization of Lipase Produced by Aspergillus oryzae CJLU-31 Isolated from Waste Cooking Oily Soil[J].Am J Food Technol,2012,7(10):596-608.
lipase:Potential biocatalyst for industrial use[J].J Mol Catal B:Enzym,2010,67:163-171.
[11]陈林林,辛嘉英,张颖鑫,等.粗状假丝酵母产脂肪酶发酵条件的优化[J].食品工业科技,2010(1):183-185.
[12]何耀强,王炳武,谭天伟.假丝酵母99-125脂肪酶的发酵工艺研究[J].生物工程学报,2004,20(6):918-921.
[13]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72:248-254.
[14]舒正玉,杨江科,闫云君.黑曲霉F044脂肪酶的分离纯化及酶学性质研究[J].生物工程学报,2007,23(1):96-100.
[15]Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nat,1970,227:680-685.
[16]Rigo E,Ninow JL,Tsai SM,et al.Preliminary characterization of novel extra-cellular lipase from Penicillium crustosum under solid-statefermentationanditspotentialapplicationfor triglycerides hydrolysis[J].Food Bioprocess Technol,2012,5:1592-1600.
Study on purification and characterization of a lipase from Aspergillus oryzae As-W6
WANG Kai-ping,LI Hong-wei,WU Yu,TANG Zheng-jiang,TANG Fei,LIU Guo-qing*
(College of Biotechnology and Food Engineering,Hefei University of Technology,Hefei 230009,China)
A lipase from Aspergillus oryzae As-W6 was purified to homogeneity by ammonium sulfate precipitation,dialysis,DEAE-52 cellulose column anion exchange chromatography and Sephadex G-75 gel filtration chromatography.The purification protocol resulted in a 86.7-fold purification with a yield of 23.2%,the relative molecular weight of the purified lipase was 40.8 ku.The optimum temperature and pH of the purified lipase was 40℃and 7,respectively.The lipase was stable over ranges of pH(6~8)and under the temperature 40℃. The lipase activity was enhanced by Ca2+,Mg2+and Acetone,while inhibited by Cu2+,Fe2+,Mn2+and SDS.It achieved maximum values when soybean oil used as substrate,which indicated that the lipase showed a significant specificity toward soybean oil.
Aspergillus oryzae;lipase;purification;properties
TS201.1
A
1002-0306(2015)18-0229-05
10.13386/j.issn1002-0306.2015.18.037
2014-11-14
王开萍(1989-),女,硕士研究生,研究方向:食品科学,E-mail:paigewang0919@163.com。
刘国庆(1963-),男,博士,教授,研究方向:食品质量与安全,动物营养研究,E-mail:liugq_168@163.com。
安徽省皖江禽产业研究院基金项目(1401c063015)。
