纤维素酶高产菌株F1—1的选育与产酶条件的优化
2015-10-28王靖李智敏谢纯良等
王靖 李智敏 谢纯良等


摘要:从快速腐烂的苎麻基质中筛选到1株产纤维素酶活力较高的菌株F1-1,分析该菌株的遗传背景,并对其产酶条件进行了优化,以期为下一步纤维素生产燃料乙醇技术的研发提供新的菌种资源。结果表明,F1-1菌株为Bacillus属,其最佳产酶培养基为醋酸纤维素1.0%、纤维二糖0.8%、木糖0.5%、葡萄糖0.2%、麦麸1.2%、玉米粉0.6%、KNO3 0.4%、MgSO4 0.2%、CaCl2 0.05%、NaH2PO4 0.05%和Na2HPO4 0.05%。最佳发酵条件为35~37 ℃、170 r/min振荡培养72 h。经优化培养,纤维素酶活力由优化前的103.20 U/mL提高到优化后的646.53 U/mL。
关键词:纤维素酶;菌株F1-1;产酶条件优化;苎麻;燃料乙醇
中图分类号:S182 文献标识码:A 文章编号:0439-8114(2015)19-4790-04
DOI:10.14088/j.cnki.issn0439-8114.2015.19.034
Abstract: Strain F1-1, which can produce cellulose, was screened from rapidly-corrupted ramie matrix. In order to provide new strain resource for the further research of the technology to produce fuel ethanol from fiber, the strains genetic background was analyzed and its fermentation conditions were optimized. The results showed that strain F1-1 belongs to Bacillus. The optimal medium contained 1.0% cellulose acetate, 0.8% cellobiose, 0.5% xylose, 0.2% glucose, 1.2% wheat bran, 0.6% corn flour, 0.2% KNO3, 0.2% MgSO4, 0.05% CaCl2, 0.05% NaH2PO4 and 0.05% Na2HPO4. The optimal fermentation condition was shake cultivation about 72 hours at 35~37 ℃ and 170 r/min. By optimization, the enzyme activity increased from 103.20 U/mL to 646.53 U/mL.
Key words: cellulase;strain F1-1; optimization of fermentation conditions; ramie; fiber ethanol
为了应对能源危机,世界各国都在开发高效、清洁的可再生资源,其中发展最快的是燃料乙醇,利用农业废弃物等木质纤维素原料发酵生产燃料乙醇已成为研究的热点和趋势[1-3]。农作物秸秆的主要结构是木质素、半纤维素、纤维素,其中,纤维素含量最高[4,5]。生产燃料乙醇首先要对农作物秸秆进行降解,各降解法中以酶水解方式最具优势[6],尤其是纤维素酶用量最多。纤维素酶是降解纤维素生成葡萄糖的一组酶的总称,是一种复合酶,作用于纤维素以及从纤维素衍生出来的产物[7]。纤维素酶大致由3个组分构成,分别为外切葡聚糖纤维二糖水解酶(CBH)、内切葡聚糖酶(EG)和β-葡萄糖苷酶(CB)。EG对葡聚糖链进行随机切割,生成较小的寡聚糖;然后由CBH对寡聚糖的非还原端进行水解,生成纤维二糖;再由CB把纤维二糖降解成葡萄糖,从而完成纤维素的完全降解[8,9]。除了用于生产燃料乙醇,纤维素酶在环境行业、食品行业、饲料行业以及日用品行业等均有广泛的应用,是一种重要的工业用酶。目前纤维素酶产业存在的主要问题是生产成本较高[10],因此仍需要加强对纤维素酶高产菌株的选育,为工业生产提供更多研究技术和解决方法。
本研究拟从不同来源的样品中筛选产纤维素酶的菌株,通过对其固体培养基、半固体培养基、培养条件等进行优化,确定最佳培养基配方和发酵条件,为纤维素酶应用乃至纤维燃料乙醇技术的研发等奠定基础。
1 材料与方法
1.1 材料
菌样:取自麻园土、沤麻水、腐烂麻壳、沤麻塘泥、腐烂苎麻基质、农家肥、腐烂木材等。
主要试剂:木糖、醋酸纤维素钠(上海楷洋生物技术有限公司);木聚糖(Sigma公司);纤维素二糖[(生工生物工程(上海)股份有限公司];3,5-二硝基水杨酸(国药集团化学试剂有限公司)。
主要仪器:立式压力蒸气灭菌器(GR110DR型,ZEALWAY);分光光度计(UV-2700,日本岛津);离心机(TGL-16C,Anke);电热恒温水浴锅(HH·SY21-Ni型,北京长源实验设备厂);电子分析天平(UX6200H型,日本岛津);气浴恒温振荡器(THZ-82B,江苏金坛市医疗仪器厂);生化培养箱(SPX-250B型,天津泰斯特仪器有限公司);超纯水器(RO-200型,台湾艾柯)。
1.2 方法
1.2.1 产纤维素酶菌株的筛选与鉴定
1)初筛。每种样品各取25 g放入三角瓶中,加入225 mL无菌水,130 r/min振荡10 min,用3层纱布过滤除去可见杂质。取滤液30 mL接种到LB培养基中进行富集培养,28 ℃、180 r/min培养过夜。取1 mL菌液稀释到10-4、10-5、10-6,涂布于筛选培养基(1% NaCl,0.5% 蛋白胨, 0.5%醋酸纤维素钠, 1%琼脂),28 ℃恒温培养过夜,挑取平板上水解斑较大的菌落。
2)菌种纯化。将筛选出的菌落进行划线分离,纯化出单菌落。测量菌落大小和水解斑直径,挑取菌落大、产酶旺盛的菌株保存备用。
3)菌种鉴定。设计引物对菌株的16S rDNA序列进行克隆,测序后在NCBI数据库中进行比对分析。引物序列为F:5′-CTTGCTCCCTGATGTTAGACGGCGG-3′;R:5′-ACTTCGGGTGTTACAAACTC
TCGT-3′。
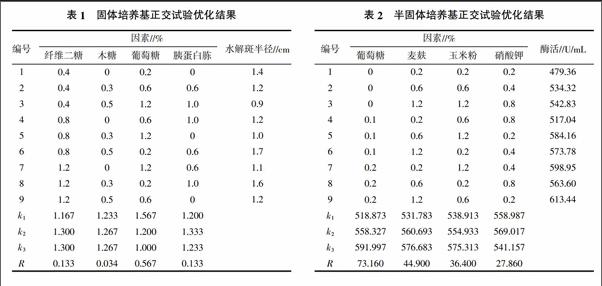
1.2.2 固体培养基成分优化 通过设计正交L9(34)试验初步优化碳源和氮源的组合与添加量,利用培养基上水解斑的大小判断酶活性的大小。固定醋酸纤维素添加量为1.0%,胰蛋白胨和酵母提取物添加量总和为1.0%,无机盐添加量为0.2% MgSO4、0.05% CaCl2、0.05% NaH2PO4和0.05% Na2HPO4。通过调整纤维素二糖(0.4%、0.8%、1.2%)、木糖(0、0.3%、0.5%)、葡萄糖(0.2%、0.6%、1.2%)和胰蛋白胨(0、0.6%、1.0%)添加量进行优化,32 ℃培养3 d。
1.2.3 半固体培养基成分优化 根据固体培养基优化试验结果,固定纤维素二糖、木糖和无机盐等成分添加量,通过设计正交L9(34)试验对葡萄糖(0、0.1%、0.2%)、麦麸(0.2%、0.6%、1.2%)、玉米粉(0.2%、0.6%、1.2%)和硝酸钾(0.2%、0.4%、0.8%)添加量进行优化,32 ℃、150 r/min培养3 d。发酵液经离心收集酶的初提液,用DNS法[11]测定纤维素酶活性。
1.2.4 培养条件单因子优化 根据半固体培养基成分优化结果,进一步考察发酵时间、转速和培养温度对酶活性的影响。①发酵时间。固定培养基,在32 ℃、150 r/min的条件下,分别在发酵1、2、3 、4 d时取样,分离初提酶液,测定纤维素酶活性。②转速。由于培养到第三天时酶活性基本达到较高水平,因此在固定培养基和32 ℃、发酵3 d的条件下考察摇床转速(100、170、220 r/min)对酶活性的影响。③培养温度。固定培养基,在170 r/min发酵3 d 的条件下,对培养温度(28、32、35、37 ℃)进行优化。
1.2.5 酶活性测定 以含0.4%诱导底物(醋酸纤维素钠)、0.5%酵母提取物、0.5%胰蛋白胨和 0.5% NaCl为培养基,接种后在30 ℃、170 r/min条件下培养72 h,测定发酵液的酶活性。取1 mL发酵液以6 000 r/min离心5 min,吸取上清液0.5 mL与预热到50 ℃的2 mL 1%羧甲基纤维素钠盐混合,在50 ℃保温30 min。之后取0.5 mL反应液与0.5 mL DNS试剂混合,放入沸水中5 min,然后加入4 mL去离子水混匀,在540 nm处测定其吸光度。1个酶活性单位(U)为l mL酶液反应1 min生成1 μmol还原糖所需的酶量。
2 结果与分析
2.1 产纤维素酶菌株的筛选与鉴定结果
通过对各基质菌株的筛选,最终从腐烂的苎麻基质中筛选到适宜菌株,在初选培养基上有约10种细菌长势良好,其中F1-1菌株的纤维素酶活力较高。对该菌株进行纤维素酶活性测定,其酶活性为103.20 U/mL。对克隆到的F1-1菌株的16S rDNA序列进行测序,结果(图1)显示,其序列长1 38 2 bp,在NCBI数据库中进行比对分析,发现该菌株与Bacillus属菌株有99%的相似性。
2.2 产酶条件的优化结果
2.2.1 固体培养基成分的优化结果 固体培养基优化结果如表1所示。由表1可知,所用固体培养基的优化结果为醋酸纤维素1.0%、纤维二糖0.8%、木糖0.5%、葡萄糖0.2%、胰蛋白胨0.6%、酵母提取物0.4%、MgSO4 0.2%、CaCl2 0.05%、NaH2PO4 0.05%和Na2HPO4 0.05%,此时水解斑半径最大为1.7 cm。优化后的水解斑加大,效果明显,如图2所示。
2.2.2 半固体培养基成分优化结果 半固体培养基正交试验优化结果见表2。由表2可知,优化试验各组合中纤维素酶活性最高可达613.44 U/mL。在试验范围内F1-1的纤维素酶活性随着葡萄糖、麦麸和玉米粉添加量的增加而提高,而硝酸钾添加量在0.4%时最适合。
2.2.3 培养条件单因子优化结果 不同培养时间对纤维素酶活性的影响见图3。由图3可知,培养1 d时纤维素酶活性最低,可能因菌体数量较少,随着培养时间的延长,纤维素酶活性逐步提高,培养3 d时F1-1菌株的纤维素酶活性接近600 U/mL,培养4 d时纤维素酶活性达到622.68 U/mL。
转速对F1-1菌株的纤维素酶活性的影响见图4。由图4可知,摇床转速为220 r/min时F1-1菌株的纤维素酶活性可达636.44 U/mL,转速为170 r/min时纤维素酶活性为621.25 U/mL,而转速为100 r/min时纤维素酶活性只有409.60 U/mL。
培养温度对纤维素酶活性的影响见图5。由图5可知,培养温度为35 ℃和37 ℃时纤维素酶活性分别达到了645.22 U/mL和646.53 U/mL,而培养温度为32 ℃和28 ℃时纤维素酶活性较低。可见最适的培养温度在35~37 ℃。F1-1菌株产酶条件优化后纤维素酶活性达到了646.53 U/mL。
3 小结与讨论
本研究从麻类来源的不同样品中进行产纤维素酶菌株的筛选,获得产纤维素酶活力较高的F1-1菌株,该菌株初始纤维素酶活性为103.20 U/mL。通过对F1-1菌株的固体培养基、半固体培养基、培养条件等进行优化,使其纤维素酶活性最终达到646.53 U/mL;确定其最佳产酶培养基为醋酸纤维素1.0%、纤维二糖0.8%、木糖0.5%、葡萄糖0.2%、麦麸1.2%、玉米粉0.6%、KNO3 0.4%、MgSO4 0.2%、CaCl2 0.05%、NaH2PO4 0.05%和Na2HPO4 0.05%;最佳培养条件是35~37 ℃、170 r/min振荡培养72 h。
固体培养基优化过程中发现葡萄糖添加量升高不利于F1-1菌株的纤维素酶活性提高,而纤维二糖和木糖添加量的适当提高有助于提高该菌株产纤维素酶活性。培养条件优化过程中发现摇床转速为100 r/min时酶活性较低,这可能跟半固体培养基的分散状态有关,转速低时培养基内非溶解性的固体颗粒物质沉在底部,不利于发酵。
麻类纤维是人类最早利用的纺织纤维之一,从快速腐烂的麻类作物中有利于筛选到产纤维素酶的菌种。相对于其他纤维作物,也可以筛选到一些具有种属特异性的新型菌株,为下一步纤维燃料乙醇技术的研发提供新的菌种资源。
参考文献:
[1] JOHN M J, THOMS S. Biofibres and biocomposites[J]. Carbohydrate Polymers, 2008, 71(3): 343-364.
[2] VENTURI P, VENTURI G. Analysis of energy comparison for crops in European agricultural systems[J]. Biomass and Bioenergy, 2003, 25(3): 235-255.
[3] PERLACK R D, WRIGHT L L, TURHOLLOW A F, et al. Biomass as a feedstock for a bioenergy and bioproducts industry: The technical feasibility of a billion-ton annual supply[EB/OL]. http://wwwostigov/bridge.
[4] 李里特,丁长河,江正强,等.一株产木聚糖酶链霉菌的鉴定及发酵产酶[J].微生物学通报,2003,30(6):59-64.
[5] RONDEAU-MOURO C, BOUCHET B, PONTOIRE B, et al. Structural features and potential texturising properties of lemon and maize cellulose microfibrils[J]. Carbohydrate Polymers, 2003, 53(3): 241-252.
[6] 李素波.纤维素酶高产菌株选育及发酵条件的优化[D].兰州:兰州大学,2008.
[7] 何国庆,丁立孝.食品酶学[M].北京:化学工业出版社,2006.
[8] 赵小蓉,林启美,孙炎鑫,等.纤维素分解菌对不同纤维素类物质的分解作用[J].微生物学杂志,2000,20(3):12-14.
[9] 史 央,蒋爱芹,戴传超,等.秸秆降解的微生物学机理研究及应用进展[J].微生物学杂志,2002,22(1):47-50.
[10] 吕春娥.稻草纤维素酶高产菌株的选育及其产酶条件的优化[D].福州:福建农林大学,2010.
[11] MILLER G L. Use of dinitrosalicylic acid reagent for determination of reducingsugar[J].Anal Chem, 1959, 31(3): 426-428.
