多杀性巴氏杆菌外源基因表达元件的构建及其序列分析
2015-10-28李国攀熊萍萍荣俊
李国攀 熊萍萍 荣俊

摘要:为了在多杀性巴氏杆菌(Pasteurella multocida)中高效表达外源基因,克隆了天冬酰氨合成酶A(asnA)基因的启动子PasnA和终止子TasnA,双酶切获取pUC18质粒的多克隆位点,将这3个片段组装成一个可以方便插入外源基因的表达元件。测序结果分析表明,PasnA是巴氏杆菌asnA基因的强启动子,具有原核生物典型的Pribnow盒和SD序列。pUC18的多克隆位点mcs具有多个核酸限制性内切酶的单一切点,便于外源基因的插入。TasnA是巴氏杆菌asnA基因的强终止子,具有很好的回文结构,在发卡结构后面有一段富含A/T区。3个片段表达元件(PcmsT)的构建为完整的巴氏杆菌-大肠杆菌穿梭表达质粒的构建奠定了基础。
关键词:多杀性巴氏杆菌(Pasteurella multocida);表达元件;天冬酰氨合成酶A基因;启动子;终止子
中图分类号:Q78 文献标识码:A 文章编号:0439-8114(2015)19-4847-04
DOI:10.14088/j.cnki.issn0439-8114.2015.19.050
Abstract: In order to express heterologous genes in Pasteurella multocida efficiently, PasnA (promoter of asparagine synthetase A,asnA), mcs(multiple cloning sites from plasmid pUC18), and TasnA(terminator of asnA) were cloned and ligated together to construct an expression element PcmsT. Sequence analysis showed that PmcsT had some unique restriction sites suitable for cloning in the frame. PasnA, the strong promoter of asnA gene from P. multocida, possessed typical prokaryotic structural characteristics, such as Pribnow box and SD sequence. TasnA, the strong terminator of asnA gene, had a perfect palindrome structure with an A/T-rich region following the hairpin structure. The expression element PcmsT could be used to construct an Escherichia coli- Pasteurella multocida shuttle plasmid in the future studies.
Key words: Pasteurella multocida; expression element; asparagine synthetase A gene (asnA); promoter; terminator
多杀性巴氏杆菌(Pasteurella multocida)是革兰氏阴性杆菌,主要通过呼吸道和消化道黏膜侵染动物,普通动物种群中有30%~80%是该菌的携带者[1,2]。多杀性巴氏杆菌携带内源性质粒是一个比较普遍的现象[3-6],利用质粒携带外源抗原基因至巴氏杆菌中表达,再通过巴氏杆菌对动物呼吸道和消化道的免疫器官递呈抗原是一个基因工程疫苗研究的可行方式。目前,国内外尚未见用巴氏杆菌表达异种抗原蛋白质的报道。本研究旨在对巴氏杆菌表达外源蛋白质的启动子和终止子进行研究,构建一个能在巴氏杆菌中表达外源抗原蛋白质的表达元件,使之成为未来构建巴氏杆菌活菌载体疫苗的研究工具或平台。Boyce等[7]用荧光定量RT-PCR的方法分析了多杀性巴氏杆菌在感染试验鸡后基因组DNA表达量的变化情况,其中asnA、gdhA、ppc、napF等基因的表达量明显提高。控制这些基因表达的启动子都有可能成为控制多杀性巴氏杆菌表达的可用基因,提高其携带的外源基因在感染鸡体内的表达水平。启动子是基因表达调控的重要顺式元件,也是基因工程表达载体的一个重要部分[8]。虽然转录终止子在表达质粒的构建过程中常被忽略,但有效的转录终止子也是表达元件中必不可少的组成部分。在研究过程中,选择巴氏杆菌基因组中调控天冬酰胺合成酶A基因(asnA) 的启动子、终止子序列作为外源基因表达的调控元件的核心组成,在启动子和终止子之间插入来源于pUC质粒的多克隆位点,构建了外源基因在巴氏杆菌中表达的调控元件,为巴氏杆菌-大肠杆菌穿梭表达质粒载体的构建奠定了基础。
1 材料与方法
1.1 菌种
禽多杀性巴氏杆菌G190E40菌株(C48-16)购自武汉中博生化有限公司生物制品厂;大肠杆菌DH5α由笔者所在实验室保存。
1.2 主要药品和试剂
限制性核酸内切酶(BamH Ⅰ、Hind Ⅲ、EcoRⅠ、Sal Ⅰ)购自Ferments公司;EX TaqTM DNA聚合酶、dNTPs、T4 DNA连接酶、pUC18质粒、pMD18-T载体均为大连宝生物公司产品;DL 2 000 DNA Marker购自华美生物工程公司;胰蛋白胨、酵母提取物为OXIOD公司产品;脑心浸出汁肉汤 (BHI)培养基为美国BD公司产品;小量胶回收试剂盒和质粒小量提取试剂盒购于上海华舜生物工程有限公司。
1.3 引物设计
参考May等[9]发布的多杀性巴氏杆菌全基因序列(AE006194)设计了启动子(PasnA)和终止子(TasnA)各两对引物,其序列如下:PasnA F:5′-CCCCGTCGACCTATAAAATTCAAAGTATAT-3′,PasnA R:5′-CCCGAATTCTTGTTGTTGTAAAATAAATGA-3′。在PasnA F的5′端添加一个SalⅠ的限制性内切酶位点,在PasnA R的5′端添加一个EcoRⅠ的限制性内切酶位点(下划线所示)。TasnA F:5′-CCCAAGCTTTAATTATCGTTATTTGTTTCC-3′;TasnA R:5′-CCCGGATCCCGCAGTCCACCCTTTTTTTAT-3′。在TasnA F的5′端添加一个Hind Ⅲ的限制性内切酶位点,在TasnA R的5′端添加一个BamHⅠ的限制性内切酶位点(下划线所示)。引物由生工生物工程(上海)技术服务有限公司合成。endprint
1.4 重组质粒pMD18-T-PasnA和pMD18-T-TasnA的构建
用无菌枪头取少许禽多杀性巴氏杆菌C48-16疫苗冻干粉于10 mL BHI培养液中培养16 h后划板。挑取多杀性巴氏杆菌C48-16单菌落接种于10 mL BHI培养液中,37 ℃摇床振荡培养过夜。取0.2 mL菌液,10 000g离心1 min,弃上清,收集菌体。加入50 μL去离子水重悬菌体,100 ℃煮沸5 min,12 000g离心5 min,上清液即为DNA模板,用于PCR扩增。
分别用引物PasnA F和PasnA R、TasnA F和TasnA R从上述提取的模板中扩增片段PasnA和TasnA。扩增程序为:95 ℃ 变性5 min;94 ℃变性30 s,62 ℃退火 30 s,72℃延伸 30 s,35循环; 72 ℃延伸10 min;4 ℃保存。用1%琼脂糖凝胶电泳分离目的基因,在紫外灯下切下含有长度为158 bp和139 bp的目的片段,用小量胶回收试剂盒回收纯化目的片段。将多杀性巴氏杆菌C48-16的asnA基因的启动子PasnA和终止子TasnA的回收产物分别与载体pMD18-T进行连接,并将连接产物转化至大肠杆菌DH5α,筛选阳性克隆。经过PCR鉴定后,由生工生物工程(上海)有限公司进行序列测定。
1.5 PasnA-mcs-TasnA三联体的构建
用EcoRⅠ和Hind Ⅲ酶切pUC18质粒,回收纯化57 bp的多克隆位点mcs;用SalⅠ和EcoRⅠ双酶切重组质粒pMD18-T-PasnA,回收PasnA 片段(158 bp);用Hind Ⅲ和BamHⅠ双酶切重组质粒pMD18-T-PasnA,回收TasnA 片段(139 bp)。将回收的目的片段PasnA、TasnA和mcs用T4 DNA连接酶连接后,以连接产物为模板,PasnA F和TasnA R为引物进行PCR扩增,回收PasnA、TasnA和mcs片段的连接产物PmcsT(350 bp)。将PmcsT与pMD18-T载体连接,并转化至大肠杆菌DH5α,由生工生物工程(上海)有限公司对转化子进行序列测定。
2 结果与分析
2.1 asnA基因的启动子PasnA和终止子TasnA的PCR扩增结果
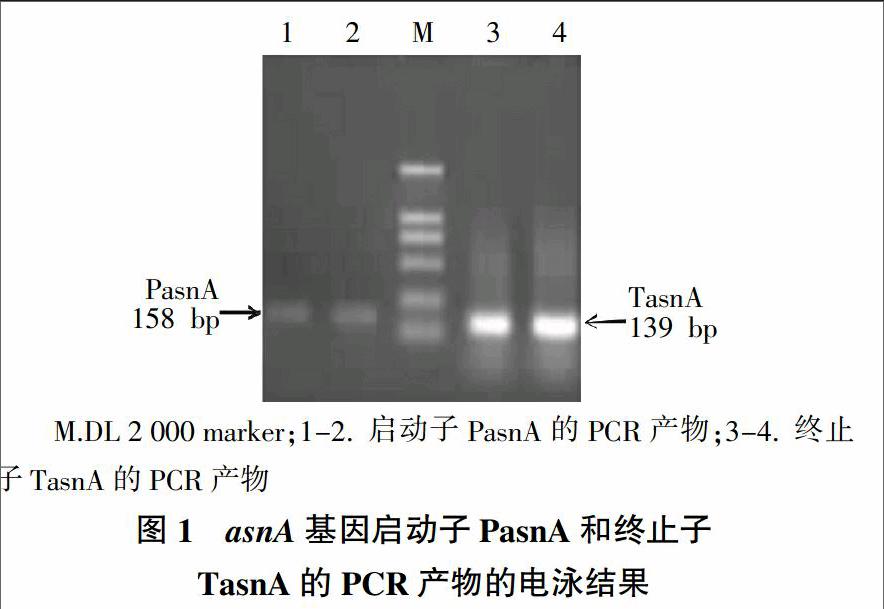
图1为启动子PasnA和终止子TasnA的PCR扩增产物的琼脂糖凝胶电泳检测结果,由图1可知,两片段分别位于158 bp和139 bp附近,表明扩增成功(图1)。
2.2 重组质粒pMD18-T-PasnA和pMD18-T-TasnA的PCR扩增鉴定
重组质粒经PCR鉴定,片段大小与预期结果相符(图2)。
2.6 重组质粒pMD18-T-PmcsT的PCR鉴定结果
用提取的质粒pMD18-T-PmcsT作为模板进行PCR扩增,可得到一条350 bp的DNA条带(图5),和预期结果相符。
3 讨论
启动子是一段供RNA聚合酶定位和促进DNA转录的DNA序列,这个DNA区域常在基因或操纵子编码序列的上游,位于核糖体结合位点(RBS)上游10~100 bp处,由调节基因控制,是DNA分子上可以与RNA聚合酶特异性结合并使之开始转录的部位,但启动子本身不被转录。影响外源基因的表达有很多因素,如启动子、内含子和polyA等,其中启动子的作用最为重要,它是基因工程表达载体的重要元件。理想的启动子具有以下特性:作用强;可以严格调控;容易转导进其他菌体中以便筛选阳性菌株,而且对其诱导是简便和廉价的。本研究克隆的启动子为巴氏杆菌的天冬酰氨合成酶A基因(asnA)的启动子PasnA,该基因活性较强,在它的5′上游区具有比较典型的Pribnow盒,位于相对于转录起始位点-10 bp的位置有一段TATATATTTTAA序列,这是一段由连续12个A或T组成的序列,它们可以与RNA聚合酶相结合,这一序列的核苷酸结构在很大程度上决定了启动子的强度。其SD序列是位于ATG上游8 bp处的富含嘌呤(AAGG)的核苷酸序列。本试验克隆的启动子活性很高,可以用来构建高效表达载体。据报道,天冬酰氨合成酶基因在感染鸡后是非常强的上调基因,3只试验鸡体内感染了巴氏杆菌后其mRNA产生量较体外分别提高了9.3、2.3和6.5倍[7]。据此,我们认为该启动子是一个较好的用于巴氏杆菌在鸡体内表达外源基因的启动子。
在原核生物中,转录终止有两种不同的机制。一种是依赖六聚体蛋白质rho的rho依赖性转录终止,rho蛋白质能使新生RNA转录本从模板解离。另一种是rho非依赖性转录终止,它特异性依赖于模板上编码的信号,即在新生RNA中形成发卡结构的回文序列区和位于该回文序列下游4~9 bp处的dA、dT富含区。虽然转录终止子在表达质粒的构建过程中常被忽略,但有效的转录终止子是表达载体中必不可少的元件。贯穿启动子的转录将抑制启动子的功能,造成所谓的启动子封堵。这种效应可以通过在编码序列下游的适当位置放置转录终止子,阻止转录过程。另有资料证明,由强启动子启动的转录会使转录通读到复制区,造成控制质粒拷贝数的ROP蛋白质的过量表达,从而导致质粒的不稳定。因此,功能可靠的转录终止子能够增强mRNA的稳定性,从而提高蛋白质的表达水平[10]。本试验克隆的禽巴氏杆菌天冬酰氨合成酶A基因的终止子TasnA的序列显示,该序列中有一段很明显且较长的回文序列:AAAAGTGCGGTGG…NN…CCACCGCACTTTT,位于该回文序列下游还有一段A/T富含区。这些现象表明TasnA属于rho非依赖性转录终止子,可以有效终止转录。作为转录终止的信号和组成发卡结构的保护性元件,阻止核酸外切酶对mRNA的降解,从而延长mRNA的半衰期。
穿梭载体(Shuttle vector)是指在两种宿主生物体内复制和能在其中至少一个宿主生物体内表达外源蛋白质的载体分子,因而可以运载目的基因穿梭往返于两种生物之间。穿梭质粒载体一般由表达元件、两种宿主生物体内的复制原点,以及用于转化菌筛选的抗性基因或报告基因等组成。表达元件包括启动子-多克隆位点-转录终止信号等。本试验构建的PmcsT是由PasnA(启动子-核糖体结合位点区域)、mcs(多克隆位点区)和TasnA(终止区)3个片段组成的。其中PasnA是巴氏杆菌天冬酰氨合成酶A基因的强启动子,它具有原核生物典型的结构特征,能被巴氏杆菌的RNA聚合酶所识别,其功能在后续的研究中已得到证实。pUC18的多克隆位点mcs具有多个限制酶的单一切点,便于外源基因的插入。TasnA是巴氏杆菌天冬酰氨合成酶A基因的强终止子,具有很好的回文结构和位于发卡结构后面的一段A/T富含区。这一特点说明该终止子可以使RNA聚合酶有效转录克隆的外源基因,同时有效的终止子使得所产生的mRNA较为稳定。endprint
PmcsT只是一个中间型载体,它不表现任何功能蛋白质,是构建表达载体或穿梭载体的工具或平台。在以后的工作中,可以根据需要,在PmcsT中加载目的基因并添加巴氏杆菌复制子或巴氏杆菌-大肠杆菌双复制子,构建巴氏杆菌表达载体或巴氏杆菌-大肠杆菌穿梭载体。所以构建三联体PmcsT是一项基础性工作,为今后构建高效表达外源基因的巴氏杆菌活菌载体疫苗奠定了良好的基础。
参考文献:
[1] PRICE S B, FREEMAN M D, MACEWEN M W. Molecular analysis of a cryptic plasmid isolated from avian strains of Pasteurella multocida[J]. Veterinary Microbiology,1993,37(1-2):31-43.
[2] HIRSH D C, HANSEN L M, DORFMAN L C, et al. Resistance to antimicrobial agents and prevalence of R plasmids in Pasteurella multocida from turkeys[J]. Antimicrob Agents Chemother, 1989, 33(5):670-673.
[3] SCHWARZ S, SPIES U, SCHAFER F, et al. Isolation and interspecies-transfer of a plasmid from Pasteurella multocida encoding for streptomycin resistance [J]. Med Microbiol Immunol, 1989, 178(2):121-125.
[4] COTE S, HAREL J, HIGGINS R, et al. Resistance to antimicrobial agents and prevalence of R plasmids in Pasteurella multocida from swine[J]. American Journal of Veterinary Research, 1991, 52(10):1653-1657.
[5] HUSH D C, MARTIN L D, RHOADES K R. Resistance plasmids of Pasteurella multocida isolated from turkeys[J]. American Journal of Veterinary Research, 1985, 46(7):1490-1493.
[6] GUNTHER R, MANNING P J, BOUMA J E et al. Partial characterization of plasmids from rabbit isolates of Pasteurella multocida[J]. Laboratory.Animal Science,1991,41(5):423-426.
[7] BOYCE J D, WILKIE I, HARPER M, et al. Genomic scale analysis of Pasteurella multocida gene expression during growth within the natural chicken host[J]. Infection and Immunity, 2002, 70(12):6871-6879.
[8] 卢圣栋.现代分子生物学实验技术[M].第二版.中国协和医科大学出版社,2001.368-387.
[9] MAY B J, ZHANG Q, LI L L, et al. Complete genomic sequence of Pasteurella multocida, Pm70[J]. Proc Natl Acad Sci USA, 2001, 98(6):3460-3465.
[10] FORSBERG G. An evaluation of different enzymatic cleavage methods for recombinant fusion proteins, applied on des (1-3) insulin-like growth factor I[J]. Protein chem,1992,11(2): 201-211.endprint
