胚胎附植期GRB7基因在绵羊子宫内膜中的mRNA表达
2015-10-27巩斌熊燊源李良远代蓉万鹏程石国庆
巩斌熊燊源李良远代蓉万鹏程石国庆
(1.石河子大学动物科技学院,石河子 832000;2.新疆农垦科学院畜牧兽医研究所,石河子 832000)
胚胎附植期GRB7基因在绵羊子宫内膜中的mRNA表达
巩斌1,2熊燊源1,2李良远1代蓉2万鹏程2石国庆2
(1.石河子大学动物科技学院,石河子 832000;2.新疆农垦科学院畜牧兽医研究所,石河子 832000)
旨在探讨生长因子受体结合蛋白7(growth factor receptor bound 7,GRB7)在绵羊胚胎附植期子宫内膜中mRNA的表达模式。应用半定量RT-PCR和实时荧光定量RT-PCR分别检测21 d怀孕母羊全身组织和妊娠第9、13、17、21及25天的怀孕与未孕母羊子宫内膜组织GRB7基因的表达。半定量RT-PCR结果显示,GRB7基因在心脏、皱胃、大肠、小肠、瘤胃、下丘脑、大脑、小脑等组织均未检测出表达,在脾脏、垂体、肾脏、输卵管、卵巢、膀胱及子宫体等组织出现表达,其中在子宫体、输卵管及肾脏中呈现较高表达;实时荧光定量PCR结果显示,从绵羊妊娠第9-25天阶段,GRB7基因在母羊子宫内膜组织的表达量呈逐渐上升趋势,孕羊GRB7的表达量均显著高于同一时间点同期发情的未孕母羊。结果表明GRB7的mRNA表达具有组织特异性,在胚胎附植期绵羊子宫内膜中的mRNA表达显著升高,表明GRB7可能在早期胚胎附植中发挥一定作用。
GRB7;绵羊;胚胎附植;子宫内膜
哺乳动物的胚胎附植是妊娠建立的标识,是胚胎与母体复杂的多基因双向调控的结果。研究表明,生长因子受体结合蛋白7(Growth factor receptor bound 7,GRB7)对细胞迁移和肿瘤转移具有调控作用[1],而早期胚胎附植与肿瘤侵袭过程具有极大的相似性。汤军等[2]在早孕小鼠的研究表明,经荧光定量PCR检测未妊娠(d0)和妊娠早期(d1-7)小鼠子宫内膜组织均有GRB7 mRNA表达,且在孕5 d达到峰值,免疫组化和蛋白印迹显示GRB7蛋白在子宫内膜的表达规律与荧光定量PCR基本一致,提示它可能与子宫内膜细胞分化、蜕膜化和维持妊娠等方面有关。GRB7蛋白由535个氨基酸残基构成,结构上具有3个保守区域:氨基端的富含脯氨酸区、中间的GM区和羧基端的SH2结构域[3]。酪氨酸激酶信号通路是细胞生长、分裂和运动的调节器。作为一种重要的接合蛋白,GRB7通过与不同酪氨酸激酶受体及其他磷酸化的酪氨酸蛋白相互作用[4],调控许多细胞的功能。据报道,GRB7的功能主要依靠羧基端的SH2结构域。通过SH2结构域,GRB7蛋白与许多信号通路相关联,如胰岛素[5]、ErbB2、ErbB3和ErbB4[6]、FAK[7]和FGFR[8]。
鉴于GRB7基因在小鼠胚胎着床过程中发挥的重要调控作用,而该基因在绵羊胚胎附植期表达调控模式的研究尚属空白,本研究选择其作为绵羊胚胎附植分子调控的候选基因。期望通过组织表达谱检测、半定量RT-PCR和实时荧光定量RT-PCR,探究其在不同组织和不同胚胎附植阶段子宫内膜的表达变化情况,为初步探讨GRB7在绵羊胚胎附植过程中的作用提供理论依据。
1 材料与方法
1.1 材料
试验动物均来自新疆兵团紫泥泉种羊场。试验母羊选择健康、经产、体况优良且一致的中国美利奴细毛羊,随机分为A、B、C、D、E 5组(每组8头)。经过同期发情处理后,每组留下3只母羊不配种做空白对照,其余发情母羊采用人工授精配种(间隔12 h左右重复授精2-3次)。母羊处理和配种期间,严格按照羊场常规标准进行饲喂和管理,同时在自由采食及饮水条件下,进行疾病的预防和行为、体况的观察。分别于人工授精后第9、13、17、21及25天采集妊娠母羊及同期发情处理后未配种母羊的子宫内膜组织,速置于液氮保存备用。选取妊娠21 d母羊3只屠宰,采集心脏、脾脏、垂体、肾脏、皱胃、大肠、小肠、瘤胃、下丘脑、大脑、小脑、输卵管、卵巢、膀胱及子宫体等15种组织,速置液氮中保存备用。
1.2 方法
1.2.1 总RNA提取及反转录cDNA第一链的合成按照Trizol(Invitrogen)试剂说明书分别提取所需组织的总RNA。利用紫外分光光度计测定OD260/OD280值和RNA浓度,用1%琼脂糖凝胶电泳检测总RNA的完整性。所提总RNA OD260/OD280值在1.85-2.0之间,无蛋白及基因组DNA污染,符合试验要求。cDNA第一链合成按照M-MLV反转录试剂盒(Invitrogen)进行。
1.2.2 引物设计及合成 根据GenBank中绵羊GRB7基因mRNA序列(XM_004013378.1),应用Primer Premier 5.0设计引物,引物跨内含子并处在基因的高保守区域。引物序列见表1和表2,由生工生物工程(上海)股份有限公司上海合成部合成。
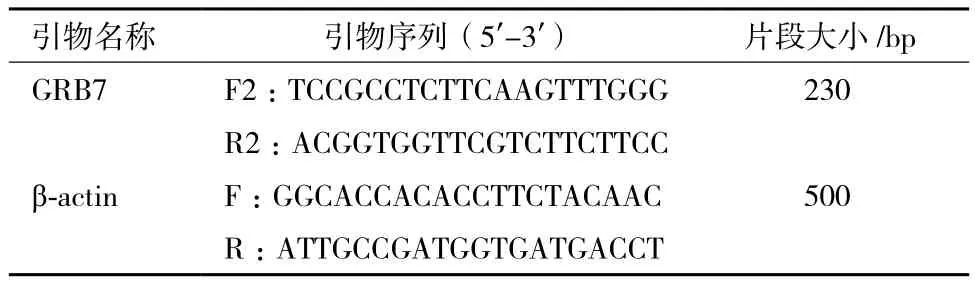
表1 组织表达谱的引物序列和片段长度

表2 实时荧光定量RT-PCR的引物序列和片段长度
1.2.3 GRB7基因克隆 以反转录合成的第一链cDNA为模板进行PCR扩增。反应总体积为25 μL,反应体系为:10×PCR buffer 2.5 μL,dNTPs 2 μL,引物GRB7-F2/R2各0.5 μL,Taq酶0.5 μL,ddH2O 18 μL,cDNA模板1 μL。PCR反应条件为:95℃ 3 min;95℃ 30 s,62℃ 30 s,72℃ 30 s,共35个循环;72℃ 5 min。PCR产物经2%琼脂糖凝胶电泳检测,DNA测序由英潍捷基(上海)贸易有限公司完成,所获序列经鉴定正确。
1.2.4 组织表达谱分析 按前述方法分别提取怀孕第21天母羊心脏、脾脏、垂体、肾脏、皱胃、大肠、小肠、瘤胃、下丘脑、大脑、小脑、输卵管、卵巢、膀胱及子宫体等组织总RNA,并合成cDNA第一链。根据所设计的引物GRB7-F2/R2进行PCR扩增。以绵羊β-actin基因为内参基因,根据持家基因指数扩增期PCR产物灰度值调整各组织初始模板浓度,并与目的基因指数扩增期PCR产物灰度值进行比较,半定量分析GRB7基因在所选组织中的相对表达水平。
1.2.5 实时荧光定量PCR检测 将采集到的各期子宫内膜组织,分别提取总RNA,合成cDNA第一链,进行实时荧光定量PCR检测。根据所设计的引物GRB7-F1/R1进行PCR扩增,以绵羊GAPDH基因为内参。反应体系20 μL,包括cDNA模板1 μL,LightCycler®480 SYBR Green I Master(Roche)Master Mix 10 μL,上下游引物各1 μL,Water,PCR-grade 7 μL。PCR扩增程序为:95℃预变性5 min;95℃变性10 s,61℃复性10 s,72℃延伸10 s,共45个循环。扩增完成后,进行熔解曲线的分析,以判断扩增过程特异性。每个检测样品设置3个重复,定量分析结果由LightCyeler480分析软件自动分析。
1.2.6 统计分析 实时荧光定量PCR获得目的基因和持家基因的CT值,采用2-△△CT法[8]计算GRB7基因的相对表达量。利用 SPSS(19.0)软件进行单因素方差分析,结果以柱状图显示各时期的表达水平变化。
2 结果
2.1 绵羊GRB7基因的克隆
利用GenBank中绵羊GRB7基因mRNA序列(XM_004013378.1),以绵羊子宫内膜组织cDNA第一链为模板,经扩增和测序,获得一条长度为 181 bp的目的片段(图1)。经PCR产物送测序公司测序,是所设计的目的片段。

图1 绵羊GRB7基因的PCR扩增电泳图
2.2 绵羊GRB7基因的组织表达谱分析
以绵羊β-actin为内参基因,采用半定量RTPCR方法检测了GRB7基因在绵羊怀孕第21天不同组织的表达水平情况。结果(图2和图3)表明,GRB7基因在脾脏、垂体、肾脏、输卵管、卵巢、膀胱及子宫体等组织出现表达,其中在子宫体、输卵管及肾脏中表达量较高,但在心脏、皱胃、大肠、小肠、瘤胃、下丘脑、大脑、小脑等组织未检测出。
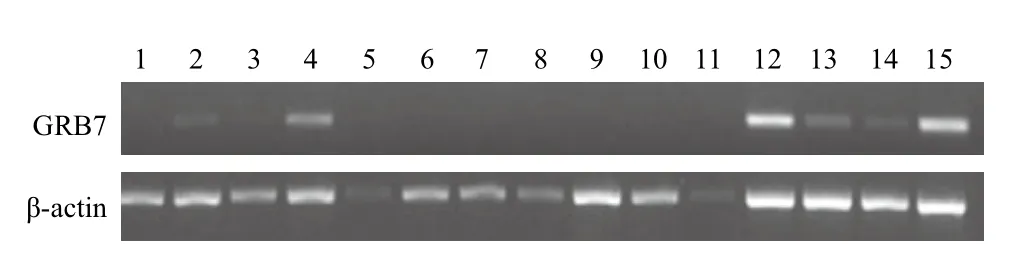
图2 GRB7基因在绵羊不同组织的表达检测
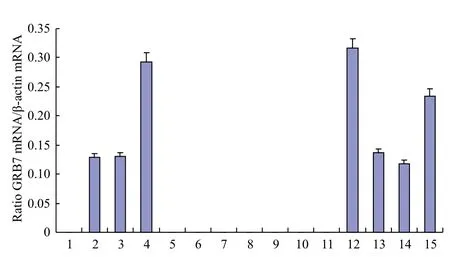
图3 绵羊GRB7基因在不同组织表达水平的比较
2.3 绵羊GRB7基因在不同附植期怀孕与未孕母羊子宫内膜的表达分析
为了研究GRB7基因在胚胎附植期绵羊子宫内膜中mRNA表达情况,利用实时定量荧光PCR方法,以GAPDH为持家基因对不同时间点子宫内膜GRB7基因的表达水平进行跟踪检测。
实时定量荧光PCR检测(图4)发现,GRB7 mRNA在怀孕组和空怀组绵羊子宫内膜中均有表达,且组间表达差异极显著(P<0.01)。怀孕组中,与d17相比较,d21的mRNA表达水平差异不显著(P=0.112),d9、d13、d25的mRNA表达水平均显著高于d17(P<0.01)。空怀组中,与d9相比较,d21的mRNA表达水平差异不显著(P=0.322),d13、d17、d25的mRNA表达水平均显著高于d9(P<0.01)。

图4 GRB7基因在怀孕组与未孕组母羊子宫内膜不同时间点的表达
3 讨论
哺乳动物胚胎附植成功的关键是胚胎和子宫内膜在时空上相互识别、容受并发生黏附联系的共同结果,在此过程中涉及相互之间的复杂分子调控过程。在胚胎附植期,子宫内膜会产生极短的允许胚胎植入的容受时期即着床窗,着床窗的出现是胚胎定位、黏着和附植的必要条件[9]。胚胎附植过程中,滋养层外胚层与子宫内膜发生黏附反应,子宫内膜腺上皮基质细胞增殖分化成蜕膜细胞,从而支持胚胎发育[2]。GRB7参与许多肿瘤细胞的移行和发生,经免疫组化分析GRB7的过表达与晚期卵巢癌有关联趋势[10],GRB7的迁移可以通过RNA干扰机制降低乳腺癌细胞活性实现[11],胚泡的植入与肿瘤细胞的侵袭、迁移等方面非常相似。
本研究结果显示,对第21天怀孕母羊全身组织进行组织表达谱分析,GRB7在脾脏、垂体、肾脏、输卵管、卵巢、膀胱及子宫体等组织均出现表达,其中在子宫体、输卵管及肾脏中表达量较高,但在心脏、皱胃、大肠、小肠、瘤胃、下丘脑、大脑、小脑等组织未检测出,表明GRB7的表达具有一定的组织特异性,这与其在人体内的表达情况不同。人体中,GRB7在胰腺中高表达,肾、胎盘、前列腺及小肠的表达适中,结肠、肝脏、肺及睾丸中表达较低[3]。汤军等[2]在早孕小鼠的研究表明,经荧光定量PCR检测未妊娠(d0)和妊娠早期(d1-7)小鼠子宫内膜组织均有GRB7 mRNA表达。GRB7在子宫体和输卵管的高表达暗示其可能与胚胎附植位点子宫内膜存在某种联系。
进一步对早期妊娠不同时间点母羊子宫内膜荧光定量RT-PCR检测发现,各时间点妊娠母羊子宫内膜GRB7的表达量均极显著高于同期未孕母羊,且从第9天至25天持续升高,在25 d达到最大检测值。绵羊胚胎附植过程大体分为4个阶段:囊胚孵化、胚胎伸长、附植预接触和胚胎定位与黏附[12]。从透明带孵化出来的囊胚立即与母体子宫产生密切联系,在胚胎伸长的过程中滋养层细胞形成指状突起,绵羊指状突起形成的时间为妊娠13 d,之后随胎盘发育而消失。绵羊妊娠14 d胚胎滋养层绒毛与子宫内膜上皮细胞预接触,并在16-18 d发生黏附,绒毛不断伸长并出现血管,30 d时与子宫阜的组织形成“母包子型”胎盘[13]。有研究表明,GRB7、ERK和FOXM1的异常上调和激活与人类肿瘤细胞的侵袭有密切联系[10],GRB7上调还涉及受体酪氨酸激酶信号通路、促进细胞生存和细胞迁移[11]。荧光定量RT-PCR检测发现妊娠母羊子宫内膜GRB7的表达量从第9天至25天持续升高,与GRB7上调机理表现出一致性,同时与汤军等[2]在早孕小鼠妊娠早期的研究结果基本一致。在25 d表达量达到最大检测值提示GRB7基因可能影响胎盘的发生。已知HER2信号通路及其下游效应器有助于细胞增殖和迁移,有报道说GRB7与HER2协同作用[14],GRB7的二聚作用可能是GRB7与RTKs或erbB2结合过程中的重要调节步骤[15]。本研究显示GRB7在子宫内膜规律性表达可能与胚胎附植相关,所调控的细胞生长、增殖和移行,提示GRB7在子宫内膜细胞分化、蜕膜化和维持妊娠方面起一定作用。但由于哺乳动物胚胎附植是一个涉及母体与胎儿复杂的双向调控过程,后续试验需要进行怀孕25 d之后的子宫内膜和孕体方面研究。
4 结论
GRB7在绵羊脾脏、垂体、肾脏、输卵管、卵巢、膀胱及子宫体等组织出现表达,其中在子宫体、输卵管及肾脏中表达量较高,而在胚胎附植期绵羊子宫内膜中的mRNA表达呈动态时空变化,提示GRB7可能在绵羊早期胚胎附植中发挥着重要的作用。
[1]Pias SC, Peterson TA, Johnson DL, et al. The intertwining of structure and function:proposed helix swapping of the SH2 domain of Grb7, a regulatory protein implicated in cancer progression and inflammation[J]. Crit Rev Immunol, 2010, 30(3):299-304.
[2]汤军, 李荣, 耿艳清, 等. GRB7基因在早孕小鼠子宫内膜中的表达[J]. 重庆医科大学学报, 2013, 38(10):1149-1153.
[3]张丹, 高友鹤. 生长因子受体结合蛋白7(Grb7)研究进展[J].基础医学与临床, 2011, 31(4):467-470.
[4]García-Palmero I, Villalobo A. Calmodulin regulates the translocation of Grb7 into the nucleus[J]. FEBS Letters, 2012, 586:1533-1539
[5]Kasus-Jacobi A, Bereziat V, Perdereau D, et al. Evidence for an interaction between the insulin receptor and Grb7. A role for two of its binding domains, PIR and SH2[J]. Oncogene, 2000, 19:2052-2059.
[6]Fiddes RJ, Campbell DH, Janes PW, et al. Analysis of Grb7 recruitment by heregulin-activated erbB receptors reveals a novel target selectivity for erbB3[J]. J Biol Chem, 1998, 273:7717-7724.
[7]Han DC, Guan JL. Association of focal adhesion kinase with Grb7 and its role in cell migration[J]. J Biol Chem, 1999, 274:24425-24430.
[8]Cailliau K, Le Marcis V, Bereziat V, et al. Inhibition of FGF receptor signalling in Xenopus oocytes:differential effect of Grb7, Grb10 and Grb14[J]. FEBS Lett, 2003, 548:43-48.
[9]Mohamed OA, Jonnaert M, Labelle-Dumais C, et al. Uterine Wnt/ beta-catenin signaling is required for implantation[J]. Proc Natl Acad Sci USA, 2005, 102(24):8579-8584.
[10]Chan DW, Hui WWY, Cai PCH, et al. Targeting GRB7/ERK/ FOXM1 signaling pathway Impairs aggressiveness of Ovarian cancer cells[J]. PLoS One, 2012, 7(12):1-10.
[11]Nencioni A, Cea M, Garuti A, et al. Grb7 upregulation is a molecular adaptation to HER2 signaling inhibition due to removal of Akt-mediated gene repression[J]. PLoS One, 2010, 5(2):1-10.
[12] Spencer TE, Johnson GA, Fuller W, et al. Implantation mechanisms:insights from the sheep[J]. Reproduction, 2004, 128:657-668.
[13]熊燊源, 万鹏程, 石文艳, 等. 绵羊胚胎附植分子调控研究进展[J]. 生命科学, 2012, 24(10):1105-1113.
[14]Pradip D, Bouzyk M, Dey N, et al. Dissecting GRB7-mediated signals for proliferation and migration in HER2 over expressing breast tumor cells:GTP-ase rules[J]. Am J Cancer Res, 2013,3(2):173-195.
[15]Peterson TA, BenallieRL, Bradford AM, et al. Dimerization in the Grb7 Protein[J]. J Mol Recognit, 2012, 25(8):427-434.
(责任编辑 马鑫)
The mRNA Expression of GRB7 in Ovine’s Endometrium During Embryo Implantation
Gong Bin1,2Xiong Shenyuan1,2Li Liangyuan1Dai Rong2Wan Pengcheng2Shi Guoqing2
(1. College of Animal Science and Technology,Shihezi University,Shihezi 832000;2. Animal Husbandry and Veterinary Institute,Xinjiang Academy of Agricultural and Reclamation Science,Shihezi 832000)
The goal of this study is to characterize the mRNA expression patterns of growth factor receptor bound 7(GRB7)gene in ovine’s endometrium. The expression profiling of tissues from whole body of a 21 d pregnant ewe was analyzed by semi-quantitative RT-PCR,and the expressions of endometrium samples from non-pregnant and pregnant ewes of 9, 13, 17, 21 and 25 d respectively were examined by realtime fluorescent quantitative RT-PCR. The results of semi-quantitative RT-PCR showed that no expression of GRB7 was detected in the tissues of heart, abomasums, large intestine, small intestine, rumen, hypothalamus, brain and cerebellum:however, the expression was observed in the tissues of spleen, hypophysis, kidney, oviduct, ovary, bladder and uterine, and the level was higher in uterine, oviduct and kidney. The RT-PCR analysis demonstrated that the mRNA expression level of GRB7 in endometrium of a pregnant ewe was higher than that in the concurrent nonpregnant one, and the tendency of expression was gradually rising with the time during period of 9-25 d pregnancy. In conclusion, GRB7 was expressed tissue-specifically, and the significant expression of GRB7 in endometrium of pregnant ewes implies that GRB7 may play a certain role in the earlier stage of embryo implantation.
GRB7;ovine;implantation;endometrium
10.13560/j.cnki.biotech.bull.1985.2015.07.022
2014-10-15
国家科技支撑计划(2011BAD28B05-1-1),国家“863”计划(2011AA100307),国家自然科学基金项目(31160460),新疆兵团绵羊繁育生物技术重点实验室开放课题(2013KLS02)
巩斌,男,硕士研究生,研究方向:动物遗传育种与繁殖;E-mail:1156199957@qq.com
石国庆,男,研究员,博士生导师,研究方向:绵羊繁育与家畜胚胎生物技术研究;E-mail:nkkxyxms@163.com万鹏程,男,副研究员,硕士生导师,研究方向:绵羊繁育与家畜胚胎生物技术研究;E-mail:pengcheng.wan@gmail.com
