T W S119对结肠癌LO V O细胞系增殖能力和耐药性的影响
2015-10-26冯家豪杨伟金
冯家豪 杨伟金 孙 政
广州市第一人民医院胃肠外科,广东广州510180
T W S119对结肠癌LO V O细胞系增殖能力和耐药性的影响
冯家豪杨伟金孙政
广州市第一人民医院胃肠外科,广东广州510180
目的探讨TWS119对结肠癌LOVO细胞系的耐药性和增殖能力的影响。方法将LOVO细胞系分成3组,分别为2 μmol/L TWS119处理组、1 μmol/L TWS119处理组和阴性对照组,TWS119处理组加入2、1 μmol/L的TWS119,对照组加入等体积DMSO,培养24 h后分别进行Western blot和qRT-PCR检测β-链蛋白(β-catenin)多药耐药相关蛋白1(MRP1)及P糖蛋白(P-gp)的表达,用流式细胞分析检测细胞周期,用CCK8检测细胞耐药性变化。结果与阴性对照组比较,2 μmol/L TWS119处理组和1 μmol/L TWS119处理组细胞中MRP1、P-gp的mRNA和β-catenin、MRP1、P-gp的蛋白表达,G2/M期细胞比例均明显升高(P<0.05)。虽然1 μmol/L TWS119处理组在5、10 μmol/L5-氟尿嘧啶(5-Fu)作用下存活率无明显变化(P>0.05),但2 μmol/L TWS119处理组存活率明显升高(P<0.05);而且在15 μmol/L 5-FU作用下处理组存活率明显升高(P<0.05)。结论在体外实验中,TWS119可以通过上调Wnt/β-catenin信号通路活性增强结肠癌细胞的耐药性和增殖能力,揭示癌细胞耐药性、Wnt/βcatenin通路和ABC转运体如P-gp、MRP1等存在联系。
结直肠癌;化疗耐药;TWS119;Wnt/β-catenin信号通路
在各种癌症中,全球结直肠癌患病率居第3位,仅次于肺癌和乳腺癌[1]。东亚结直肠癌发病率正在上升,可能与生活方式西方化、高脂低纤维饮食、肥胖和吸烟的流行有关[2]。大部分新发案例可以接受根治性手术[3],但对于Ⅲ期结直肠癌患者,术后仍需化疗[4];而且20%~30%新发病例有远处转移,这些患者即使进行根治性手术,仍有近50%的患者发生局部复发和转移[5],对于这部分患者,系统化疗显得更为重要[4,6]。但单纯化疗并非根治手段,由于随着治疗的进展,癌症耐药性会逐步增强,这与患者药代动力学、药物和肿瘤类型、耐药机制、肿瘤微环境有关,机制非常复杂[7]。Wnt(wingless integration)信号通路被证实与人类癌症有关[8],分为Wnt/β-catenin(cadherin-associated protein,β-链蛋白,β-1)通路、Wnt/Ca2+通路和WNT/PCP(planar cell polarity)通路[9]。有研究显示,相关基因突变导致的Wnt/β-catenin信号通路调控失调出现在大部分结直肠癌病例中[10]。Wnt/β-catenin可以调节c-myc和cyclin D1基因,它们在细胞生长、增殖和分化中起重要作用,在结肠癌中这些基因常常被异常激活[11]。TWS119是一种人工合成的小分子化合物,它可以促进老鼠胚胎腺癌细胞和胚胎癌细胞向神经细胞方向分化,而且发现其作用机制为抑制糖原合成酶激酶3β(glycogen synthase kinase 3 beta,GSK-3β)的磷酸化作用,可使胞内β-catenin浓度升高进而上调Wnt/β-catenin信号通路活性[12]。但TWS119对人类结肠癌细胞的作用仍未有报道。本实验研究TWS119对LOVO细胞系的耐药性和增殖性影响,探讨其对人类结肠癌细胞的影响作用,进一步揭示Wnt/β-catenin信号通路与人类结肠癌细胞耐药性的联系。
1 材料与方法
1.1细胞培养和药物处理
LOVO细胞系(中山大学实验动物中心提供)分为2 μmol/L TWS119处理组、1 μmol/L TWS119处理组和阴性对照组。在含10%胎牛血清、100 μg/mL链霉素和100 U/mL青霉素的RPMI1640培养基(Gibco),5%CO2、37℃无菌培养箱中培养,TWS119(Selleck)溶于DMSO中-20℃避光保存,处理组分别加入2、1 μmol/L TWS119[13],阴性对照组加入等体积DMSO,培养24 h后进行后续实验。
1.2qRT-PCR
收集细胞,用trizol试剂(invitrogen)提取细胞总RNA,用两步法qRT-PCR SYBER试剂盒(TAKARA)检测各组细胞MRP1、P-gp mRNA表达,各引物设3个复孔,引物序列(由Invitrogen公司合成)见表1。
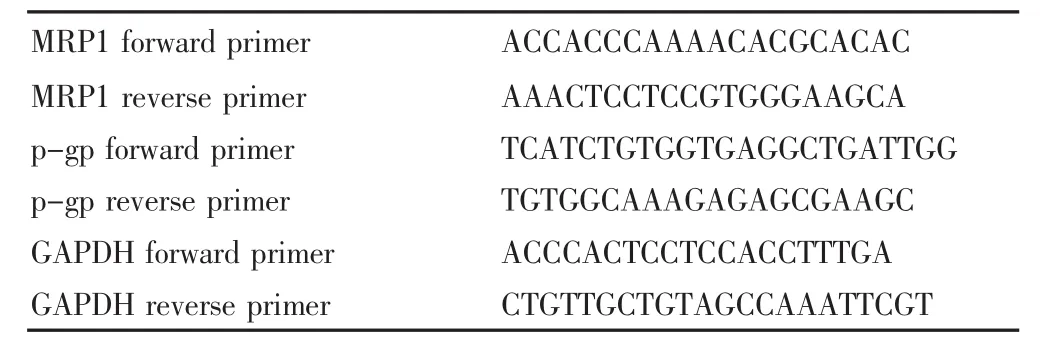
表1 各引物序列
1.3Western blot
收集细胞,用细胞裂解液提取总蛋白,经聚丙烯酰胺凝胶电泳分离后转膜,5%脱脂奶粉封闭1 h后一抗孵育过夜,二抗孵育1 h,曝光后扫描,使用Image J软件分析灰度值。一抗、二抗均购自北京博奥森生物技术有限公司。
1.4CCK8
调整细胞密度至5×104/mL,接种于96孔板,5-氟尿嘧啶(5-FU)设5、10、15 μmol/L 3个浓度梯度,阴性对照加等体积培养基,各设5个复孔,无菌培养箱中培养24 h,每孔加入10 μL CCK8试剂(碧云天)作用4 h后酶标仪分析吸光度,每组重复3次。
1.5流式细胞分析
收集细胞,预冷PBS洗涤离心后用75%酒精固定过夜,碘化丙啶试剂(碧云天)染色30 min,流式细胞仪分析细胞周期。
1.6统计学方法
采用统计软件SPSS 15.0对数据进行分析,正态分布计量资料以均数±标准差(x±s)表示,多组间比较采用方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1三组qRT-PCR结果
与阴性对照组比较,2 μmol/L TWS119处理组和1 μmol/L TWS119处理组细胞中P糖蛋白(P-gp)和多药耐药相关蛋白(MRP1)mRNA表达量显著增加(P<0.05),且2 μmol/L TWS119处理组较1 μmol/L TWS119处理组P-gp和MRP1 mRNA表达量显著增加(P<0.05)。见表2、图1。

表2 三组qRT-PCR结果
2.2三组Western blot结果
与阴性对照组比较,2 μmol/L TWS119处理组和1 μmol/L TWS119处理组细胞中β-链蛋白(βcatenin)、P-gp和MRP1蛋白表达量显著增加(P<0.05),且2 μmol/L TWS119处理组较1 μmol/L TWS119处理组β-cateniu、P-gp和MRP1蛋白表达量显著增加(P<0.05)。见图2、3。
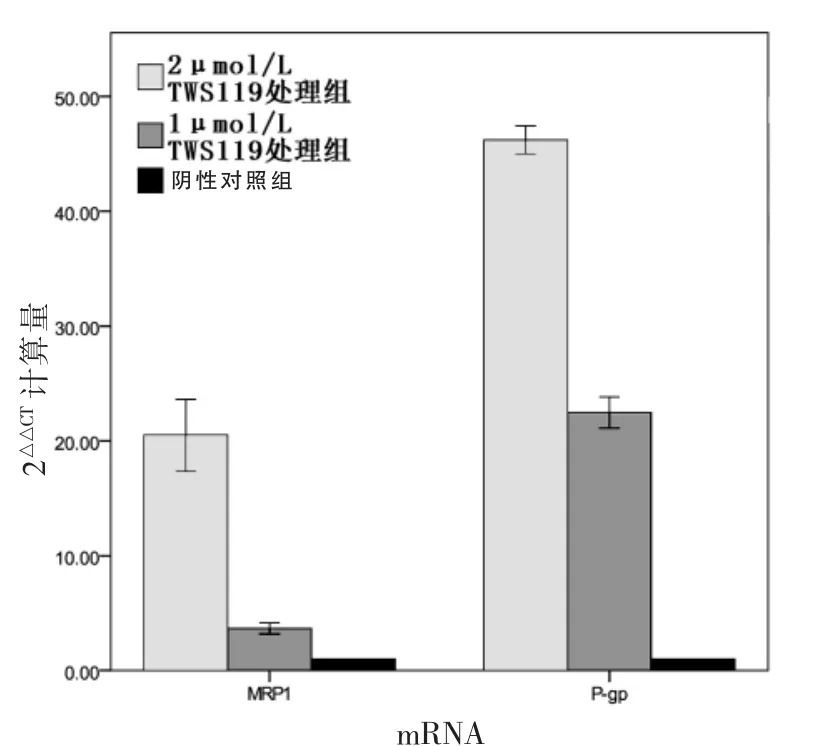
图1 三组qRT-PCR结果
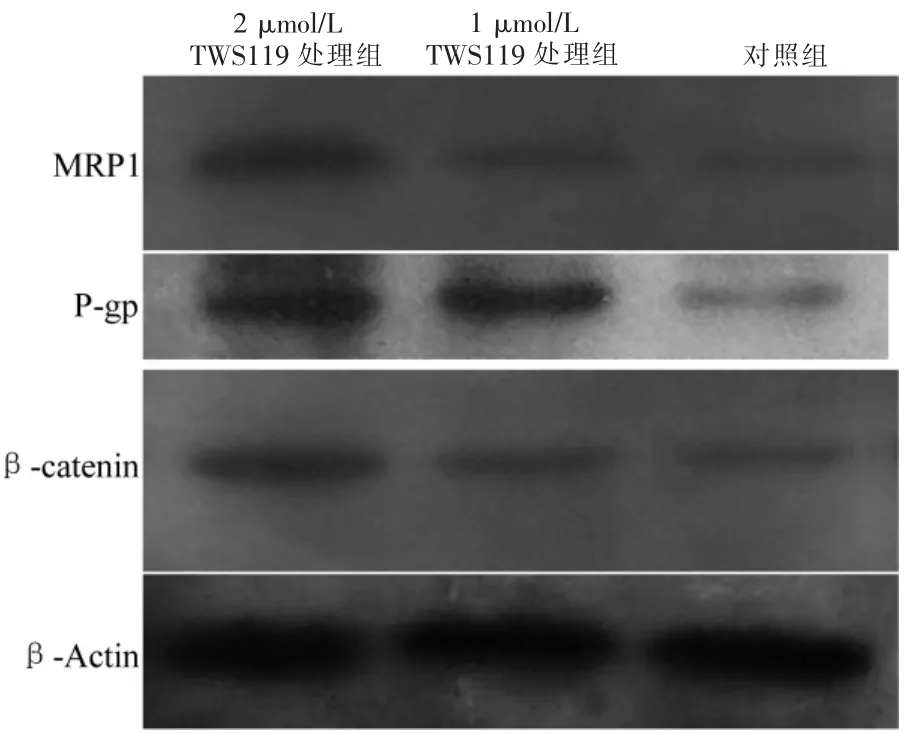
图2 三组蛋白条带图(β-Actin为内参)

图3 三组蛋白条带灰度值比较
2.3三组细胞在不同浓度5-FU作用下CCK8试验结果
在5 μmol/L 5-FU作用下,2 μmol/L TWS119处理组LOVO细胞存活率高于1 μmol/L TWS119处理组和阴性对照组,差异有统计学意义(P<0.05);但1 μmol/L TWS119处理组与阴性对照组比较,差异无统计学意义(P>0.05)。在10 μmol/L 5-FU作用下,2 μmol/L TWS119处理组LOVO细胞存活率高于1 μmol/L TWS119处理组和阴性对照组,差异有统计学意义(P<0.05);但1 μmol/L TWS119处理组与阴性对照组比较,差异无统计学意义(P>0.05)。在15 μmol/L 5-FU作用下,2 μmol/L TWS119处理组LOVO细胞存活率高于1 μmol/L TWS119处理组和对照组,差异有统计学意义(P<0.05);1 μmol/L TWS119处理组存活率明显高于对照组,差异有统计学意义(P<0.05)。见表3、图4。
表3 三组细胞在不同浓度5-FU作用下CCK8试验存活率(%,±s)

表3 三组细胞在不同浓度5-FU作用下CCK8试验存活率(%,±s)
注:与阴性对照组比较,▲P<0.05;与1 μmol/L TWS119处理组比较,*P<0.05;5-FU:5-氟尿嘧啶
组别5 μmol/L 5-FU 10μmol/L5-FU 15μmol/L5-FU 2 μmol/L TWS119处理组1 μmol/L TWS119处理组阴性对照组P值93.12±0.76▲*87.20±1.77 80.21±0.79<0.05 87.40±1.77▲*72.24±5.35 68.43±2.26<0.05 80.21±0.79▲*68.43±2.26▲59.94±9.08<0.05
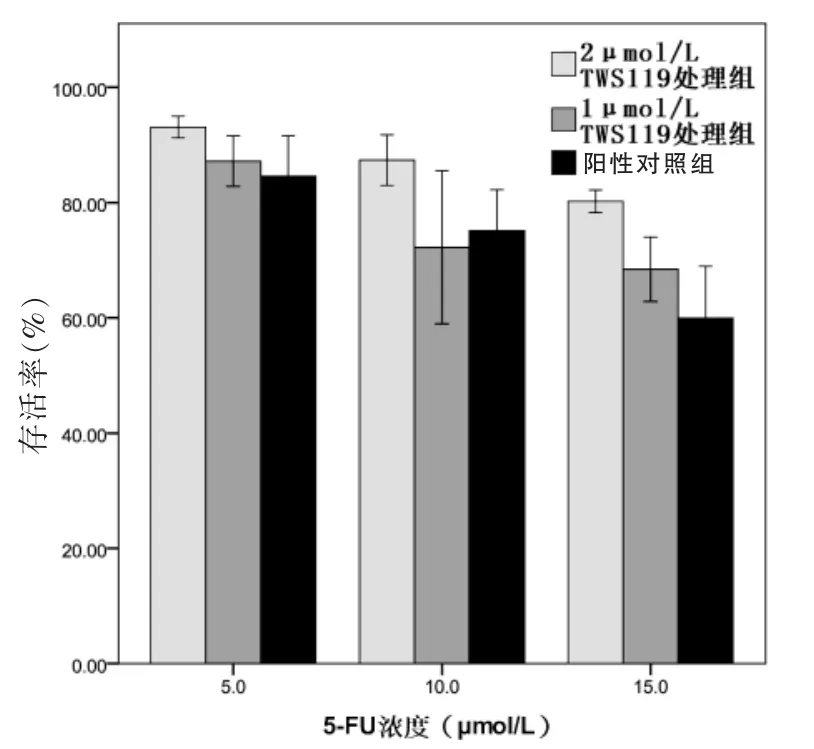
图4 三组细胞在不同浓度5-FU作用下CCK8试验存活率
2.4TWS119对增殖细胞比例的影响
阴性对照组G2/M期细胞比例为(6.42±2.62)%、2 μmol/L TWS119处理组G2/M期细胞比例为(17.8± 1.60)%、1 μmol/L TWS119处理组G2/M期细胞比例为(11.63±1.59)%。与阴性对照组比较,2、1 μmol/L TWS119处理组中G2/M期细胞比例显著升高,差异有统计学意义(P<0.05);且2 μmol/L TWS119处理组G2/M期细胞比例明显高于1 μmol/L TWS119处理组,差异有统计学意义(P<0.05)。
3 讨论
通常情况下在细胞内由轴抑制蛋白(axis inhibition protein,Axin)、结肠腺瘤样息肉蛋白(adenomatous polyposis coli,APC)、酪蛋白激酶1(casein kinase 1)和GSK-3β组成的复合体对β-catenin有磷酸化作用,磷酸化的β-catenin随后被泛素-蛋白酶体降解,但Wnt与胞膜上的卷曲蛋白受体(frizzled class receptor)和低密度脂蛋白受体相关蛋白5/6(low density lipoprotein receptor-related protein 5/6,LRP5/6)结合后,通过蓬乱蛋白(dishevelled segment polarity protein,DVL)使上述蛋白复合体受到抑制,β-catenin在胞内得以集聚,浓度升高。β-catenin通过核孔进入细胞核,可以与T细胞因子/淋巴增强结合因子家族(T-cell factor/lymphoid enhancer-binding factor,TCF/ LEF)、环腺苷酸效应元件结合蛋白结合蛋白[cAMP response element-binding protein(CREB)-binding protein,CBP]等结合,促进多种转录反应[14-16]。
P-gp和MRP1同属ATP结合位点转运体(ATP binding cassette transporter,ABC transporter)家族成员。P-gp由ABCB1基因编码,在胞膜上有跨膜区-ATP结合位点,可以水解ATP释放能量引起构象改变,进而使底物排出细胞[17]。P-gp被证实与肿瘤耐药性有关,使癌细胞抵抗蒽环类、长春碱类和紫杉醇等化疗药的毒性[18]。MRP1是从P-gp表达缺失的耐药细胞株中发现的,由ABCC1基因编码,与P-gp类似的是,MRP1也有跨膜区-ATP结合位点这种功能性结构[19]。在乳腺癌、前列腺癌、肺癌等疾病中,MRP1过表达是化疗效果不佳的预示性指标[20]。
本研究结果表明TWS119可使人结肠癌LOVO细胞系β-catenin、P-gp和MRP1表达上调,明显提高细胞的增殖活性和5-FU耐药性,且存在剂量依赖性。该机制可能是TWS119选择性抑制GSK-3β磷酸化活性,导致β-catenin在胞内浓度上升而使β-catenin/ TCF转录活性增强,其下游基因c-myc和cyclin-D1表达增加均可增强LOVO细胞增殖活性,而Wnt/βcatenin信号通路可能与ABCB1和ABCC1两个基因表达有关,致使P-gp和MRP1表达增加,对5-Fu的外排作用增强,导致细胞耐药性增加。
1 μmol/L TWS119处理组虽然有P-gp和MRP1的表达上调,但5、10 μmol/L 5-FU作用下耐药性较阴性对照组无明显增加,可能是由于胞内P-gp和MRP1表达需提高至一定水平才能显著影响LOVO细胞5-FU耐药性;在15 μmol/L 5FU作用下1 μmol/L TWS119处理组也有显著耐药性,可能是因为当底物5-FU浓度较高时,P-gp和MRP1的外排泵效率也相应提高。
本研究揭示癌细胞耐药可能与Wnt/β-catenin信号通路有关,希望可以为癌细胞耐药机制的研究提供思路。此外,TWS119在人类结肠癌细胞系中能影响信号通路的活性,可以用于信号通路的相关研究。
[1]Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,5(136):e359-e386.
[2]Center MM,Jemal A,Ward E.International trends in colorectal cancer incidence rates[J].Cancer Epidemiol Biomarkers Prev,2009,18(6):1688-1694.
[3]Lombardi L,Morelli F,Cinieri S,et al.Adjuvant colon cancer chemotherapy:where we are and where we'll go[J]. Cancer Treat Rev,2010,36(suppl 3):s34-s41.
[4]Engstrom PF,Arnoletti JP,Benson AB,et al.NCCN clinical practice guidelines in oncology:colon cancer[J].J Natl Compr Canc Netw,2009,7(8):778-831.
[5]Gill S,Blackstock AW,Goldberg RM.Colorectal cancer[J]. Mayo Clin Proc,2007,82(1):114-129.
[6]Scheithauer W,Rosen H,Kornek GV,et al.Randomised comparison of combination chemotherapy plus supportive care with supportive care alone in patients with metastatic colorectal cancer[J].BMJ,1993,306(6880):752-755.
[7]Foo J,Michor F.Evolution of acquired resistance to anticancer therapy[J].J Theor Biol,2014,355:10-20.
[8]Polakis P.Wnt signaling in cancer[J].Cold Spring Harb Perspect Biol,2012,4(5):a008052.
[9]Van Camp JK,Beckers S,Zegers D,et al.Wnt signaling and the control of human stem cell fate[J].Stem Cell Rev,2014,10(2):207-229.
[10]Clevers H.Wnt/beta-catenin signaling in development and disease[J].Cell,2006,127(3):469-480.
[11]Uematsu K,Kanazawa S,You L,et al.Wnt pathway activation inmesothelioma:evidence of Dishevelled overexpression and transcriptional activity of beta-catenin[J]. Cancer Research,2003,63(15):4547-4551.
[12]Ding S,Schultz PG.A role for chemistry in stem cell biology[J].Nat Biotechnol,2004,22(7):833-840.
[13]Ding S,Wu TY,Brinker A,et al.Synthetic small molecules that controlstemcellfate[J].ProcNatlAcadSciUSA,2003,100(13):7632-7637.[14]Archbold HC,Yang YX,Chen L,et al.How do they do Wnt they do:regulation of transcription by the Wnt/beta-catenin pathway[J].Acta Physiologica(Oxford),2012,204(1):74-109.
[15]Teo JL,Kahn M.The Wnt signaling pathway in cellular proliferation anddifferentiation:ataleoftwocoactivators[J]. Advanced Drug Delivery Reviews,2010,62(12):1149-1155.
[16]Sustmann C,Flach H,Ebert H,et al.Cell-type-specific function of BCL9 involves a transcriptional activation domain that synergizes with beta-catenin[J].Molecular and Cellular Biology,2008,28(10):3526-3537.
[17]Sauna ZE,Smith MM,Müller M,et al.The mechanism of action of multidrug-resistance-linked p-glycoprotein[J]. J Bioenerg Biomembr,2001,33(6):481-491.
[18]Avendano C,Menendez JC.Inhibitors of multidrug resisitance to antitumor agents(ADR)[J].Curr Med Chem,2002,9(2):159-193.
[19]Borst P,Evers R,Kool M,et al.A family of drug transporters:the multidrug resistance-associated proteins[J]. J Natl Cancer Inst,2000,92(16):1295-1302.
[20]Deeley RG,Westlake C,Cole SP.Transmembrane transport of endo-and xenobiotics by mammalian ATP-binding cassette multidrug resistance proteins[J].Physiol Rev,2006,86(3):849-899.
Impact of TWS119 on proliferation capacity and chemotherapy resistance of colon cell line LOVO
FENG JiahaoYANG WeijinSUN Zheng
Department of Gastrointestinal Surgery,Guangzhou First People's Hospital,Guangdong Province,Guangzhou510180,China
Objective To discuss the impact of TWS119 on chemotherapy drug resistance and proliferation capacity of colon cancer cell line LOVO.Methods The cell line LOVO was divided into three group,2 μmol/L TWS119 treatment group,1 μmol/L TWS119 treatment group and negative control group,the TWS119 treatment groups were added 2,1 μmol/L TWS119,the negative control group was added equal volume of DMSO,Western blot and qRT-PCR were performed to test the expression of P-gp,β-catenin and MRP1 after 24 h treatment.Flow cytometry and CCK8 test were performed to analyze the cells tolerance change.Results Compared with the negative control group,the mRNA expression of MRP1,P-gp,the protein expression of P-gp,β-catenin and MRP1,the G2/M period cell rate in 2 μmol/L TWS119 treatment group and 1 μmol/L TWS119 treatment group significantly increased(P<0.05);the survival rate with 5,10 μmol/L 5-FU treatment had no significantly changed in 1 μmol/L TWS119 treatment group(P>0.05),while those in 2 μmol/L treatment group significantly increased(P<0.05),and the survival rate of both treatment group significantly increased with 15 μmol/L 5-FU treatment(P<0.05).Conclusion TWS119 can improve the chemotherapy drug resistance and proliferation capacity of colon cancer cell through increasing Wnt/β-catenin signaling pathway in vitro,these phenomena perhaps reveals there are some relationships among drug resistance of cancer cell,Wnt/β-catenin signaling pathway and the ABC transporter such as MRP1 and P-gp.
Colorectal cancer;Chemotherapy resistance;TWS119;Wnt/β-catenin
R73-36
A
1673-7210(2015)09(a)-0027-05
2015-04-08本文编辑:苏畅)
冯家豪(1988.9-),男,广州医科大学2012级外科学专业在读硕士研究生;研究方向:大肠癌多药耐药的分子生物学机制及治疗。
孙政(1971.3-),男,博士,主任医师,广州市第一人民医院胃肠外科副主任,曾获得2007年广州市科技进步一等奖、2008年广东省科技进步二等奖;研究方向:胃肠道肿瘤的治疗。
