重组大肠杆菌发酵生产谷胱甘肽的氨基酸添加策略优化
2015-10-25王德正吴辉李志敏叶勤
王德正 吴辉 李志敏 叶勤
(华东理工大学生物 反应器工程国家重点实验室,上海 200237)
重组大肠杆菌发酵生产谷胱甘肽的氨基酸添加策略优化
王德正 吴辉 李志敏 叶勤
(华东理工大学生物反应器工程国家重点实验室,上海200237)
对表达双功能谷胱甘肽合成酶的重组大肠杆菌发酵生产谷胱甘肽(Glutathione,GSH)进行氨基酸添加策略优化,结果表明:基本培养基中未添加氨基酸时GSH产量为0.81 g/L;诱导2 h后添加17 mmol/L半胱氨酸GSH产量为1.16 g/L,比不加氨基酸提高43 %;添加17 mmol/L的3种前体氨基酸,GSH产量达到3.86 g/L,比只添加半胱氨酸提高2.33倍;进一步提高3种氨基酸添加量至25 mmol/L,GSH产量可达4.64 g/L,比不添加氨基酸提高4.73倍,总生产强度高达317.8 mg/(L·h),半胱氨酸转化为谷胱甘肽达到0.60 mol/mol;考察氨基酸添加模式发现一次性添加25 mmol/L氨基酸较恒速流加模式生产速率提高了29.8%。后续在50 L罐放大生产GSH,产量为4.31 g/L,总生产强度达到310.1 mg/(L·h),为工业化放大生产GSH奠定了基础。
谷胱甘肽;氨基酸;半胱氨酸;重组大肠杆菌
谷胱甘肽(Glutathione,GSH)是已知的非蛋白巯基类生物基化合物,广泛存在于动物、植物、微生物中[1]。GSH在生物体内具有多种作用,参与体内多种代谢,特别是对维持体内氧化还原平衡起着重要作用[2]。基于其较强的电子供体能力,GSH能保护DNA、蛋白质等生物分子免受自由基等的氧化损伤。目前已广泛用于食品卫生、运动健康、美容养颜、癌症治疗等领域[3,4]。
目前谷胱甘肽的生产方法主要有细胞提取法[5]、化学合成法[6]、酶法及发酵法,其中研究最广泛的为酶法和发酵法。酶法合成GSH底物利用率高、杂质含量少、利于后续纯化分离,但此法生产GSH的瓶颈为ATP的供给。外源添加ATP可以维持酶转化反应,但成本过于昂贵。通过结合ATP再生系统[7]可以较好地解决ATP的供给问题,但该方法需经菌体培养、细胞处理、转化反应三步,操作过程繁多且工业化生产成本依旧较高。发酵法生产GSH即为菌体通过代谢廉价原料产生ATP供自身GSH合成所需,此法操作过程简单,成本低廉,是目前工业生产GSH的常用方法。
GSH的合成分为两步。第一步为谷氨酸、半胱氨酸在γ-谷氨酰胺半胱氨酸合成酶的催化下合成γ-谷氨酰胺半胱氨酸;第二步为γ-谷氨酰胺半胱氨酸与甘氨酸在谷胱甘肽合成酶的催化下合成GSH。在这两步反应中,γ-谷氨酰胺半胱氨酸合成酶受GSH的反馈抑制从而在一定程度上限制了GSH的高产。自2005年来,逐渐有报道[8,9]发现一种酶——双功能GSH合成酶,该酶可以催化GSH两步合成反应并且某些来源的酶对产物抑制不敏感。本实验室将来自嗜热链球菌的表达双功能GSH合成酶的gshF基因导入大肠杆菌中表达,酶法合成GSH达到较高水平[7]。进一步实验证明该酶几乎不受GSH的反馈抑制,表现出较好的GSH合成潜力。
GSH是由谷氨酸、甘氨酸和半胱氨酸在酶的催化下经肽键缩合而成,其合成与3种组成氨基酸密切相关。Alfafara等[10]通过研究发现在酿酒酵母生产GSH过程中,添加半胱氨酸GSH产量得到了提高,而添加谷氨酸与甘氨酸并没有提高GSH产量。Wen等[11]研究发现在Saccharomyces cerevisiae T65中谷氨酸、甘氨酸、半胱氨酸均能提高GSH的产量。在氨基酸添加的基础上Li等[12]通过结合ATP添加使胞内GSH浓度提高了1.4倍、Wang等[13]通过结合反馈调控策略使GSH产量提高了25%。Alfafara等[14]研究发现一次性添加半胱氨酸比连续流加半胱氨酸效果好。Liang[15]通过两阶段添加氨基酸使Candida utilis WSH 02-08 GSH产量提高了69.5%。目前关于氨基酸添加对大肠杆菌生产GSH的影响报道较少,本研究重点研究并优化了氨基酸添加策略,以期获得高GSH产量及生产强度。
1 材料与方法
1.1 材料
1.1.1 菌株 重组大肠杆菌BL21(pET28a-gshF),本实验室构建,表达双功能谷胱甘肽合成酶的目的片段gshF来自嗜热链球菌。
1.1.2 培养基
1.1.2.1 种子培养基 含有30 mg/L的硫酸卡那霉素的Luria-Bertani培养基。
1.1.2.2 发酵培养基 Na2HPO4·12H2O 15 g/L,葡萄糖 8 g/L,KH2PO43 g/L,NH4Cl 3 g/L,NaCl 0.5 g/L,MgSO40.2 g/L,CaCl20.011 g/L,维生素B1溶液(1%,W/V)0.2 mol/L,微量元素混合液0.2 mol/L。补料培养基为500 g/L 葡萄糖。微量元素混合液(Na2MoO4·2H2O 2 g/L,FeSO4·7H2O 80 g/L,MnSO4·H2O 10 g/L,ZnSO4·7H2O 2 g/L,CoCl24 g/L,CuCl2·2H2O 1 g/L,AlCl3·6H2O 10 g/L,H3BO40.5 g/L)及维生素B1溶液采用0.22 μm微孔滤膜过滤除菌,CaCl2与葡萄糖分别在115℃蒸汽灭菌30 min,其它物质则在121℃灭菌30 min。
1.2 方法
1.2.1 菌种活化 将-20℃保存的甘油管接种于含有30 mL种子培养基的三角瓶中,加入硫酸卡那霉素至终浓度30 mg/L,37℃、220 r/min培养6 h。
1.2.2 种子培养 将活化后的菌液按1%的接种量加入分别装有150 mL或300 mL种子培养基的500 mL或1 L的三角瓶中,37℃、220 r/min培养9 h。
1.2.3 补料分批发酵 以6 %的接种量接入装有3 L培养基的5 L发酵罐中或装有30 L培养基的50 L发酵罐中。发酵过程中使用氨水控制pH为7,调节通气量在1 L/(L·min)。当初糖耗尽,溶氧跃升后开始补料。葡萄糖流加采用指数流加(比生长速率控制在0.3 h-1)。在菌体生长至OD600=30时添加终浓度为1 mmol/L的IPTG进行诱导。
(A)研究优化氨基酸添加量:诱导2 h后菌体浓度达到OD600=40左右,此时分别添加不同浓度氨基酸(0 mmol/L,17 mmol/L 半胱氨酸,17 mmol/L三种前体氨基酸,25 mmol/L三种前体氨基酸),发酵3 h后结束。
(B)研究氨基酸添加模式:诱导2 h后添加氨基酸,2 h后结束发酵。氨基酸添加模式分为:一次性添加25 mmol/L三种氨基酸;0 h和0.5 h时分别添加12.5 mmol/L三种氨基酸;恒速流加25 mmol/L三种氨基酸。
(C)50 L罐放大生产GSH:诱导2 h后一次性添加25 mmol/L三种氨基酸,1.5 h后结束发酵。
1.2.4 分析方法
1.2.4.1 菌体密度测定 待测发酵液稀释一定浓度后,用紫外分光光度计在600 nm检测吸光值。
1.2.4.2 GSH的测定 用HPLC法检测GSH含量。使用C18色谱柱(4.6 mm×150 mm),检测器为紫外检测器,检测波长为210 nm。流动相A为甲醇,流动相B为含0.05 mol/L KH2PO4及0.01 mol/L 庚烷磺酸钠的水溶液(用磷酸调pH至3.0),A∶B为5∶95。流速为1 mL/min,检测温度为30℃。
1.2.4.3 乙酸、葡萄糖检测 用HPLC法检测。色谱柱为Aminex HPX-87H,检测器为示差折光检测器。流动相为5 mmol/L H2SO4,流速0.6 mL/min,检测温度65℃。
1.2.4.4 双功能GSH合成酶活力测定 取1 mL发酵液离心弃掉上清,所得菌体用0.15 mmol/L Tris-HCl(pH为8.5,含0.2 mmol/L EDTA,0.1 mol/L KCl)重悬并稀释6倍,冰浴进行超声破碎。超声破碎的功率设定为200 W,周期9 s(工作3 s停6 s),共99个循环。破碎好的细胞12 000 r/min、4℃离心10 min取上清获得粗酶液,然后用0.15 mmol/L Tris-HCl稀释2倍。取500 μL稀释好的粗酶液加入500 μL反应液(含MgCl240 mmol/L,ATP 20 mmol/L,Glu 40 mmol/L,Gly 40 mmol/L,Cys 20 mmol/L, 溶液用0.15 mmol/L Tris-HCl配制)。混合均匀后30℃反应30 min。然后加入等体积的20%的三氯乙酸终止反应。离心取上清,HPLC检测GSH含量。
酶活定义:每分钟转化底物生成1 mg GSH所需要的酶量为1个酶活单位。
2 结果
2.1 氨基酸添加量对GSH合成的影响
2.1.1 不添加氨基酸时GSH的生成 从图1-A可以看出,在OD600为30时加入IPTG诱导双功能GSH合成酶表达,5 h后细胞浓度达到56.4。在加入IPTG诱导之前,大肠杆菌合成的GSH非常低,几乎检测不到。加入IPTG后,菌体内GSH开始积累,诱导1 h后浓度达到0.02 g/L,诱导后第2 h浓度达到0.26 g/L,最终在诱导5 h后GSH浓度达到0.81 g/L,GSH合成速率为0.16 g/(L·h)。
2.1.2 添加17 mmol/L半胱氨酸对GSH生成的影响 加入氨基酸后,菌体浓度由39.7降至37.0(图1-B)。主要有两方面原因:加入的氨基酸溶液有一定程度稀释作用;氨基酸加入后pH急速下降至6,部分菌体死亡并自溶。在氨基酸加入1 h后,细胞慢慢恢复正常状态开始继续生长,在发酵结束时细胞浓度达到42.2。
之前研究数据表明加入IPTG诱导2 h后外源蛋白表达量达到最高,因此在诱导2 h后加入半胱氨酸。在加入半胱氨酸之前GSH仅为0.18 g/L,加入半胱氨酸1 h后GSH合成量达到0.86 g/L。之后GSH一直积累但合成速度降低,发酵结束时GSH产量达到1.16 g/L,比未添加氨基酸高出43%。向培养基中添加半胱氨酸,可以满足GSH合成中对半胱氨酸需求从而提高GSH产量,但本次发酵半胱氨酸转化生成GSH的转化率仅为0.22 mol/mol。分析原因可能是,加入半胱氨酸后双功能GSH合成酶活力不足;GSH合成受谷氨酸及甘氨酸的限制。酶活力测试发现添加半胱氨酸后1 h酶活力达到最高为(1262±38)U/L,之后略有下降但依旧维持在最高酶活的70%以上。由此知半胱氨酸不能完全转化的原因很可能是谷氨酸及甘氨酸不足。因此,在之后的实验中同时添加三种氨基酸来提高GSH的产量。
2.1.3 添加17 mmol/L三种氨基酸对GSH生成的影响 如图1-C,GSH在氨基酸加入后迅速合成,0.5 h内积累量达到3.74 g/L,合成速率高达7.48 g/L/h。在加入氨基酸1.5 h后GSH合成量达到最高3.86 g/L,此时氨基酸转化为谷胱甘肽的转化率为0.73 mol/mol,发酵结束时GSH浓度下降为3.45 g/L。1.5 h GSH降低的原因分析是:加入的三种氨基酸耗尽,不再生产GSH;GSH的氧化分解作用。分析数据发现,只添加17 mmol/L半胱氨酸GSH产量是不添加氨基酸的1.43倍,而同时添加17 mmol/L谷氨酸、甘氨酸、半胱氨酸GSH产量是不添加氨基酸的4.86倍。由此说明添加三种前体氨基酸比只添加半胱氨酸更能促进GSH生产。
2.1.4 添加25 mmol/L三种氨基酸对GSH生成的影响 为进一步提高GSH的产量,本实验在菌体浓度达到40时一次性加入25 mmol/L谷氨酸、甘氨酸、半胱氨酸,结果如图1-D。
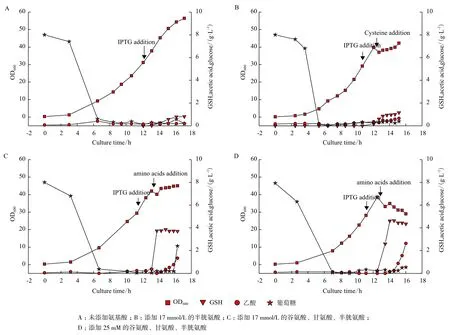
图1 氨基酸添加量对GSH生产的影响
在加入氨基酸1.5 h后GSH达到最高为4.64 g/L,1.5 h后GSH浓度下降,至发酵结束时GSH浓度为4.35 g/L。GSH最高产量比2.1.3提高了19%,而此时转化率仅为0.60 mol/mol,相比2.1.3下降了18%。综合考虑产量及转化率,分析认为最佳氨基酸添加量为25 mmol/L。
相对于添加17 mmol/L半胱氨酸的批次发酵及添加17 mmol/L三种氨基酸的批次发酵,一次性加入25 mmol/L氨基酸后菌体浓度一直下降,不再增加。分析原因可能是高浓度的GSH抑制了菌体生长。从GSH生产曲线可以看出在加入氨基酸1.5 h后GSH浓度已达到最高,因此GSH生产结束时间确定在加入氨基酸1.5 h后。
2.2 氨基酸添加模式对GSH合成的影响
图2中比较了氨基酸添加模式对菌体生长的影响。一次性添加25 mmol/L 氨基酸细胞浓度下降最多,由39.6降至31.2。二次添加次之,连续流加细胞浓度下降最低(由38.5降为36.8)。由此结果知,采用氨基酸流加方式,细胞浓度受氨基酸添加影响较小。
图3中比较了氨基酸添加模式对GSH合成的影响。一次性加入氨基酸后GSH迅速合成,在1 h时达到4.62 g/L,1.5 h 时GSH浓度为4.64 g/L,2 h时GSH浓度略降为4.34 g/L。分两次添加氨基酸后,GSH在1 h时达到最高4.54 g/L,之后略微下降。在恒速流加实验中,0-1 h GSH几乎以恒定速率缓慢生成,1 h时GSH浓度为3.18 g/L,2 h时 GSH浓度达到最高为4.76 g/L。GSH最高浓度略高于一次性添加氨基酸,可能原因是采用氨基酸流加降低了半胱氨酸对细胞生长的抑制作用,同时也降低了半胱氨酸的氧化分解。
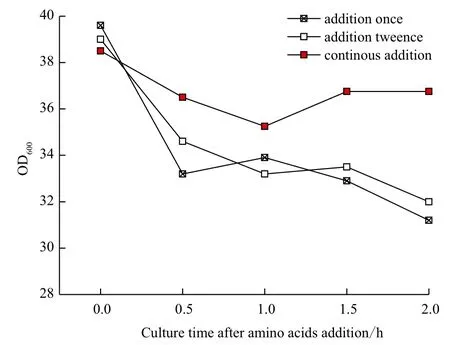
图2 不同氨基酸添加模式对细胞生长的影响
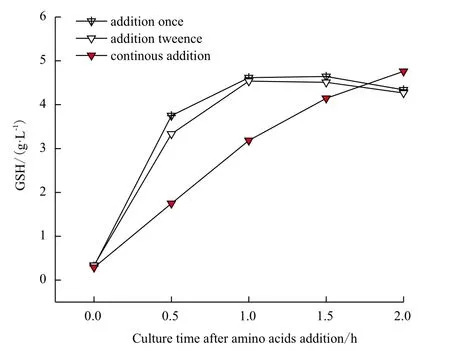
图3 氨基酸添加模式对GSH合成的影响
比较第一种氨基酸添加方式及第3种氨基酸添加方式:一次性添加实验中GSH在1.5 h 时达到最高4.64 g/L,此时氨基酸转化为GSH的转化率为0.60 mol/mol,GSH生产速率为3.09 g/L/h;恒速流加实验中,GSH浓度缓慢增加,2 h时达到最高4.76 g/L,此时氨基酸转化为GSH的转化率为0.62 mol/mol,GSH生产速率为2.38 g/L/h。恒速流加方式在GSH生成量及转化率上没有明显优于一次性添加方式,且如果进行工业化生产恒速流加在操作及设备要求上都比一次性添加方式高,因此认为氨基酸一次性加入方式较优。
2.3 50 L发酵罐放大生产GSH
为对发酵工艺进行验证,进行了50 L罐发酵放大实验,结果如图4。加入氨基酸后0.5 h,GSH浓度由0.21 g/L升至3.23 g/L,OD600由42.6 降至34.0。之后GSH缓慢增加,1.5 h后达到4.31 g/L,此时加入的氨基酸转换为GSH的转化率为0.56 mol/mol,GSH生产速率为2.87 g/(L·h),GSH总生产强度为310.1 mg/(L·h)。发酵结束时葡萄糖及乙酸含量都处于较低水平,分别为0.35 g/L及0.87 g/L。
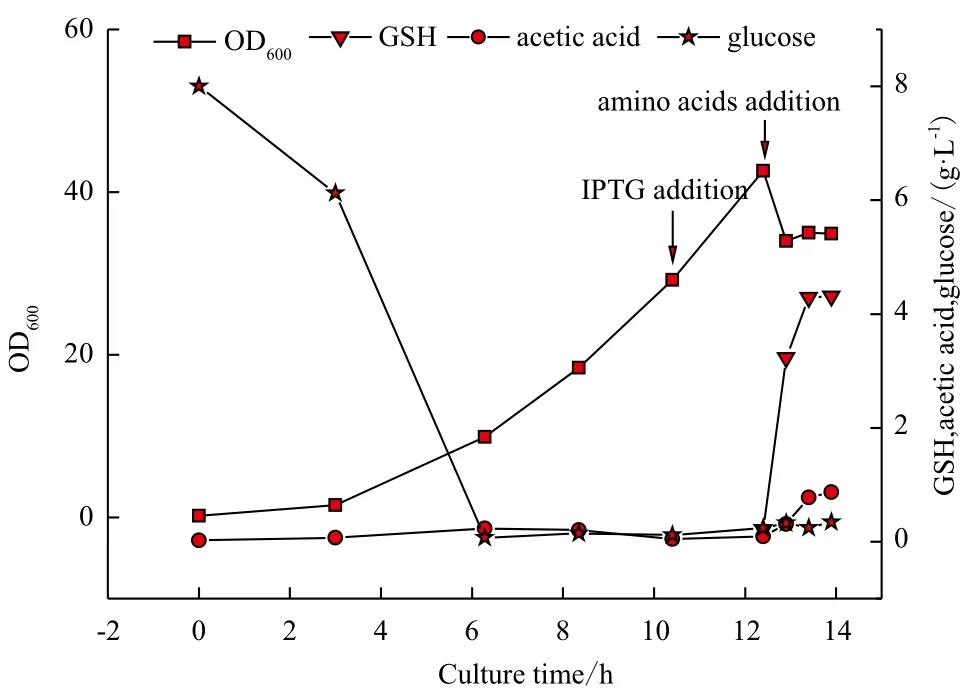
图4 50 L罐发酵生产GSH过程曲线
3 讨论
由于谷胱甘肽独特的生理特性,其在医药、美容、食品、运动等行业应用广泛,需求量日益增加。谷胱甘肽工业化生产主要采用发酵法,目前限制我国大规模工业化生产GSH的原因主要有生产菌株产量低、发酵工艺条件不成熟、生产成本高等。本研究构建的重组大肠杆菌进行发酵工艺条件优化,在尽量降低成本的基础上实现了GSH高产。
谷氨酸、甘氨酸、半胱氨酸作为GSH合成前体,细胞自身可以合成,但当GSH大量积累时,自身合成的氨基酸无法满足GSH的合成需求。本实验在5 L罐中分别研究了诱导条件下不添加任何氨基酸、只添加17 mmol/L半胱氨酸、添加17 mmol/L三种前体氨基酸、添加25 mmol/L三种前体氨基酸GSH的生成情况。在未补加任何前体氨基酸时经过17 h的发酵GSH产量可达0.81 g/L。在同样长的发酵时间内,不添加氨基酸,使用酿酒酵母[11]、假丝酵母[15]、表达γ-谷氨酰胺半胱氨酸合成酶和谷胱甘肽合成酶的重组大肠杆菌[12]GSH产量均低于0.75 g/L。只添加17 mmol/L半胱氨酸,GSH产量为1.16 g/L,比未添加氨基酸高出43.2%。添加17 mmol/L三种前体氨基酸,GSH合成量达到最高3.86 g/L,转化率为0.73 mol/mol。继续增加至25 mmol/L氨基酸添加量GSH产量至4.64 g/L,半胱氨酸对GSH的转化率为0.60 mol/mol,总生产强度为317.8 mg/L/h,处于较高水平。
进一步对氨基酸添加模式进行研究,研究发现一次性加入、分两次加入、恒速流加均使菌体浓度有一定程度的下降。实验结果表明恒速流加方式在GSH生成量及转化率方面没有明显优于一次性添加方式,且操作及设备要求均比一次性添加方式高,因此认为氨基酸一次性加入方式较优。
通过优化,最终确定发酵工艺为菌体生长至OD600nm为30时添加1 mmol/L IPTG诱导,诱导2 h后一次性加入25 mmol/L三种前体氨基酸,1.5 h后结束发酵。与相关文献对比(表1),可以看出本发酵工艺在GSH产量、半胱氨酸转化率均处于较高水平,尤其是GSH总生产强度为目前报道最高水平。在该工艺条件下进行50 L罐放大,成功获得4.31 g/L GSH,半胱氨酸对GSH的转化率为0.56 mol/mol,GSH总生产强度为310.1 mg/L/h。与5 L水平发酵相近,说明此工艺有很好的应用前景。
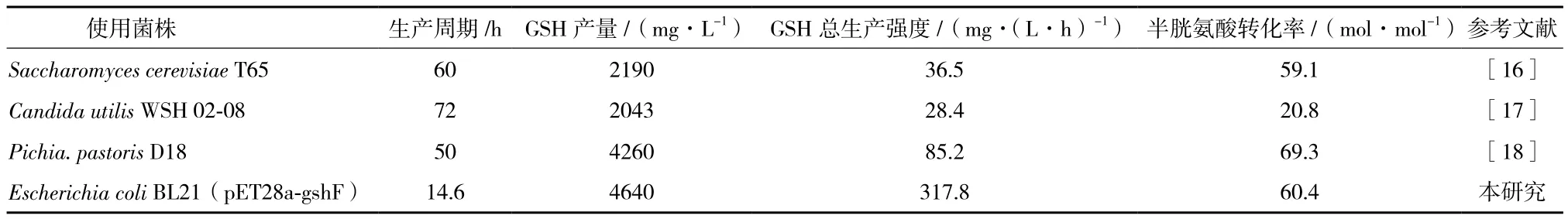
表1 利用不同菌株发酵生产GSH文献比较
4 结论
本实验使用表达双功能谷胱甘肽合成酶的重组大肠杆菌进行发酵工艺优化。诱导条件下对氨基酸添加量进行优化,添加25 mmol/L三种前体氨基酸时,产量可达4.64 g/L,转化率为0.60 mol/mol,总生产强度达到317.8 mg/(L·h)。对氨基酸添加模式进行优化,实验证明一次性添加25 mmol/L氨基酸为最佳模式。将此工艺进行50 L罐放大,成功获得4.31 g/L GSH,总生产强度达到310.1 mg/(L·h)。
[1]Meister A, Anderson M. Glutathione[J]. Annual Review of Biochemistry, 1983, 52(1):711-760.
[2]Pastore A, Federici G, Bertini E, et al. Analysis of glutathione:implication in redox and detoxification[J]. Clinica Chimica Acta,2003, 333(1):19-39.
[3]Sies H. Glutathione and its role in cellular functions[J]. Free Radical Biology and Medicine, 1999, 27(9):916-921.
[4]Liao X, Shen W, Chen J, et al. Improved glutathione production by gene expression in Escherichia coli[J]. Letters in Applied Microbiology, 2006, 43(2):211-214.
[5]沈蓓英, 江志炜. 具有生物活性新型功能性食品添加剂谷胱甘肽[J]. 粮食与油脂, 1993, 6(2):27-32.
[6]袁尔东, 郑建仙. 功能性食品基料—谷胱甘肽的研究进展[J].食品与发酵工业, 1999, 25(5):52-57.
[7]Li W, Li Z, Yang J, et al. Production of glutathione using a bifunctional enzyme encoded by gshF from Streptococcus thermophilus expressed in Escherichia coli[J]. Journal of Biotechnology, 2011,154(4):261-268.
[8]Janowiak B, Griffith O. Glutathione synthesis in Streptococcus agalactiae:one protein accounts for γ-glutamylcysteine synthetase and glutathione synthetase activities[J]. Journal of Biological Chemistry, 2005, 280(12):11829-11839.
[9]Gopal S, Borovok I, Ofer A, et al. A multidomain fusion protein in Listeria monocytogenes catalyzes the two primary activities for glutathione biosynthesis[J]. Journal of Bacteriology, 2005, 187(11):3839-3847.
[10]Alfafara C, Kanda A, Shioi T, et al. Effect of amino acids on glutathione production by Saccharomyces cerevisiae[J]. Applied Microbiology and Biotechnology, 1992, 36(4):538-540.
[11]Wen S, Zhang T, Tan T. Utilization of amino acids to enhance glutathione production in Saccharomyces cerevisiae[J]. Enzyme and Microbial Technology, 2004, 35(6):501-507.
[12]Li Y, Chen J, Mao Y, et al. Effect of additives and fed-batch culture strategies on the production of glutathione by recombinant Escherichia coli[J]. Process Biochemistry, 1998, 33(7):709-714.
[13]Wang Z, Tan T, Song J. Effect of amino acids addition and feedback control strategies on the high-cell-density cultivation of Saccharomyces cerevisiae for glutathione production[J]. Process Biochemistry, 2007, 42(1):108-111.
[14]Alfafara C, Miura K, Shimizu H, et al. Cysteine addition strategy for maximum glutathione production in fed-batch cu lture of Saccharomyces cerevisiae[J]. App lied M icrobiology and Biotechnology, 1992, 37(2):141-146.
[15]Liang G, Liao X, Du G, et al. Optimization of amino acids addition for efficient production of glutathione in Candida utilis[J]. Biochemical Engineering Journal, 2008, 41(3):234-240.
[16]Wen S, Zhang T, Tan T. Maximizing production of glutathione by amino acid modulation and high-cell-density fed-batch culture of Saccharomyces cerevisiae[J]. Process Biochemistry, 2006, 41(12):2424-2428.
[17]Liang G, Liao X, Du G, et al. Elevated glutathione production by adding precursor amino acids coupled with ATP in high cell density cultivation of Candida utilis[J]. Journal of Applied Microbiology,2008, 105(5):1432-1440.
[18]Fei L, Wang Y, Chen S. Improved glutathione production by gene expression in Pichia pastoris[J]. Bioprocess and Biosystems Engineering, 2009, 32(6):729-735.
(责任编辑 李楠)
Optim izing the Addition of Am ino Acids in the Production of G lutathione by Recombinant Escherichia coli
Wang Dezheng Wu Hui Li Zhimin Ye Qin
(State Key Laboratory of Bioreactor Engineering,East China University of Science and Technology,Shanghai200237)
The condition of amino acids was optimized in the production of glutathione(GSH)by recombinant Escherichia coli expressing bifunctional glutathione synthetase. Only 0.81 g/L of GSH was produced without adding any amino acid, whereas 1.16 g/L of GSH was formed when 17 mmol/L of cysteine was fed into the medium after 2 h induction, increasing 43% compared to no amino acid added. With the feeding 17mmol/L of 3 precusor amino acids, the production was improved significantly and achieved at 3.86 g/L, which was 2.33 times of single cysteine addition. By increasing the amount of 3 amino acids to 25mmol/L, GSH was 4.64 g/L, 4.73 times as no amino acid added, and the overall productivity was 317.8 mg/(L·h), the conversion rate of cysteine to glutathione was 0.60 mol/mol. While concerning the addition mode, the production rate of GSH was 3.09 g/(L·h) when 25mmol/L of amino acids was once added to the fermenter, only 2.38 g/(L·h)when 25mmol/L of amino acids added at constant speed and continuously, so the productivity increased 29.8% by adding once. The process was successfully scaled up in the 50 L fermenter and 4.31 g/L of GSH was produced with an overall productivity of 310.1 mg/(L·h), which laid a foundation for the industrial production of GSH.
glutathione;amino acid;cysteine;recombinant Escherichia coli
10.13560/j.cnki.biotech.bull.1985.2015.09.028
2015-01-14
国家自然科学青年基金项目(21406065),上海市科委产学研医合作项目(13DZ1930200),生物反应器工程国家重点实验室开放课题资助项目(2060204)
王德正,男,硕士,研究方向:发酵工程;E-mail:wdzfromchina@163.com
李志敏,女,博士,教授,研究方向:生物化工,发酵工程,代谢工程,微生物生理和代谢调控;E-mail:lizm@ecust.edu.cn
