转基因水稻cry1Ab/Ac基因及蛋白在肉鸡肠道中的残留检测
2015-10-25徐灯耿丽丽张敏红卢凡张杰
徐灯耿丽丽张敏红卢凡张杰
(1. 湖北工业大学资源与环境学院,武汉 430068;2. 中国农业科学院植物保护研究所 植物病虫害生物学国家重点实验室,北京 100193;3. 中国农业科学院北京畜牧兽医研究所,北京 100193)
转基因水稻cry1Ab/Ac基因及蛋白在肉鸡肠道中的残留检测
徐灯1,2耿丽丽2张敏红3卢凡1张杰2
(1.湖北工业大学资源与环境学院,武汉430068;2.中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京100193;3.中国农业科学院北京畜牧兽医研究所,北京100193)
旨在研究转基因水稻对饲喂肉鸡的影响,以含有转cry1Ab/Ac基因水稻的饲料饲喂肉鸡,分析了肉鸡空肠、回肠、盲肠、直肠中cry1Ab/Ac基因和蛋白残留情况,并用体外实验验证了外源基因的降解情况。结果表明,饲喂转cry1Ab/Ac基因水稻21 d和42 d的肉鸡肠道4个部位中没有检测到cry1Ab/Ac基因残留,体外消化外源基因的实验发现外源基因在肉鸡肠道中约4 h后开始逐步降解。对上述4个部位内容物进行ELISA和Western blot分析,均未检测到 Cry1Ab/Ac蛋白残留。综合分析表明,转基因水稻中的外源基因和蛋白在肉鸡肠道中易被消化和降解。
转基因水稻;肉鸡;基因及蛋白残留;体外消化
水稻是我国主要的粮食作物之一,转基因水稻主要有抗虫、抗病、抗除草剂、抗逆环境以及提高水稻品质等多个品种。转cry1Ab/Ac基因水稻(华恢1号)是华中农业大学自主培育的对二化螟、三化螟、稻纵卷叶螟等具有较强杀虫活性的水稻品种[1],2009年转Bt抗虫水稻华恢1号和汕优63获得农业部颁发的农业转基因生物安全证书(生产应用)[2],具有广阔的应用前景。随着全球转基因作物的商业化和大规模种植[3],在一定程度上缓解了粮食紧缺的问题,但转基因作物可能会对动物等非靶标生物或生态环境产生一些非预期效应,所以推广转基因作物的前提是要确保其安全性。
对转基因作物的安全性评价主要从环境和食用安全性两方面考虑,食品安全性评价包括对营养成分、抗营养因子、毒性、过敏性、抗生素抗性等方面进行全面评估[4]。转基因作物被动物摄食后消化规律是否改变,外源基因及蛋白在肠道及粪便中是否残留,是否存在转移到重要器官和血液中的风险;如果动物体内有外源基因和蛋白残留,是否会在人体内积累残留,这些问题都备受关注。大量的研究发现饲喂转Bt基因或抗除草剂基因的玉米肉鸡,在空肠、回肠、盲肠和排泄物以及重要内脏和血液无外源基因残留[5,6],在肝脏、鸡蛋排泄物中均未发现外源蛋白的残留[7]。而对转基因水稻中外源基因和蛋白残留的报道仅有两例,发现肉鸡小肠壁、血液、肌肉和脾脏等器官中无cry1Ab基因残留[8],在肉鸡十二指肠、空肠、回肠内容物和脾脏等器官中无Cry1Ac蛋白残留[9];迄今国内外尚无转cry1Ab/ Ac基因水稻中外源基因及蛋白在肉鸡体内残留研究的报道。
针对目前基因残留检测中引物单一、覆盖率低等问题,本研究在转基因生物新品种培育科技重大专项的支持下,以饲喂转Bt基因水稻21 d和42 d的肉鸡为材料,采用小片段全覆盖的策略,分析肉鸡肠道内容物中cry1Ab/Ac基因的残留情况,同时采用ELISA和Western blot两种方法检测蛋白残留,旨在为转基因水稻安全性评价提供技术支撑和理论依据。
1 材料与方法
1.1 材料
1.1.1 实验材料 供试水稻品种为华恢1号转cry1Ab/Ac基因水稻,亲本明恢63为对照组,由华中农业大学提供。
1.1.2 试剂 实验所需E. coli DH5α菌株由抗虫生物技术组保存;pMD19-T载体等购自TaKaRa 公司;PVDF膜购自Pall 公司;QIAamp DNA Stool Mini Kit购自QIGEN 公司,QualiPlate试剂盒购自Envirologix公司。鼠源一抗由本实验室制备,二抗鼠抗羊lgG HRP购自北京天德悦生物科技公司。
1.2 方法
1.2.1 肉鸡饲喂 实验饲养肉鸡日粮配制根据中华人民共和国农业行业标准NY/T33-2004《鸡饲养标准》中肉鸡营养需要。一共140只鸡分成14组,其中7组饲喂含有转基因水稻饲料,另7组饲喂对照组水稻饲粮。1-21 d日粮中稻米含量为51.72%,22-42 d稻米含量为56.54%。
在21 d和42 d分别从每个处理中随机取7只鸡,屠宰前使肉鸡禁食12 h,放血处理后解剖肉鸡,分别取空肠、回肠、盲肠、直肠部位置于离心管中液氮冷冻保存。
1.2.2 肉鸡肠道中外源基因残留检测 肉鸡肠道内容物DNA提取用QIAamp DNA Stool Mini Kit试剂盒,按照说明书中的方法提取。方法稍作改动,肠道内容物加入1.6 mL Buffer ASL振荡至均质,加入InhibitEX药片用于去除杂质和PCR干扰物,加入蛋白酶K去除体系中的蛋白,用无水乙醇沉淀DNA,过QIAamp spin柱洗脱后加入200 μL 超纯水。DNA提取后采用DNA定量仪(Thermo公司)测定DNA样品的浓度,并以OD260-280nm检测DNA的纯度。DNA样品用超纯水稀释至40-50 ng/μL,-20℃储存备用。
为了检测外源基因、水稻内源基因残留,分别根据cry1Ab/Ac基因以及水稻内源蔗糖磷酸合酶基因SPS(Sucrose phosphate synthase gene,U33175)[10]和淀粉分支酶基因RBE4(Starch branching enzyme,EF055878)[11]、肉鸡内源基因卵清蛋白ov基因设计引物25对,其中包括扩增cry1Ab/Ac基因全长引物1对和100 bp小片段引物9对、扩增SPS基因100 bp小片段引物11对、扩增RBE4基因全长引物1对和100 bp小片段引物2对、扩增ov基因引物1对,引物序列及扩增长度,见表1,所有引物由生工生物工程公司合成。
PCR反应设置水空白对照、阳性对照、待测样品,每个样品做3个重复。扩增cry1Ab/Ac基因反应条件:94℃ 预 变 性5 min;94℃ 30 s,58℃ 30 s,72℃ 1 min 45 s,30个循环;72℃ 10 min。扩增SPS、ov基因反应条件:94℃预变性5 min;94℃ 30 s,56℃ 30 s,72℃ 20 s,30个循环;72℃ 10 min。扩增RBE4基因反应条件:94℃预变性5 min;94℃ 30 s,54℃ 30 s,72℃ 30 s,30个循环;72℃ 10 min,PCR产物4℃保存,1%琼脂糖凝胶电泳检测。PCR反应体系,见表2。
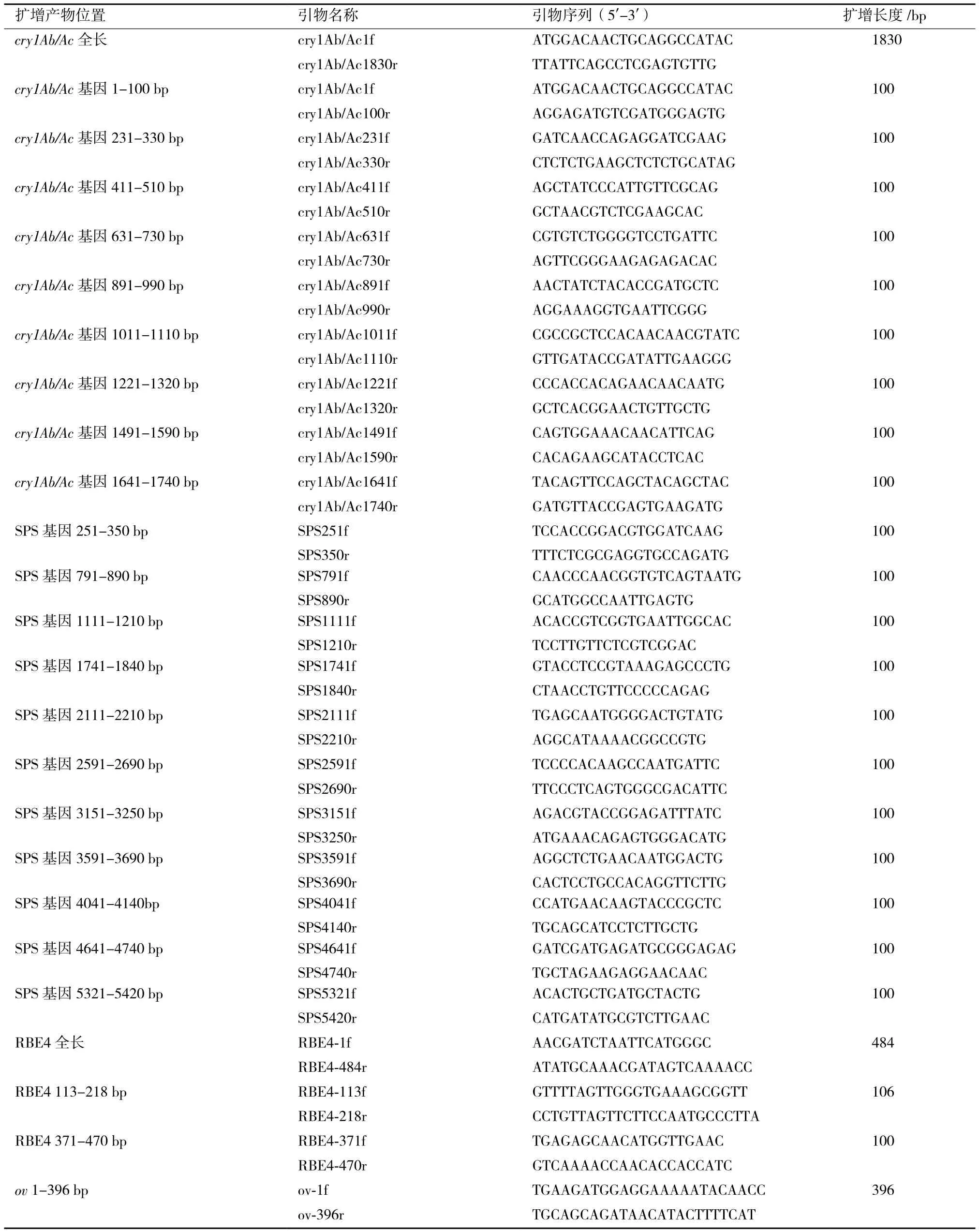
表1 引物序列及扩增产物

表2 PCR反应体系
1.2.3 体外消化cry1Ab/Ac基因模拟实验 cry1Ab/Ac基因50 ng和水稻基因组10 μg加肉鸡肠道内容物5 mg以及对照组cry1Ab/Ac基因50 ng和水稻基因组10 μg分别在37℃温浴0、4、8和12 h,温浴后的产物用QIAamp DNA Stool Mini Kit试剂盒提取DNA,DNA产物用根据cry1Ab/Ac基因所设计的10对引物检测cry1Ab/Ac基因片段。PCR反应条件同1.2.2,1%琼脂糖凝胶电泳检测。
1.2.4 肉鸡肠道中的外源蛋白残留检测 肉鸡肠道内容物总蛋白用PBS(pH7.4)缓冲液提取,总蛋白定量采用BCA方法,试剂盒购自北京艾德莱生物科技有限公司。Cry1Ab/Ac蛋白残留检测采用ELISA双抗夹心法,QualiPlate试剂盒购自美国Envirologix公司,方法按照试剂盒说明书进行,重复3次;其中放置温度均改为37℃,检测结果用Western blot验证。Western blot方法如下:待测样经过SDS-PAGE分离后转印至PVDF 膜上,将膜用TBS-T 溶液漂洗后用20 mL 5%脱脂奶粉封闭2 h,加入含一抗(0.5 μL)的TBS-T漂洗液15 mL,4℃孵育过夜或室温1 h,加入含鼠抗兔IgG二抗(1 μL)的TBS-T漂洗液15 mL,室温1 h,每步结束后漂洗膜3次,每次10 min,最后膜用显色液显色后拍照。
2 结果
2.1 肉鸡肠道中外源基因残留检测
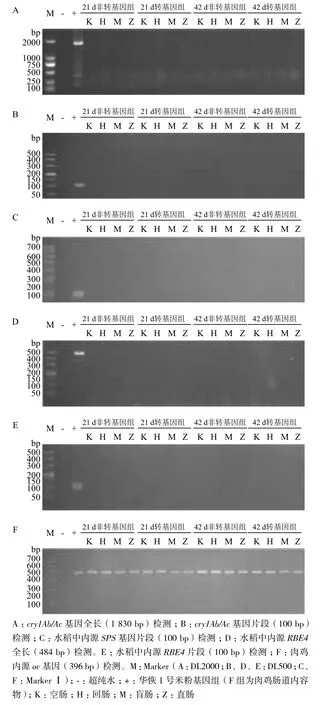
图1 肉鸡肠道内容物提取的总DNA中cry1Ab/Ac基因的PCR检测结果
肉鸡肠道内容物经QIAamp DNA Stool Mini Kit试剂盒提取后,DNA定量仪检测DNA的纯度(OD260-280nm)均在1.7-1.9,将DNA样品用超纯水稀释至40-50 ng/μL,每个样品取1.0 μL用于检测。PCR方法分别检测了肉鸡肠道内容物提取的总DNA中cry1Ab/Ac基因全长和9个小片段基因,琼脂糖凝胶电泳结果显示,仅能扩增出10个片段的相应正对照,在肠道内容物总DNA中,均未检测到cry1Ab/Ac基因全长和9个小片段(图1-A和图1-B)。同样,在空肠、回肠、盲肠和直肠内容物提取的总DNA中,也检测不到水稻内源基因SPS及REB4(图1-C、D和E);但所有的内容物总DNA中都可以检测到肉鸡内源ov基因(图1-F)。
2.2 体外消化cry1Ab/Ac基因模拟实验结果
从消化时间上看,不加肠道内容物对照处理中12 h仍能扩增出全长cry1Ab/Ac基因;然而,cry1Ab/ Ac基因在加入了肠道内容物后,在4 h就检测不到全长cry1Ab/Ac基因(图2-A);但是在4和8 h时还能检测出cry1Ab/Ac基因9个小片段,而到达12 h时,9个小片段均无法检测到(图2-B)。

图2 体外消化cry1Ab/Ac基因全长(A)及片段(B)
2.3 肉鸡肠道中Cry1Ab/Ac蛋白残留检测
ELISA检测前为避免样品中的蛋白浓度对检测结果产生较大影响,先用BCA法对提取的蛋白进行定量,定量至20 μg。用双抗夹心法对样品进行检测,检测结果如表3所示,检测结果中21 d、42 d转基因和非转基因组中盲肠和直肠样品21CM、21CZ、21TM、21TZ、42CM、42CZ、42TM和 42TZ出现比较明显的显色反应,检测值表明其中可能存在Cry1Ab/Ac蛋白残留。

表3 ELISA检测结果
对ELISA检测结果中产生颜色反应的样品进行SDS-PAGE和Western blot分析,结果显示SDSPAGE电泳图中在60 kD处42CZ样品和42TZ样品存在疑似条带,但Western blot分析结果表明这两个样品中并不存在Cry1Ab/Ac蛋白。
3 讨论
家禽肠道中没有Bt蛋白的结合位点,因此,Bt蛋白不会破坏家禽的肠道继而影响家禽发育。但如果转Bt基因水稻中的外源蛋白不易消化,蛋白残留可能会对家禽产生致敏性[12],基因残留也可能引起其他非预期效应,需要对转Bt基因水稻的消化情况进行分析。本研究发现饲喂转Bt水稻肉鸡肠道中没有cry1Ab/Ac基因和蛋白残留,同时用体外消化实验进行了进一步的验证。
针对基因残留检测中引物单一、覆盖率低等问题,本研究采用多对引物同时对cry1Ab/Ac基因全长及基因碎片进行检测。在饥饿12 h的肉鸡肠道内容物中未检测到cry1Ab/Ac基因的残留,这与Rossi和Tony的结果是一致的。Rossi[13]在饲喂转Bt玉米肉鸡肠道中发现外源基因仅在肉鸡肠道消化系统的前面部分嗉囊中检测到,原因是肉鸡在这一时间段不可能完全消化掉饲料。本研究中水稻内源基因SPS和REB4与cry1Ab/Ac基因有同样的降解情况,而Tony等[14]在肉鸡肠道空肠之后的部位能检测到植物内源基因的残留。为了进一步验证动物实验中外源基因在肉鸡肠道中的降解情况,本研究进行了体外模拟实验,结果表明全长cry1Ab/Ac基因在4 h已经降解,而小片段在12 h也降解完全,验证了在饥饿12 h的肉鸡肠道内容物中检测不到cry1Ab/Ac基因的结果。
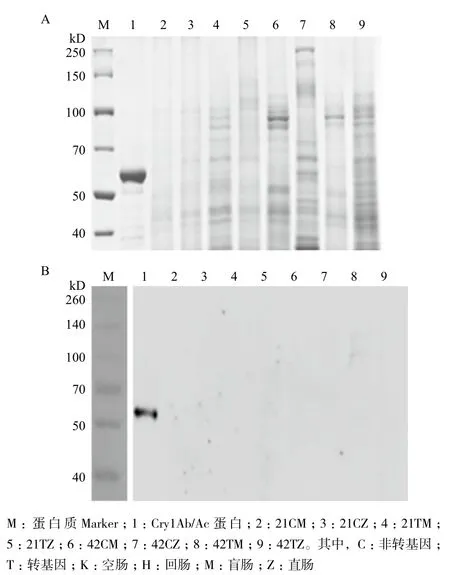
图3 21 d、42 d转基因和非转基因饲喂肉鸡盲肠和直肠内容物总蛋白的SDS-PAGE分析(A)及W estern blot分析(B)
本研究ELISA实验中一些非转基因样品也出现了明显颜色反应,这与Chowdhμry[15]和Einspanier[16]的结果相类似,肉鸡肠道内容物中一些外源或内源的污染物可能会引起显色反应,影响实验的结果。Western blot检测发现样品中并没有Bt蛋白残留[17],与本研究结果一致。随着肠道消化吸收食物,在肠道以外部分如鸡的蛋[18]、血液[5]、肌肉[19,20]、内脏组织[6,21]、粪便[7]中也未检测到外源蛋白的残留。
上述研究充分说明转基因水稻中的外源基因和蛋白在肉鸡肠道内容物中无残留,本实验室进一步利用宏基因组16S rDNA测序技术发现饲喂转Bt基因水稻对肉鸡肠道微生物群落结构无显著影响(数据待发表),当然还需要营养学、毒理学等方面的研究对转Bt基因水稻食用安全性做出全面的评价。
4 结论
本研究分析了饲喂转Bt水稻肉鸡肠道中外源基因和蛋白的残留情况,结果显示,肉鸡肠道内容物中没有cry1Ab/Ac基因和蛋白残留,该研究体系为其他转基因作物对动物饲喂安全性评价提供了借鉴。
[1]Tu JM, Zhang GA, Datta K, et al. Field performance of transgenic elite commercial hybrid rice expressing Bacillus thuringiensis deltaendotoxin[J]. Nature Biotechnology, 2000, 18(10):1101-1104.
[2]Lu C. The first approved transgenic rice in China[J]. GM Crops,2010, 1(3):113-115.
[3]James C. Global Status of Commercialized Biotech/GM Crops:2013[R]. ISAAA Brief 46, 2014.
[4]许文涛, 贺晓云, 黄昆仑, 等. 转基因植物的食品安全性问题及评价策略[J]. 生命科学, 2011, 23(2):179-185.
[5]Swiatkiewicz S, Koreleski J, Arczewska-W losek A, et al. Detection of transgenic dna from Bt maize and herbicide tolerant soybean meal in tissues, eggs and digestive tract content of laying hens fed diets containing[J]. Annals of Animal Science, 2011, 11(3):413-424.
[6]Jennings JC, Albee LD, Kolwyck DC, et al. Attempts to detect transgenic and endogenous plant DNA and transgenic protein in muscle from broilers fed Yield Gard Corn Borer Corn[J]. Poultry Science, 2003, 82(3):371-380.
[7] Ash J, Novak C, Scheideler SE. The fate of genetically modified protein from Roundup Ready Soybeans in laying hens[J]. Journal of Applied Poultry Research, 2003, 12(2):242-245.
[8]杜红方. 转基因水稻作为肉仔鸡日粮原料的安全性评价[D].北京:中国农业科学院, 2006.
[9]秦海峰. 转 Cry1Ac/sck 基因糙米作为肉仔鸡日粮原料的安全性评价[D]. 北京:中国农业科学院, 2012.
[10]Ding JY, Jia JW, Yang LT, et al. Validation of a rice specific gene,sucrose phosphate synthase, used as the endogenous reference gene for qualitative and real-time quantitative PCR detection of transgenes[J]. Journal of Agricultural and Food Chemistry,2004, 52(11):3372-3377.
[11]Jeong SC, Pack IS, Cho EY, et al. Molecular analysis and quantitative detection of a transgenic rice line expressing a bifunctional fusion TPSP[J]. Food Control, 2007, 18(11):1434-1442.
[12]Bannon GA. What makes a food protein an allergen?[J]. Current Allergy and Asthma Reports, 2004, 4(1):43-46.
[13]Rossi F, Morlacchini M, Fusconi G, et al. Effect of Bt corn on broiler growth performance and fate of feed-derived DNA in the digestive tract[J]. Poultry Science, 2005, 84(7):1022-1030.
[14]Tony MA, Butschke A, Broll H, et al. Safety assessment of Bt 176 maize in broiler nutrition:Degradation of maize-DNA and its metabolic fate[J]. Archives of Animal Nutrition-Archiv Fur Tierernahrung, 2003, 57(4):235-252.
[15]Chowdhury EH, Shimada N, Murata H, et al. Detection of Cry1Ab protein in gastrointestinal contents but not visceral organs of genetically modified Bt11-fed calves[J]. Vet Hum Toxicol, 2003,45(2):72-75.
[16]Einspanier R, Lutz B, Rief S, et al. Tracing residual recombinant feed molecules during digestion and rumen bacterial diversity in cattle fed transgene maize[J]. European Food Research and Technology, 2004, 218(3):269-273.
[17]Lutz B, W iedemann S, Einspanier R, et al. Degradation of Cry1Ab protein from genetically modified maize in the bovine gastrointestinal tract[J]. J Agric Food Chem, 2005, 53(5):1453-1456.
[18]Ma QG, Gao CQ, Zhang JY, et al. Detection of transgenic and endogenous plant DNA fragments and proteins in the digesta,blood, tissues, and eggs of laying hens fed with phytase transgenic corn[J]. PLoS One, 2013, 8(4):10.
[19]Gao CQ, Ma QG, Zhao LH, et al. Effect of dietary phytase transgenic corn on physiological characteristics and the fate of recombinant plant DNA in laying hens[J]. Asian-Australasian Journal of Animal Sciences, 2014, 27(1):77-82.
[20]Stadnik J, Karwowska M, Dolatowski ZJ, et al. Effect of genetically modified, insect resistant corn(Mon 810)and glyphosate tolerant soybean meal(Roundup Ready)on physico-chemical properties of broilers’ breast and thigh muscles[J]. Bulletin of the Veterinary Institute in Pulawy, 2011, 55(3):541-546.
[21]Sieradzki Z, Mazur M, Kwiatek K, et al. Assessing the possibility of genetically modified DNA transfer from GM feed to broiler,laying hen, pig and calf tissues[J]. Polish Journal of Veterinary Sciences, 2013, 16(3):435-441.
(责任编辑 狄艳红)
Detection of cry1Ab/Ac Gene and Protein Remained in Gut of Broiler Feeding Transgenic Rice
Xu Deng1,2Geng Lili2Zhang Minhong3Lu Fan1Zhang Jie2
(1. School of Resource & Environmental Engineering,Hubei University of Technology,Wuhan430068;2. State Key Laboratory for Biology of Plant Diseases and Insect Pests,Institute of Plant Protection,Chinese Academy of Agricultural Sciences,Beijing100193;3. Institute of Animal Science,Chinese Academy of Agricultural Sciences,Beijing100193)
To analyze the effects of genetically modified rice on feeding broilers, cry1Ab/Ac gene and protein remained in the jejunum,ileum, cecum and rectum of broiler feeding transgenic rice were detected, and the degradation patterns were testified in vitro. The results showed that there were no residues of cry1Ab/Ac gene in 4 intestinal parts of broilers fed transgenic rice for 21 and 42 d, and cry1Ab/Ac gene gradually degraded after 4 h in the gut in vitro test. No residues of Cry1Ab/Ac protein were detected in contents of the above 4 parts of broilers using ELISA and Western blot. In conclusion, cry1Ab/Ac gene and protein of the transgenic rice were easily digested and degraded in broiler intestines.
transgenic rice;broiler;gene and protein residues;digestion in vitro
10.13560/j.cnki.biotech.bull.1985.2015.09.011
2015-01-28
转基因生物新品种培育重大专项(2012ZX08011001-005)
徐灯,男,硕士,研究方向:转基因生物安全评价;E-mail:xudg1230@163.com
张杰,男,博士,研究员,研究方向:生防微生物功能基因;E-mail:jzhang@ippcaas.cn卢凡,男,博士,教授,研究方向:藻类生物技术;E-mail:lulab99@gmail.com
