经皮肝穿刺胆道引流联合CT引导下微波消融治疗肝门区胆管癌的疗效分析
2015-10-24古善智李国文黄满平熊正平
唐 田, 古善智, 李国文, 黄满平, 黄 斌, 熊正平
·临床研究Clinical research·
经皮肝穿刺胆道引流联合CT引导下微波消融治疗肝门区胆管癌的疗效分析
唐田,古善智,李国文,黄满平,黄斌,熊正平
目的探讨经皮肝穿刺胆道引流联合CT引导下微波消融(MWA)治疗肝门区胆管癌的应用价值。方法回顾性分析自2012年12月至2014年8月29例不可手术切除的Ⅲ、Ⅳ型肝门区胆管癌伴梗阻性黄疸患者,经病理证实胆管腺癌,其中19例行胆道内外引流术,4例行胆道外引流术,6例行左右两侧胆管引流术,待肝功能改善后,行肝门区肿块MWA治疗,29例患者完成46次消融治疗,每例平均1.5次,术后4~8周复查肝功能、增强CT或者MR,采用mRECIST标准评价肿瘤治疗疗效,观察患者的胆红素变化,随访其进展及生存时间。结果术后1个月完全缓解(CR)15例(15/29,51.7%)、部分缓解(PR)17例(17/29,58.6%),整体有效率82%(CR+PR),1例患者术后出现肝内转移,1例出现肺转移,29例患者术后胆红素均明显下降,6个月、1年、2年生存率分别为68.9%(20/29),31.0%(9/29),6.8%(2/29),中位生存期(MST)8.9个月,总生存期(OS)11.7个月。结论经皮肝穿刺胆道引流联合CT引导下MWA治疗肝门区胆管癌是微创、安全、有效的治疗方法。
肝门区胆管癌;微波消融;经皮肝穿刺胆道引流;介入放射学;CT引导
肝门区胆管癌Ⅲ、Ⅳ型因病变浸润左、右两侧胆管,外科手术切除困难,创伤大,并发症多[1-2];肝门区胆管腺癌对放化疗亦不敏感[3],同时患者合并梗阻性黄疸,肝功能较差,无法耐受放化疗,TACE治疗的局限性在于胆管癌往往是乏血供的,栓塞效果欠佳,目前仍无标准的动脉灌注化疗方案。综上原因,我科于2012年12月至2014年8月针对29例不可手术切除的Ⅲ、Ⅳ型肝门区胆管癌伴梗阻性黄疸采取经皮肝穿刺胆道引流(PTCD)联合微波消融(MWA)的治疗方法,研究这一方法在肝门区胆管癌治疗的应用价值。
1 材料与方法
1.1临床资料
29例患者,其中男23例,女6例,年龄42~74岁,平均54.3岁。所有患者均经CT或MR评估符合Ⅲ、Ⅳ型肝门区胆管癌,均经穿刺病理证实为胆管腺癌。其中高分化腺癌17例,中分化6例,低分化6例,并经我院肝胆外科医师评估不可切除。29例患者胆红素中重度升高,平均胆红素值304.8 μmol/L;胆管癌分型Ⅲa型4例、Ⅲb型12例、Ⅳ型13例。29例患者共计29个病变,可测量大小平均为4.27 cm× 5.18 cm。肝功能均属于Child B级。
1.2方法
1.2.1术前准备术前作三大常规、血生化等检查、检验,尤其是排除广泛浸润弥漫型Ⅳ型胆管癌,确定无肝内及远处转移,排除无器质性疾病如严重高血压、心脏病等手术禁忌证,术前常规禁食、禁水12 h。
1.2.2治疗过程所有患者先行DSA引导下PTCD术,术中胆道造影以了解胆道梗阻部位、程度及范围,选择合理的穿刺置管路径,扩张明显者直接在DSA引导下行肝内胆管穿刺,不明显者在B超引导下穿刺,穿刺中胆管后,行胆道造影,根据肝内胆管狭窄的部位及程度,若导丝能够通过狭窄段,则行胆道内、外引流术,若反复尝试未能通过狭窄段,则行外引流术。19例行胆道内外引流术,4例行胆道外引流术;6例因左、右两侧胆管明显狭窄,行双侧胆管引流术,术后持续胆汁引流,2~3周后患者胆红素降至正常值2~3倍以下时,肝功能明显改善后,在静脉全麻CT引导下行WMA治疗,根据病灶的大小,选择合理功率及时间,消融功率50~70 W,平均56.8 W,消融时间8~18 min,平均10.7 min,消融过程多次增强扫描监控消融范围。消融设备采用南京康友MWA治疗仪,型号KY-2000,14 G MWA电极。
1.2.3复查及随访所有患者消融术后1个月后复查增强CT和(或)MR,检测血清胆红素值。对于术后复发及残留的患者,再次行消融治疗,患者前半年内,每个月复查,此后每隔2~3个月复查影像学及生化检查,统计其6个月、1年、2年生存率。
2 结果
2.1肿瘤治疗疗效
29例患者15例(15/29,51.7%)1个月复查病灶呈完全坏死,17例(17/29,58.6%)发现局部复发及残留,1个月再次重复行MWA治疗,总共完成46次治疗,整体有效率82%(CR+PR),其中1例患者术后出现肝内多发转移,1例患者出现双肺转移,疗效PD(2/29,6.8%)。
2.2胆红素的变化
29例患者术前胆红素胆红素值(304.8± 78.2)μmol/L,PTCD术治疗后 1个月复查降至(78.3±23.6)μmol/L,皮肤巩膜黄染明显减轻,消融治疗后半年内,其中13例(13/29,44.8%)总胆红素恢复正常,12例患者降至正常值2倍以内,3例患者出现胆红素一过性升高。
2.3并发症
6例患者在行经PTCD内外引流术后出现胆道感染,予以冲管、抗感染治疗后缓解,2例出现血性胆汁,经止血治疗恢复正常,1例术中出现胆心反射;19例(19/29,65.5%)患者消融治疗后诉不同程度疼痛,15例(15/29,51.7%)出现低热、乏力消融综合征,对症治疗缓解,3例(3/29,10.3%)患者出现消融后胆红素升高,考虑胆道热损伤致炎性水肿,无胆道损伤、狭窄。1例患者术后肝脓肿形成,经积极引流后缓解。
2.4随访结果
29例患者6个月生存率68.9%(20/29),死亡9例中3例死于肝内转移,1例患者出现肾衰竭,2例出现肺部转移继发肺部感染,3例局部复发。随访1年、2年生存率分别为31.0%(9/29),6.8%(2/29),中位生存期(mST)8.9个月,总生存期(OS)11.7个月,死亡原因如下:肝内转移37.9%(11/29),局部复发 20.6%(6/29),远处转移 27.5%(8/29),其他12.7%(4/29)。图1。
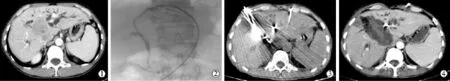
图1 胆管癌PTCD序贯MWA治疗图像
3 讨论
肝门部胆管癌又称Klatskin tumor[1],起源于肝管的左右分叉部,占胆管癌的60%~70%[4],Ⅰ型、Ⅱ型肿瘤范围局限,外科治疗可以取得较理想的效果,对于Ⅲ及Ⅳ型因肿瘤体积过大、侵犯范围广,并常沿肝内胆管浸润、合并侵犯门静脉致使胆管严重阻塞[1,5],导致手术切除率低,创伤大,手术病死率高达10%[6]。临床中70%~80%患者就诊时合并严重的黄疸[7],PTCD操作简便、创伤小、疗效确切等优点[8],广泛应用于临床,所以不能手术切除的肝门部胆管癌先行PTCD解除胆道梗阻,消除黄疸是首要之举,只有患者胆红素下降、肝功能恢复才可能考虑下一步抗肿瘤治疗。由于胆管腺癌对放、化疗均不敏感[3],且肿瘤多为乏血供,DSA造影仅见稀疏样肿瘤染色,碘油沉积少或不沉积,TACE治疗效果差,我们采取了直接CT引导下MWA病灶。
CT导向下MWA治疗是直接将微波辐射电极插入肿瘤内,利用高温直接使细胞蛋白质凝固变性,当肿瘤组织局部温度达到有效治疗温度,如54℃(1 min)或60℃(即刻)以上时,肿瘤完全凝固性坏死[9]。MWA具有热效率高、场强分布广、凝固区组织坏死彻底等特点[10]。灭活的肿瘤组织可产生热休克蛋白,刺激机体的免疫系统,局部和全身免疫功能增强,从而限制肿瘤细胞扩散。研究证明[11-12]:CT导向MWA后,肿瘤和邻近肝组织内的免疫细胞明显增加,提高患者局部免疫功能。
采用PTCD联合CT引导下MWA,首先可以明显降低患者的胆红素,改善患者肝功能,纠正患者的凝血功能,减轻胆管的扩张程度,术中行消融时减少损伤胆管的可能性,同时经皮胆道造影可以进一步显示胆管受侵的情况,了解胆道狭窄的部位、程度、范围,为进一步选择及制定消融计划做准备。其次,留置胆道引流管,在CT引导下常常可以作为消融定位的标志,减少穿刺过程损伤胆管及血管的可能性;最后,消融术后胆道引流管内持续冰盐水循环以降低胆管的热损伤概率,19例内外引流患者,消融术中持续冰盐水灌注,10例外引流患者,不断注入一定的冰生理盐水,并反复抽吸交换,迅速带走MWA过程产生的热量。
本组以增强CT或者MR检测术后活性区域,因为MWA术后病灶缩小并不明显,所以采用mRECIST标准以“存活肿瘤”对靶病灶进行疗效评价,较传统的标准评估更加可靠[13],29例患者术后1个月增强CT或者MR检查,其中完全缓解(CR)15例(15/ 29,51.7%)、部分缓解(PR)17例(17/29,58.6%),整体有效率82%(CR+PR),1例患者术后出现术后引流管引流血性胆汁,考虑系胆管热损伤,胆道出血可能,予以静脉注射血凝酶,及引流管内注射去甲肾上腺素收缩血管后缓解,1例患者因消融范围较大,坏死物引流不畅,术后出现肝脏脓肿,予以置管引流,并抗炎治疗后恢复,3例患者出现一过性的胆红素增高,可能系胆管热损伤导致炎性水肿胆道狭窄加重所致。所有患者胆红素下降明显,肝功能显著改善,总结如下经验:①选择合适的病例,本组29例患者均为呈肿块型,虽然Ⅲ、Ⅳ型肝门区胆管癌侵犯左右两侧胆管,但如果肿块呈弥漫浸润性生长,形态不规则者,往往消融效果欠佳,本组4例术后早期即转移患者均为肿块浸润相对较为广泛。②术前计划好进针路线,良好的影像学基础及穿刺技术,准确识别肝门区结构,巧妙利用引流管作为定位标志,必要时术中予以增强扫描鉴别。③尽量选择小功率长时间消融,由于MWA加热速度迅速,若选择高功率消融,不仅无法控制消融范围,而且容易损伤肝门区结构,导致胆管狭窄,术后大出血等严重并发症。④消融术中,建议予以CT增强扫描,实时观察消融范围,尽量使消融范围覆盖肿瘤,微波消融血管凝固能力强,术中因误穿部分小血管,可开启微波直接凝固血管,肝门区常有较大的血管通过,但因 “heat-sink”热沉降效应,不会对门静脉主支造成损伤[14-15]。
而国内外文献报道的肝门胆管癌仅有不到35%患者适合行手术切除[5-6],大多数行姑息治疗的患者其生存时间不超过10个月[16],本组29例患者6个月、1年、2年生存率分别为 68.9%(20/29),31.0%(9/29),6.8%(2/29),中位生存期(mST)8.9个月,总生存期(OS)11.7个月,相对外科比较,该方法具有创伤小、并发症少,恢复快等优点,因此,PTCD联合CT引导下MWA治疗肝门区胆管癌是微创、安全、有效的治疗方法。其远期疗效及具体影响预后因素需要大样本对照实验进一步研究。
[1]Klatskin G.Adenocarcinoma of the hepatic duct at its bifurcation within the porta hepatis.An unusual tumor with distinctive clinical and pathological features[J].Am J Med,1965,38:241-256.
[2]Chen W,Ke K,Chen YL.Combined portal vein resection in the treatment of hilar cholangiocarcinoma:a systematic review and meta-analysis[J].Eur J Surg Oncol,2014,40:489-495.
[3]Soares KC,Kamel I,Cosgrove DP,et al.Hilar cholangiocarcinoma:diagnosis,treatment options,and management[J]. Hepatobiliary Surg Nutr,2014,3:18-34.
[4]Skipworth JR,Keane MG,Pereira SP.Update on the management of cholangiocarcinoma[J].Dig Dis,2014,32:570-578.
[5] Yu W,Gu Z,Shi S,et al.Effect evaluation of vascular resection for patients with hilar cholangiocarcinoma:original data and meta-analysis[J].Cell Biochem Biophys,2014,69:509-516.
[6]Zhang BY,Lu Y,Dong Q,et al.Surgical treatment and prognostic analysis of 93 cases of hilar cholangiocarcinoma[J].Am J Med Sci,2010,339:221-224.
[7] Lee TH.Technical tips and issues of biliary stenting,focusing on malignant hilar obstruction[J].Clin Endosc,2013,46:260-266.
[8]刘磊,黄强,王成,等.晚期恶性梗阻性黄疸姑息引流治疗的临床疗效及预后分析[J].肝胆外科杂志,2012,20:359-362.
[9] 董宝玮,梁萍,于小玲,等.超声引导下微波治疗肝癌的实验研究及临床初步应用[J].中华医学杂志,1996,02:87-91.
[10]Brace CL,Laeseke PF,Sampson LA,et al.Microwave ablation withmultiplesimultaneouslypoweredsmall-gauge triaxialantennas:results from an in vivo swine liver model[J].Radiology,2007,244:151-156.
[11]Haemmerich D,Laeseke PF.Thermal tumour ablation:devices,clinical applications and future directions[J].Int J Hyperthermia,2005,21:755-760.
[12]Liang P,Dong B,Yu X,et al.Prognostic factors for survival in patientswithhepatocellularcarcinomaafterpercutaneous microwave ablation[J].Radiology,2005,235:299-307.
[13]Eisenhauer EA,Therasse P,Bogaerts J,et al.New response evaluation criteria in solid tumours:Revised RECIST guideline (version 1.1)[J].Eur J Cancer,2009,45:228-247.
[14]Frericks BB,Ritz JP,Albrecht T,et al.Influence of intrahepatic vessels on volume and shape of percutaneous thermal ablation zones:in vivo evaluation in a porcine model[J].Invest Radiol,2008,43:211-218.
[15]Yu NC,Raman SS,Kim YJ,et al.Microwave liver ablation:influence of hepatic vein size on heat-sink effect in a porcine model[J].J Vasc Interv Radiol,2008,19:1087-1092.
[16]Furusawa N,Kobayashi A,Yokoyama T,et al.Surgical treatment of 144 cases of hilar cholangiocarcinoma without liver-related mortality[J].World J Surg,2014,38:1164-1176.
PTCD combined with CT-guided microwave ablation for hepatic hilar cholangiocarcinoma:analysis of therapeutic efficacy
TANG Tian,GU Shan-zhi,LI Guo-wen,HUANG Man-ping,HUANG Bin,XIONG Zheng-ping.Department of Interventional Radiology,Hunan Provincial Cancer Hospital&Affiliated Cancer Hospital of Xiangya School of Medicine,Central South University,Changsha,Hunan Province 410013,China
GU Shan-zhi,E-mail:gushanzhi2015@163.com
ObjectiveTodiscusstheclinicalapplicationofpercutaneoustranshepatic cholangiopancreatic drainage(PTCD)combined with CT-guided microwave ablation in treating hepatic hilar cholangiocarcinoma.MethodsThe clinical data of 29 patients with inoperableⅢ andⅣ type hilar cholangiocarcinoma complicated by obstructive jaundice,who were admitted to authors'hospital during the period from December 2012 to August 2014,were retrospectively analyzed.The diagnosis of bile duct adenocarcinoma was confirmed by pathology in all patients.Of the 29 patients,both internal and external biliary tract drainage was employed in 19,external biliary tract drainage in 4,and bilateral(both left and right side)bile duct drainage in 6.CT-guided microwave ablation was carried out when the liver function became improved.A total of 46 procedures of microwave ablation were completed in the 29 patients with a mean of 1.5 times per patient.Hepatic function tests,enhanced CT or MR scan were performed 4-8 weeks after treatment.According to mRECIST criteria the therapeutic results were evaluated;the serum bilirubin levels were recorded;the disease progress and the patient's survival time were followed up.ResultsOne month after the treatment,complete response(CR)was obtained in 15 patients(15/29,51.7%),and partial remission(PR)in 17 patients(17/29,58.6%),with the overall efficacy(CR+PR)being 82%.After the treatment,one patient developed hepatic metastasis and another one had pulmonary metastasis.Postoperative serum bilirubin levels showed an obvious decrease in all 29 patients.The 6-month,one-year and two-yearsurvival rates were 68.9%(20/29),31.0%(9/29)and 6.8%(2/29)respectively;the median survival time was 8.9 months and the overall survival time was 11.7 months.ConclusionFor the treatment of hepatic hilar cholangiocarcinoma,PTCD combined with CT-guided microwave ablation is minimally invasive,clinically safe and effective.(J Intervent Radiol,2015,24:811-814)
hepatic hilar cholangiocarcinoma;microwave ablation;percutaneous transhepatic cholangiopancreatic drainage;interventional radiology;CT guidance
R735.8
B
1008-794X(2015)-09-0811-04
2014-11-22)
(本文编辑:俞瑞纲)
10.3969/j.issn.1008-794X.2015.09.017
410013长沙湖南省肿瘤医院(中南大学湘雅医学院附属肿瘤医院)放射介入科
古善智E-mail:gushanzhi2015@163.com
