血清PCT CRP及TNF-α检测对小儿脑膜炎的鉴别诊断价值
2015-10-22王素梅齐旭升通讯作者
王素梅 齐旭升(通讯作者)
湖北医药学院附属太和医院儿科 十堰 442000
脑膜炎是小儿常见的中枢神经感染性疾病之一,可由细菌或病毒感染引起,其中细菌性脑膜炎有时可造成严重并发症进而危及患儿生命[1]。但细菌性脑膜炎与病毒性脑膜炎病程常不易区别,尤其在病程初期,患儿病原学检出率不高、脑脊液不典型,常因误诊而造成治疗延误,另一方面临床上有时将病毒性脑膜炎误诊为细菌性脑膜炎而造成抗生素滥用。因此,对细菌性脑膜炎和病毒性脑膜炎予早期鉴别并给予有效治疗措施是提高治愈率,减少中枢神经系统后遗症和改善预后的关键[2]。血清C 反应蛋白(CRP)和肿瘤坏死因子-α(TNF-α)是机体炎症反应中的重要参与者,血清降钙素原(PCT)近年来在鉴别对细菌感染和非细菌感染中的高敏感性和特异性也不断被关注。因此,本研究旨在探讨血清PCT、CRP及TNF-α检测对小儿脑膜炎的鉴别诊断价值。
1 资料与方法
1.1 一般资料 选取2013-01—2014-06我院儿科收治的62例中枢神经系统感染患儿,其中细菌性脑膜炎32 例,男18例,女14例,平均年龄(5.6±2.5)岁;病毒性脑膜炎30 例,男19例,女11例,平均年龄(6.2±3.1)岁,均因发热、头痛伴或不伴抽搐来院就诊,均符合《儿科学》制定的诊断标准[3]:急性起病,临床上患儿有感染中毒的一般表现,颅内高压征如头痛、恶心,脑膜刺激征如凯尔尼格征、巴宾斯基征阳性等。细菌性脑膜炎除上述表现外还包括脑脊液涂片或培养致病菌阳性,并排除霉菌性、结核性脑膜炎;病毒性脑膜炎还应包括脑脊液中检测到特异性病毒抗体(或PCR 检测到病毒DNA),排除细菌、霉菌、结核杆菌感染。排除标准:(1)合并先天性心脏病、免疫缺陷病等基础疾病者;(2)合并全身性细菌感染者;(3)中毒性脑病、热型惊厥;(4)临床诊断符合而脑脊液正常的不典型的患儿。选取我院体检的30例健康患儿纳入对照组,男16 例,女14 例,平均年龄(6.1±3.4)岁。
1.2 方法 患儿均于入院次日抽取清晨空腹抽取静脉血,分离血清后置于-20 ℃条件下保存待测。采用免疫比浊法测定血清CRP 水平,采用双抗夹心ELISA 法检测血清PCT、TNF-α水平,均严格按照试剂盒操作步骤进行。
1.3 统计学分析 使用SPSS 13.0软件,计量数据采用均数±标准差表示,比较采用t检验,P<0.05为差异有统计学意义。
2 结果
细菌性脑膜炎组患儿血清PCT、CRP 及TNF-α均较病毒性脑膜炎组、对照组明显升高,差异有统计学意义(P<0.05);PCT 在病毒性脑膜炎组及对照组患儿间比较差异无统计学意义(P>0.05);血清CRP、TNF-α在病毒性脑膜炎组明显高于对照组,差异有统计学意义(P<0.05)。见表1。
表1 3组血清PCT、CRP及TNF-α水平比较
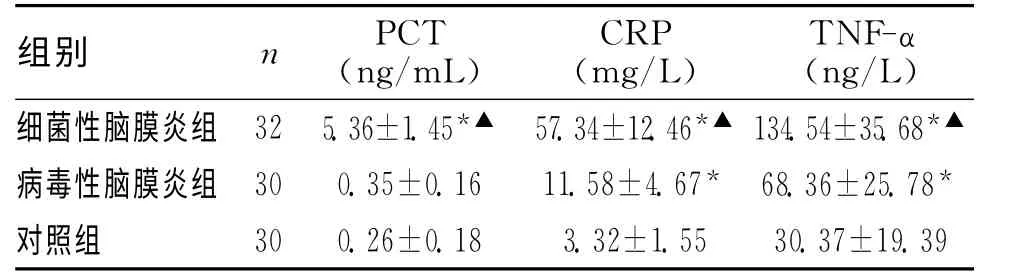
表1 3组血清PCT、CRP及TNF-α水平比较
注:与对照组比较,*P<0.05;与病毒性脑膜炎组比较,▲P<0.05
组别 n (ngP/C mTL ) (m CgR/PL ) (Tn Ng/FL-α)细菌性脑膜炎组 32 5.36±1.45*▲ 57.34±12.46*▲134.54±35.68*▲病毒性脑膜炎组 30 0.35±0.16 11.58±4.67* 68.36±25.78*对照组30 0.26±0.18 3.32±1.55 30.37±19.39
3 讨论
小儿脑膜炎是常见的感染性疾病,临床上诊断本病主要根据症状、体征,脑脊液常规及生化,血清学相关抗体检测、病原菌培养等。细菌性脑膜炎又称化脓性脑膜炎,随着以抗生素为主的综合支持治疗措施的发展,细菌性脑膜炎的病死率已经明显降低,但患儿后遗症发生率仍高达10%[4],因此早期诊断和恰当干预具有重要意义。但是由于临床上抗生素的广泛应用,使临床及脑脊液表现不典型的患儿不断增加,疾病早期缺乏可靠、敏感的检测指标,给细菌性脑膜炎的的早期诊断带来了很大困难,也导致了临床医师在明确病原体前予以经验性的应用不同等级的抗生素,不可避免的造成一定程度上的抗生素滥用现象[5],进而增加了耐药性细菌感染的危险。
细胞因子在炎症性疾病的发生发展中起着非常重要的作用,机体可出现促炎和抗炎细胞因子之间相互促进、相互制约。肿瘤坏死因子-α(TNF-α)作为一种主要由单核-吞噬细胞产生的单核因子,具有多种生物学活性,并且对机体炎症反应具有重要促进作用。TNF-α可刺激激下丘脑体温调节中枢引起体温升高,并可直接破坏血脑屏障,增加其通透性,通过与神经细胞和神经胶质细胞作用使其表达更多的细胞因子及其受体,进而扩大炎性反应,加重神经细胞损伤[6]。有研究表明小儿发生急性中枢神经系统感染时,TNF-α水平与病情程度密切相关[7]。CRP是一种主要由IL-6诱导肝脏合成的急性时相反应蛋白,其增长速度与炎症反应的范围及程度呈正相关,由肝细胞合成,以微量形式存在于血清中。一旦机体发生炎症或组织损伤后,CRP 则在4~6h内迅速合成并增加,在36~50h达高峰,且由于其半衰期短,可在炎症控制后迅速下降,因此血清CRP已成为感染性疾病诊断、疗效观察和预后判断的重要指标[8]。血清PCT 是降钙素的前体,由116个氨基酸组成,半衰期为25~30h,在体内与体外均具有良好的稳定性,正常情况下血清中含量极少,但在细菌感染特别是重症感染时,肝脏的巨噬细胞及单核细胞,肺、肠道组织的淋巴细胞等均可迅速合成并分泌PCT,使血清PCT 水平显著升高,其灵敏度及特异性远远优于CRP,且PCT 值与感染的严重性具有明显相关性[9],但对于病毒感染、非细菌感染患者,血清PCT 水平并不升高,或仅轻度升高[10]。本研究发现,细菌性脑膜炎患儿血清细菌性脑膜炎组患儿血清PCT、CRP及TNF-α均较病毒性脑膜炎组、对照组明显升高,差异有统计学意义(P<0.05),但PCT 在病毒性脑膜炎组及对照组患儿间比较差异无统计学意义(P>0.05),表明检测患儿血清PCT 水平对鉴别细菌性和病毒性脑膜炎具有重要的价值。
综上所述,血清PCT 水平可作为早期诊断及鉴别诊断小儿细菌性脑膜炎、病毒性脑膜炎的一个敏感指标,联合检测PCT 与CRP、TNF-α则更具临床价值。
[1] 刘敏,庞玉生,石靖.细菌性脑膜炎并脑积水的临床特点及危险因素[J].实用儿科临床杂志,2012,27(10):774-776.
[2] 王砚冰,程大也.脑脊液白细胞介素-6和白细胞介素-8在细菌性脑膜炎和病毒性脑膜炎鉴别诊断中的意义[J].山西医药杂志,2012,41(4):391-393.
[3] 杨锡强,易著文.儿科学[M].6版.北京:人民卫生出版社,2003:464-465.
[4] 张金晶,王亚娟.儿童细菌性脑膜炎的后遗症及其危险因素研究进展[J].中华实用儿科临床杂志,2013,28(12):939-942.
[5] 王莹.不同方法治疗小儿细菌性脑膜炎的临床研究[J].吉林医学,2013,34(11):2 029-2 030.
[6] 秦海云.TNF-α和IL-1β在细菌性脑膜炎患儿血清中的表达及其临床意义[J].中国现代医生,2013,51(11):154-155.
[7] 谢军,李书锦,许红.儿童感染性脑膜炎后期中CRP、IL-6、TNF的测定的价值[J].中国实用医药,2008,3(26):63-64.
[8] 何静,卢卫国.联合测定血清PCT 与CRP对感染性疾病的诊断价值[J].检验医学与临床,2012,9(15):1 904-1 905.
[9] 张伟新.儿童全身炎症反应综合征与降钙素原质量浓度的相关性研究[J].基层医学论坛,2011,15(1):29-30.
[10] 侯丽,李巍,古丽娜尔·沙丁.降钙素原对儿童细菌性脑膜炎鉴别诊断的Meta分析[J].中国循证儿科杂志,2013,8(5):331-337.
