复合益生菌粉对刺参生长·体壁成分和消化酶活性的影响
2015-10-21钱淑媛王福强憨素连等
钱淑媛 王福强 憨素连等

摘要 [目的]研究饲料中添加复合益生菌粉对刺参生长、体壁成分和消化酶活性的影响。[方法] 在基础日粮中分别添加含有0、0.2%、0.4%、0.6%、0.8%的复合益生菌粉(由枯草芽孢杆菌、嗜酸乳杆菌、酿酒酵母菌组成,含有106CFU/g)进行喂养试验,养殖8周。[结果]随着复合益生菌添加量的提高,刺参增重率和特殊生长率有增加趋势。与对照组相比,添加0.8%的复合益生菌能显著提高刺参的增重率和特定生长率(P<0.05)。复合益生菌对刺参成活率和体壁成分均无显著影响(P>0.05)。复合益生菌对刺参肠道的消化酶活性也无显著影响(P>0.05),但有提高刺参肠道脂肪酶活性的趋势。当益生菌添加量为0.4%时,刺参脂肪酶活性最高。[结论]复合益生菌粉能够促进刺参的生长。当益生菌添加量为0.8%时刺参的生长较好。
关键词 复合益生菌;刺参;生长;消化酶活性
中图分类号 S816 文献标识码 A 文章编号 0517-6611(2015)20-129-04
Abstract [Objective] The experiment was conducted to investigate the effects of compound probiotics powder on the growth,body wall composition and digestive enzyme activity of sea cucumber,Apostichopus japonicus.[Method] Five diets were formulated by supplementing with 0.0%(control),0.4%,0.6% and 0.8% compound probiotics (Bacillus subtilis,Lactobacilli acidophilus,Saccharomyces cerevisiae,106cfu/g) in basal diet,respectively.The experiment lasted for 8 weeks.[Result] Weight gain and specific growth rate had an increasing trend with increasing compound probiotics,weight gain and specific growth rate in sea cucumber fed the diets with 0.8% supplementation were significantly higher than that of control group (P<0.05).There were no significant difference on survival rate and body wall composition among treatments (P>0.05).Although there were no significant difference on digestive enzyme activity (P>0.05),sea cucumber fed the diets with compound probiotics showed higher trends of lipase activity than those fed the control diet.The highest lipase activity appeared in 0.4% supplementation group.[Conclusion] Diet supplementing with 0.8% compound probiotics can promote the growth performance of sea cucumber .
Key words Compound probiotics; Apostichopus japonicus; Growth performance; Digestive enzyme activity
刺參是棘皮动物门、海参纲的动物,是我国黄渤海海域最具经济价值的水产养殖品种之一。大规模、高密度的刺参人工养殖、药物滥用常常会导致刺参的疾病和死亡大规模爆发等问题。在饲料中添加益生菌,不仅可以提高养殖动物的增重率,而且可以增强养殖动物的免疫力,降低疾病的发生几率,是实现生态养殖的重要方式。
大量研究表明,益生菌对鱼类的生长有积极作用[1-3]。益生菌还可以产生多种酶类,减少细菌毒素毒害的发生[4]。
复合益生菌比单一益生菌对水产动物有更好的作用效果。胡毅等[5]用复合益生菌和单一益生菌投喂凡纳滨对虾,复合益生菌组的特定生长率、饲料效率、溶菌酶活力和血清蛋白浓度等均优于单一益生菌组。Salinas等[6]用芽孢杆菌和乳酸菌复合投喂乌颊鱼(Gilthead seabream)效果比单一的这2种菌更好。
益生菌在刺参养殖上的应用研究还较少报道。笔者研究了复合益生菌粉对刺参的生长、刺参体壁成分和肠道消化酶活性的影响,探索益生菌在刺参方面的应用,以期为刺参的可持续养殖提供参考。
1 材料与方法
1.1 材料
1.1.1 复合益生菌。
试验所用的复合益生菌由大连阳光白奥科技有限公司生产,由枯草芽孢杆菌(Bacillus subtilis, 106CFU/g以上)、嗜酸乳杆菌(Lactobacilli acidophilus, 106CFU/g以上)、酿酒酵母(Saccharomyces cerevisiae, 106CFU/g以上)组成。
1.1.2 试验动物。
试验所用刺参来自大连水益生海洋生物科技公司的同一批次刺参苗,刺参购回后暂养驯化7 d。挑取个体大小均匀的健康刺参随机分为5组,每组3个重复,每个重复30头刺参,试验刺参初始体重为(1.07±0.02)g。
1.1.3 试验地点。养殖试验在大连海洋大学辽宁省水生生物学重点实验室进行。
1.2 方法
1.2.1 试验饲料。试验基础日粮组成和营养成分见表1~2。分别在基础日粮中添加0、0.2%、0.4%、0.6%和0.8%的复合益生菌,制成A、B、C、D、E 5组饲料。在低于20 ℃室内阴干后,贮存于-20 ℃的冰箱中备用。
1.2.2 饲养管理。
每天以刺参体重的3%投饵,根据摄食情况适当调整饲喂量,达到饱食投喂,每天17:20投喂1次,次日13:30吸除残饵和粪便,并补充暂存1 d的沙虑海水。饲养期间连续充气,水温控制在(15±3)℃。养殖试验持续56 d。
1.2.3 生长指标的测定。
同时,采集刺参体壁进行体成分分析。粗蛋白的测定采用凯氏定氮法(GB/T 6432-1994),粗脂肪的测定采用索氏抽提法(GB/T 6433-1994),灰分的测定采用550 ℃灼烧质量法(GB/T 6438-2007)。
1.2.4 肠道消化酶活性的测定。粗酶液的提取:刺参肠道粗酶液的提取参照袁成玉等[7]的方法进行,收集刺参后,在冰盘中将肠道取出,将刺参肠道内容物挤出,并用冷冻双蒸水冲洗干净。用滤纸轻轻吸干水分,迅速称重,在匀浆器中匀浆,并且稀释10倍制成匀浆液,4 ℃下3 000 r/min 离心30 min,取上清液立即测定。
肠道中蛋白酶的活力采用福林-酚法进行测定。肠道中淀粉酶的活力采用淀粉-碘显色法进行测定。肠道中脂肪酶活力采用滴定法进行测定[8]。
1.2.5 数据处理。
试验结果以平均值±标准差表示,并使用SPSS17.0统计软件进行方差分析,在差异显著时对平均数进行邓肯氏多重比较。
2 结果与分析
2.1 复合益生菌对刺参生长、存活率及体成分的影响 由表2可知,各组刺参的始重无显著差异(P>0.05);养殖56 d后添加益生菌的各组刺参末重、增重率和特定生长率随着益生菌添加量的增加呈现递增的趋势。其中,E组增重率和特定生长率均显著高于A、B、C组(P<0.05),其他试验组与A组差异不显著(P>0.05);各试验组刺参的存活率较高,但各组之间没有显著差异(P>0.05)。
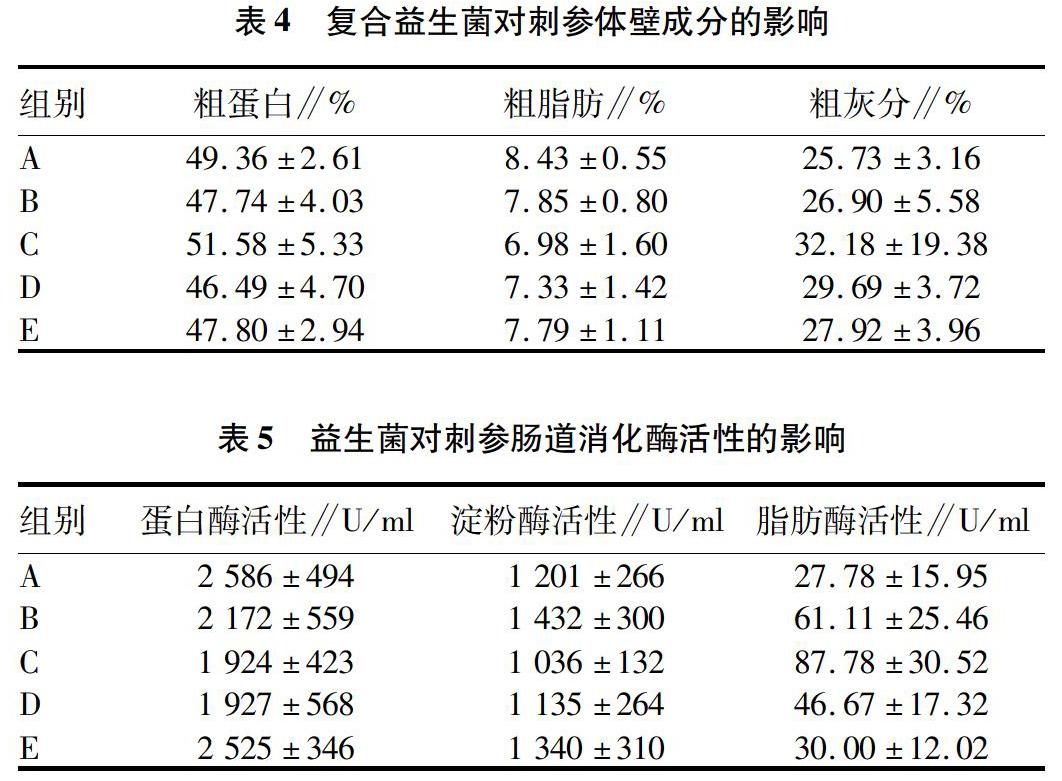
2.2 复合益生菌对刺参体壁成分的影响
由表3可知,试验组的粗脂肪含量较低,粗灰分含量较高,但各组间刺参体壁的粗蛋白、粗脂肪和粗灰分含量均没有显著差异(P>0.05)。
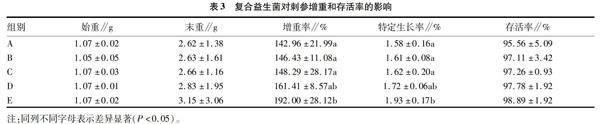
2.3 复合益生菌对刺参肠道消化酶活性的影响
由表4可知,随着益生菌添加量的增加,刺参肠道中蛋白酶活性有轻微的降低趋势,E组有所回升。但是,不同处理组间肠道蛋白酶活力没有显著差异(P>0.05)。刺参肠道中淀粉酶活性B组比A组有所升高,C组反而降低,之后又升高。不同处理组间肠道淀粉酶活力没有显著差异(P>0.05)。刺参肠道中脂肪酶活性先逐渐上升,后有所回落。但是,不同处理组间肠道脂肪酶活力也没有显著差异(P>0.05)。
3 讨论与结论
3.1 饲料中添加益生菌对刺参生长和存活率的影响
芽孢杆菌可以饲料的形式进入水产動物的消化道中,提高其消化酶的活性,促进动物生长[9-10]。有学者推测,芽孢菌可以促进水产动物的生长和消化,可能是由于芽孢菌可以分泌丰富的胞外消化酶类,对水产动物有辅助消化的作用[11]。
嗜酸乳杆菌具有较高的蛋白水解酶活性[12],这可能有辅助消化作用。Son等[13]在石斑鱼饲料中添加4周的植物乳酸杆菌后,石斑鱼的增重率和饲料效率显著提高。Suzer等[14]的研究表明,在黑鲷(Sparus aurata)的仔鱼发育阶段使用乳酸菌,可以提高仔鱼的生长性能和消化酶活性。Aly等[15]在饲料中添加乳酸菌,饲喂罗非鱼1个月和2个月后均可以显著提高其体增重。Ha等[16]将1 g/kg的热灭活的植物乳酸杆菌添加到对虾的饲料中,可以提高对虾的存活率、体增重率和特定生长率。王国霞等[17]证实添加10%的乳酸菌可以提高南美白对虾的成活率、增重率和特定生长率,降低饵料系数。在凡纳滨对虾的研究中也得到相似结果[18]。
酵母菌含有丰富的菌体蛋白,可以作为水产动物的饵料而被利用。酵母的细胞蛋白可以替代一定的鱼粉或虾粉,并且适宜的替代量可以促进鱼虾的生长,提高饲料效率,从而降低养殖成本[19]。
大量研究表明,饲料中添加益生菌也可以促进刺参的生长性能。王路平等[20]发现微生态制剂能够净化养殖水质,并且显著提高刺参生长速度。周慧慧等[21]发现仿刺参肠道中分离的益生菌能够使刺参生长得到促进,抗病力也有所加强。李明[22]用酵母菌和枯草芽孢杆菌投喂刺参,刺参的特定生长率显著提高。袁成玉等[7]用光合细菌和芽孢杆菌饲喂刺参后特定生长率明显提高。该试验中饲料中添加0.8%复合益生菌能显著提高刺参的增重率和特定生长率,但较低水平的益生菌添加量的促生长作用不明显。该试验结果与上述研究基本一致。这也预示着益生菌必须达到一定的添加量才具有促进生长的效果。
3.2 饲料中添加益生菌对刺参体成分的影响
为了考察饲料添加剂对刺参品质的影响,在试验结束后测定刺参体壁中主要营养成分。该试验中粗蛋白和粗脂肪含量与对照组相比均无显著差异(P>0.05),C组的粗灰分含量最高,但与其他组间差异不显著(P>0.05)。Shear[23]认为影响粗蛋白含量的因素主要是内因(如鱼体大小,不同发育阶段)造成的,而外因(如温度、盐度、日粮等)对鱼体粗蛋白含量没有影响。鲁琳等[24]研究表明在饲料中添加微生物制剂对虹鳟鱼体成分无明显不良影响。这些研究与该试验结果类似。
3.3 复合益生菌对刺参肠道消化酶活性的影响
大量研究表明,飼料中添加一些益生菌能影响鱼的消化酶活性。华雪铭等[25]研究表明枯草杆菌和地衣芽孢杆菌等益生菌能提高暗纹东方鲀肠道的消化酶活性。丁贤等[26]研究发现芽孢杆菌能显著影响对虾肠道中蛋白酶活性。Pan等[27]研究表明添加芽孢杆菌制剂的鲤鱼试验组肠道蛋白酶和淀粉酶活性均比对照组显著提高。一定浓度的芽孢杆菌也显著提高了印度白对虾和凡纳滨对虾肠道蛋白酶、淀粉酶和脂肪酶等消化酶的活性[28-29]。Suzer等[14]报道在金头鲷的仔鱼发育阶段使用乳酸菌可以提高仔鱼的生长性能和消化酶活性。ZiaeiNejad[28]认为益生菌可以刺激对虾产生内源性酶,从含有益生菌的日粮中获得高活力的酶。
益生菌对刺参肠道消化酶的影响也有报道。张艳婷[30]研究表明灭活植物乳杆菌也能提高刺参肠道的蛋白酶和淀粉酶的活性。张涛等[31]用仿刺参肠道筛选的乳酸菌和芽孢杆菌投喂仿刺参,提高了肠道内蛋白酶和淀粉酶的活性。李明[22]用酵母菌和枯草芽孢杆菌投喂刺参,刺参的脂肪酶、淀粉酶、胰蛋白酶都显著提高。袁成玉等[7]用光合细菌和芽孢杆菌饲喂刺参后,蛋白酶和淀粉酶的活性高于对照组。
该试验中添加不同水平的复合益生菌对蛋白酶、脂肪酶和淀粉酶活性均无显著差异。该试验结果与上述文献报道并不一致。这可能是此次试验的水温较低(12~15 ℃)、益生菌的添加量也较低(106 CFU/g),导致芽孢杆菌和酵母菌等益生菌产酶活力较弱所致,有必要研究在不同水温下添加更大剂量益生菌对刺参肠道消化酶活性的影响,以探讨益生菌作用的最适水温和最适添加量。
参考文献
[1] 邱燕,蔡春芳,代小芳,等.枯草芽孢杆菌对草鱼生长性能与肠道黏膜形态的影响[J].中国饲料,2010(19):34-36.
[2] GHOSH K,SEN S K,RAY A K.Supplementation of an isolated fish gut bacterium,Bacillus circulans, in formulated diets for rohu,Labeo rohita, fingerlings[J].Bamidgeh,2003,55:13-21.
[3] 李卫芬,沈涛,陈南南,等.饲料中添加枯草芽孢杆菌对草鱼消化酶活性和肠道菌群的影响[J].大连海洋大学学报,2012,27(3):221-225.
[4] HARRIS L J,DAESCHEL M A,STILES M E,et al.Antimicrobial activity of lactic acid bacteria against Listeria monocytogenes[J].Journal of Food Protection,1989,52(6):384-387.
[5] 胡毅,谭北平,麦康森,等.饲料中益生菌对凡纳滨对虾生长、肠道菌群及部分免疫指标的影响[J].中国水产科学,2008,15(2):244-251.
[6] SALINAS I,CUESTA A,ESTEBAN M.Dietary administration of Lactobacillus delbrueckii and Bacillus subtilis, single or combined,on gilthead seabream cellular innate immune responses[J].Fish Shellfish Immunol,2005,19:67-77.
[7] 袁成玉,张洪,吴垠,等.微生态制剂对幼刺参生长及消化酶活性的影响[J].水产科学,2006,25(12):612-615.
[8] 桂远明.水产动物机能学实验[M].北京:中国农业出版社,2004:124-147.
[9] WANG Y B.Effect of probiotics on growth performance and digestive enzyme activity of the shrimp Penaeus vannamei[J].Aquaculture,2007,269(1/4):259-264.
[10] ALY S M,MOHAMED M F,JOHN G.Effect of probiotics on the survival,growth and challenge infection in Tilapia nilotica (Oreochromis niloticus)[J].Aquaculture Research,2008,39(6):647-656.
[11] GATESOUPE F J.The use of probiotics in aquaculture[J].Aquaculture,1999,180(1/2):147-165.
[12] ZHAO R X,SUN J L,MO H Z,et al.Analysis of functional properties of Lactobacillus acidophilus[J].World Journal of Microbiology and Biotectmology,2007,23(2):195-200.
[13] SON V M,CHANGA C C,WU M C,et al.Dietary administration of the probiotic,Lactobacillus plantarum,enhanced the growth,innate immune responses,and disease resistance of the grouper Epinephelus coioides[J].Fish Shellfish Immunol,2009,26:691-698.
[14] SUZER C,COBAN D,KAMACI H O,et al.Lactobacillus spp.bacteria as probioticsin gilthead sea bream (Sparus aurata L) larvae:Effects on growth performance and digestivc enzyme activities[J].Aquaculture,2008,280:140-145.
[15] ALY S M,AHMED Y A G,GHAREEB A A A,et al.Studies on Bacillus subtilis and Lactobacillus acidophilus,as potential probiotics,on the immune response and resistance of Tilapia nilotica (Oreochromis niloticus) to challenge infections[J].Fish Shellfish Immunol,2008,25:128-136.
[16] THANH TUNG H,KOSHIO S,ISHIKAWA M,et al.Effects of dietary heatkilled Lactobacillus plantarum on larval and postlarval kuruma shrimp, Marsupenaeus japonicus Bate[J].Journal of the World Aquaculture Socirty,2010,41(S1):16-26.
[17] 王國霞,黄燕华,黄文庆,等.乳酸菌对南美白对虾生长,饲料利用和体组成的影响[J].中国饲料,2010(12):24-32.
[18] 王国霞,黄燕华,周晔,等.乳酸菌对凡纳滨对虾生长性能、消化酶活性和非特异性免疫的影响[J].动物营养学报,2010,22(1):228-234.
[19] OLIVATELES A,GONQALVES P.Partial replacement of fishmeal by brewers yeast (Saccaromyces cerevisae) in diets for sea bass (Dicentrarchus labrax) juveniles[J].Aquaculture,2001,202(3/4):269-278.
[20] 王路平,吴垠,班红琴,等.微生态制剂对刺参幼参在封闭式循环养殖系统中的应用研究[J].中国微生态学杂志,2009,21(6):497-499.
[21] 周慧慧,马洪明,张文兵,等.仿刺参肠道潜在益生菌对刺参生长、免疫及抗病力的影响[J].水产学报,2010,34(6):955-963.
[22] 李明.混合益生菌对刺参生长、免疫、消化和肠道菌群的影响[D].大连:大连海洋大学,2014.
[23] SHEARER K D.Factors affecting the proximate composition of cultured fishes with emphasis on salmonids[J].Aquaculture,1994,119:63-88.
[24] 鲁琳,于志强,燕楠.资源化微生物添加剂对虹鳟鱼生长性能的影响[J].饲料研究,2007(3):3-5.
[25] 华雪铭,周洪淇,张宇峰.饲料中添加壳聚糖和益生菌对暗纹东方鲀幼鱼生长及部分消化酶活性的影响[J].水生生物学报,2005,29(3):299-304.
[26] 丁贤,李卓佳,陈永青,等.芽孢杆菌对凡纳对虾生长和消化酶活性的影响[J].中国水产科学,2004,11(6):580-584.
[27] PAN K C,YANG H B. Progress in study of mechanism of Bacillus[J].Feed Industry,1997,18(9):32-34.
[28] ZIAEINEJAD S,REZAEI M H,TAKAMI G A,et al.The effect of Bacillus spp.Bacteria used as probiotics on digestive enzyme activity,survival and growth in the Indian white shrimp Fenneropenaeus indicus[J].Aquaculture,2006,252(2/4):516-524.
[29] 王彦波,傅玲琳.益生菌对凡纳滨对虾生长性能和消化酶活性的影响[J].饲料工业,2010,31(20):12-14.
[30] 张艳婷.热灭活乳酸杆菌(HKLP)对刺参生长性能、消化酶活性、免疫力以及人工感染灿烂弧菌后免疫反应的影响[D].大连:大连海洋大学,2012.
[31] 张涛,白岚,李蕾,等.不同添加量的益生菌组合对仿刺参消化和免疫指标的影响[J].大连水产学院学报,2009(S1):64-68.
