感染维氏气单胞菌后齐口裂腹鱼主要器官组织的病理变化
2015-10-21谢光美贾丹叶华
谢光美 贾丹 叶华

摘要 [目的] 研究感染维氏气单胞菌后齐口裂腹鱼的组织病理变化。[方法] 用培养稀释的维氏气单胞菌菌液,经腹腔注射人工感染健康齐口裂腹鱼,通过病理切片和HE染色技术观察患病鱼的腮、肝、肾、脾、肠、头肾等器官的病理组织学变化。[结果] 染病鱼的腮、肝、脾、肾、肠和头肾均发生了明显的病理变化,其病理特征主要表现为不同程度的出血,组织细胞变性、坏死,某些细胞的细胞核固缩、碎裂或崩解,病变严重的区域组织细胞坏死崩解成一片无结构的物质。[结论] 维氏气单胞菌引起的病症使齐口裂腹鱼的免疫系统、呼吸系统、消化系统功能均减弱或丧失。
关键词 齐口裂腹鱼;维氏气单胞菌;组织病理变化
中图分类号 S941 文献标识码 A 文章编号 0517-6611(2015)20-117-05
Abstract [Objective] The research aimed to study the histopathological changes of Schizothorax prenanti infected with Aeromonas veronii. [Method] The healthy Schizothorax prenanti was artificially infected with diluted Aeromonas veronii by intraperitoneal injection. The hispathological changes of tissues (gill, liver, kidney, spleen, intestine and head kidney) of diseased S. prenanti were observed under microscope after hematoxylineosin staining. [Result] Aeromonas veronii infection caused obvious pathological changes in the gill, liver, spleen, kidney, intestine and head kidney of S. prenanti. The histopathological changes were characterized by hemorrhage at different degrees, vacuolar degeneration and necrosis. Some cells were changed by karyopyknosis, fragmentation or disintegration, and tissues disintegrated into an unstructured material in some regions damaged seriously. [Conclusion] The functions of the immune system, respiratory system and digestive system of S. prenanti infected with A. veronii were weakened or lost.
Key words Schizothorax prenanti; Aeromonas veronii; Histopathological changes
齐口裂腹鱼(Schizothorax prenanti),俗称齐口细鳞鱼、豹口、细甲鱼、雅鱼、洋鱼等,隶属鲤形目、鲤科、裂腹鱼亚科、裂腹鱼属、裂腹鱼亚属,主要分布于长江上游、金沙江、岷江、大渡河、青衣江、酉水和汉江任河的上游、乌江下游等水系[1]。该鱼肉质细嫩,味道鲜美,富含脂肪,为产区群众喜爱雅鱼佳肴,颇负盛名,是长江上游的重要经济鱼类。目前,齐口裂腹鱼的人工养殖前景良好,养殖过程中已发现有多种细菌性疾病和寄生虫感染[2-3] 。其中,细菌性疾病因其传播速度快、死亡率高、治愈难度大等特点而受到广大学者的关注。
维氏气单胞菌(Aeromonas veronii),又称凡隆气单胞菌、维罗纳气单胞菌,1983年美国疾病预防与控制中心为纪念法国微生物学家Veron在弧菌和气单胞菌研究中所作的贡献而命名,作为近年来发现并鉴定的一个新种气单胞菌,其研究才刚刚起步,但该菌普遍存在于淡水、污水、土壤乃至海水中,其中一部分菌株是微生态环境中正常存在的,而另一些菌株具有致病性,主要感染变温动物(如中华绒螯蟹、大鲵、罗非鱼、斑点叉尾鮰等[4-7]),可引起大量死亡。笔者对齐口裂腹鱼进行人工侵染维氏气单胞菌,以引发齐口裂腹鱼产生病症,进而对齐口裂腹鱼进行组织切片的显微观察,研究病鱼各组织器官的病理变化,以期为该病的深入研究和临床治療提供基础资料。
1 材料与方法
1.1 材料
1.1.1 试验鱼。
试验用齐口裂腹鱼购自重庆城口任河水产养殖公司,暂养于西南大学荣昌校区实训基地,选取15尾健康鱼用于试验,平均体长(18.2±0.3)cm,体重(86.4±1.5)g。用高锰酸浸泡鱼缸1 h,再用清水洗净,曝气1 d。将选取的齐口裂腹鱼放入缸中,进行试验前暂养,7 d后进行注射感染。暂养期间均按照常规饲养管理进行,每天按鱼体重的2%投喂饵料,并吸掉池底残渣,每天换水约1/3。
1.1.2 菌株。
菌株由西南大学鱼类繁育与健康养殖研究中心实验室从患病黄颡鱼体内分离到,于-80 ℃下保种。
1.2 方法
1.2.1 菌苗制备。① 用维氏气单胞菌(保存于-80 ℃)在LBAMP平板上划线并置于28 ℃培养箱中恒温培养24 h。②划线的平板上已长出单个的菌落,挑取4个维氏气单胞菌菌落于1.0 ml LBAMP液体培养基中(1.5 ml离心管)在28 ℃摇床摇菌至菌液混浊。
③取150 ml菌液涂布到无AMP的固体培养基平板并置于28 ℃培养箱恒温培养6 h。
④用生理盐水洗脱收集菌液,取200 ml收集的菌液,用生理盐水稀释10倍后测定OD值,采用麦氏比浊法[8]测定并计算细菌浓度。⑤用无菌生理盐水将菌液稀释成1×107CFU/ml,备用。
1.2.2 人工感染试验。
人工感染采用腹腔注射法,试验组注射1×107CFU/ ml维氏气单胞菌菌液,剂量0.2 ml/尾,每组5尾,并设置重复组1个,对照组注射生理盐水0.2 ml/尾。对照组和试验组分别饲养在不同的水箱中,试验期间不投食,使用增氧机持续增氧。连续观察其临床症状和病理组织取样。
1.2.3 鱼发病情况观察与取样。
感染后观察鱼的发病症状及死亡情况,并将感染后的濒死鱼和对照组的健康鱼分别取样,取材部位包括鳃、肝脏、脾脏、肾脏、头肾、肠道等组织。
1.2.4 病理组织切片的制备与观察。
将所取的样本放入Bouin氏液中固定24 h以上,经脱水、透明、浸蜡、包埋、切片、HE染色后,用中性树胶封片,在正置DPT2型OLMPUS显微镜拍摄系统下观察并进行显微拍照。
2 结果与分析
2.1 临床症状和解剖病理变化
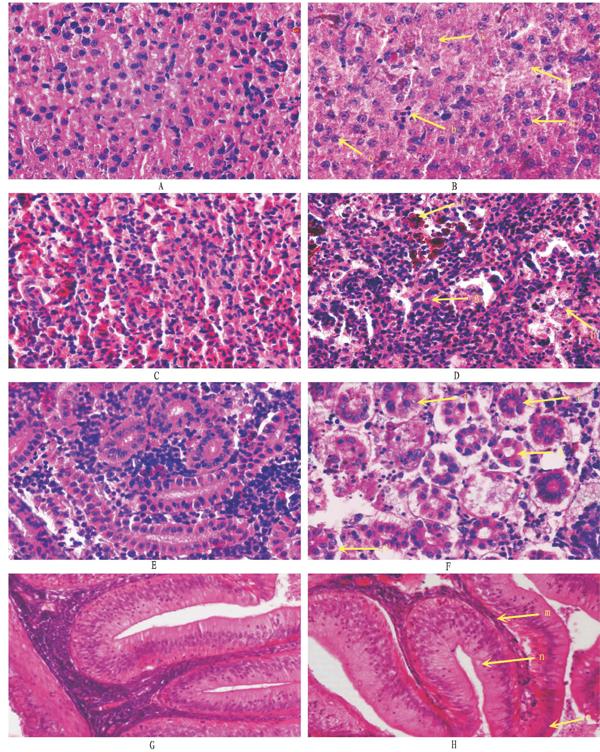
病鱼体色变暗,体表粘液分泌明显增多,于靠近水面处离群独游。随着病程的发展,病鱼躁动不安,快速游动,最后病发死亡。感染试验中齐口裂腹鱼出现的临床症状主要表现为:全身性充血,特别是头部、颐部、鳃盖、肛门、鳍条基部等处充血尤为严重,体表粘液增多。病鱼腮丝肿胀,粘液增多,颜色变淡。眼球轻微突起, 全身鳍条轻微柱鳍,腹部膨大,腹壁变薄,没有弹性,肛门充血红肿,略微外凸(图1A~F)。解剖后观察发现,腹腔内有大量淡黄色或带血的腹水,肾脏肿胀和轻微肠炎症状,肠管轻微臌气、扩张,肠黏膜轻微充血、微红,其他脏器无明显变化。充血症状出现的顺序为胸鳍鳍条基部首先出现红肿充血,接着头部、鳃盖、颐部、肛门相继出现充血症状。
2.2 病理组织学变化
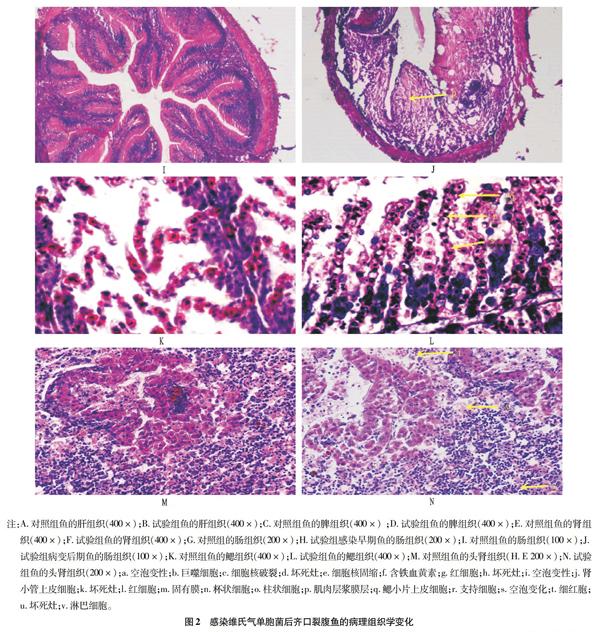
从图2可以看出,病鱼肝脏、脾脏、肾脏、头肾均出现细胞核固缩、破裂、溶解,细胞间空隙变大。①肝脏。健康齐口裂腹鱼的肝脏组织细胞分布均匀,排列整齐(图2A)。患病鱼肝组织发生了弥散病变,出现大片自溶性坏死,肝细胞排列紊乱、稀疏。细胞肿胀,胞浆结构松散,着色不均,呈明显的空泡变性(图2B)。②脾脏。健康齐口裂腹鱼的脾脏组织细胞排列紧密,轮廓清晰,细胞核核型规则,结构完整(图2C)。患病鱼脾脏织严重坏死,已看不清明显的红髓和白髓结构,细胞排列紊乱。严重病变时网状细胞、造血组织和结构性结缔组织大量坏死,崩解成一片粉红色无结构物质,仅留下少量变性、坏死的造血组织和网状细胞,形成坏死灶(图2D)。
③肾脏。健康齐口裂腹鱼肾脏细胞排列规则,肾小球和肾小管排列比较整齐有序,结构也比较清晰,肾间质充分填充于泌尿小管和肾内血管之间,分布均匀(图2E)。患病鱼肾脏结构出现崩解,肾小管排列紊乱,且大部分已变性坏死,肾小管上皮细胞脱离基底膜,胞浆呈红色团块状流失于管腔,出现空泡变性。已看不见完整的肾小球结构,广泛出血。肾脏间质组织结构模糊,大量间质细胞坏死,甚至消失(图2F)。
④肠。健康齐口裂腹鱼肠道组织粘膜皱襞多,柱状上皮细胞排列紧密,肌层平整,肠绒毛完整,排列整齐,肠外膜完整(图2G、I)。感染早期(人工感染13 h后),肠结构整齐,轮廓清晰,肠绒毛柱状上皮细胞与结缔组织轻微剥离,肠上皮、基底膜和粘膜下层有轻微出血,上皮杯状细胞增多(图2H)。病变后期(人工感染58 h后),肠上皮细胞坏死崩解,肠绒毛几乎完全脱落、肠外膜结构破损,肌层平滑肌不完整,肠腔中有大量红细胞(图2J)。⑤鳃。健康齐口裂腹鱼的鳃丝结构完整,鳃小片上皮细胞排列整齐,结构也比较清晰(图2K)。染病鱼的鳃小片变粗呈棒状,鳃小片上皮细胞、毛细血管、结缔组织和软骨膜等软组织都出现坏死崩解。鳃小片结构崩解,形成大量空泡(图2L)。⑥头肾。健康齐口裂腹鱼头肾细胞排列紧密,分布均匀而有规则,轮廓清晰,结构完整(图2M)。染病鱼的头肾细胞排列紊乱,广泛出血。头肾细胞成片、网状细胞、造血组织和结构性结缔组织坏死、崩解,形成大空泡(图2N)。
3 讨论
笔者对齐口裂腹鱼进行人工侵染维氏气单胞菌,结果发现感染维氏气单胞菌的齐口裂腹鱼主要临床表现为:全身性充血,各鳍鳍条基部、鳃盖、颐部、肛门等处充血尤为严重,腹部膨大,解剖观察可见腹部有腹水,肾脏肿胀和轻微肠炎症状;病理学观察发现,染病鱼的鳃、肝脏、脾脏、肾脏、头肾和肠道等器官组织出现不同程度的充血、出血、肿大、变性、坏死以及炎症细胞浸润等病理变化。维氏气单胞菌导致的齊口裂腹鱼组织病理变化与其感染斑点叉尾鮰及嗜水气单胞菌感染黄鳝(Monopterus albus)、香鱼(Plecoglossus altivelis)、剑尾鱼(Xiphophorus helleri)等多种鱼类的组织病理学变化相似[9-13]。
维氏气单胞菌侵入鱼体后,可产生一系列的毒力因子[14],对组织细胞造成损害,使其发生变性,引起机体防御反应,激发造血功能,使白细胞增多并从血管渗出,组织间炎性细胞浸润。产生的气溶素具有溶血性,其菌毛是重要的凝血因子,可促使细菌粘附在红细胞表面,在血管内形成微血栓,广泛的血管内凝血消耗了大量凝血因子和血栓细胞,使血液转变为低凝状态,同时由于血管损伤,红细胞渗出而产生出血现象,导致循环血流量减少。脾脏和肾脏是鱼类的主要造血器官,二者出现病变引起造血功能障碍,加重贫血症状。贫血造成缺氧,鳃部本身的病变造成气体交换障碍,加重了缺氧症状。缺氧导致全身各组织细胞物质代谢障碍,进而影响其结构和功能。停留在体表感染部位的病菌则在局部组织引起病变[14],从而出现体表充血、出血、发炎和溃疡等外观症状。
肠道是营养物质的消化与吸收的场所,感染早期,肠上皮、基底膜和粘膜下层有轻微出血,上皮杯状细胞增多,这些杯状细胞的主要功能是分泌粘蛋白,这些蛋白覆盖在粘膜表面不仅可以保护其不被细菌侵染,而且可以分泌溶菌酶起到杀菌作用[9]。病变后期,肠上皮细胞坏死崩解,肠绒毛几乎完全脱落,肠道的结构和功能彻底丧失。
笔者对齐口裂腹鱼的头肾进行了组织切片的显微观察,研究了病鱼头肾的病理变化,这在以前的组织病理学研究报道中极为鲜见。头肾是鱼类重要的免疫、造血器官,除成体弹涂鱼(Periophthalmus koelreueri)[15]等少数鱼类的头肾具有肾单位外,大多数硬骨鱼类头肾中无肾单位,其实质完全由网状淋巴组织组成,头肾中有动脉、静脉和丰富的血窦[16]。该试验中头肾是维氏气单胞菌攻击的主要靶器官之一,患病鱼头肾出现明显病变,部分淋巴组织结构变得不清晰,细胞坏死、崩解,细胞间隙变大,严重的区域完全解体而形成无细胞区,毛细血管壁破裂造成组织间红细胞浸润,血窦腔增大。染病鱼头肾病变导致机体特异性免疫功能下降,机体发生补偿性病理变化,从而病鱼头肾中出现大量的淋巴细胞、浆细胞,发生炎症反应。罗朝晖等[17]研究汞、铬离子对黄鳝头肾组织结构的影响也发现当重金属污染物毒性低、浓度较低、污染时间较短时,头肾组织中的淋巴细胞、粒细胞和黑色素巨噬细胞数量均显著增多,随着重金属离子浓度的增加和染毒时间的延长,淋巴组织逐渐松散,排列稀疏混乱,淋巴细胞界限逐渐不清晰,呈退化趋势,数量减少,红血细胞大量破坏,血窦扩张。由此可见,头肾是鱼类重要的免疫器官,当细菌和重金属等有害物质浸入时会发生相应的免疫机能,但有害物质会使其结构遭到破坏,导致其免疫功能下降甚至丧失。
4 小结
该验结果表明染病鱼的鳃、肝脏、脾脏、肾脏、头肾和肠道均发生了明显的病理变化,主要表现为不同程度的出血,组织细胞变性、坏死,某些细胞的细胞核固缩、碎裂或崩解,病变严重的区域组织细胞坏死崩解成一片无结构的物质,说明维氏气单胞菌引起的病症不仅使齐口裂腹鱼的免疫系统遭到破坏,也使其呼吸系统和消化系统的功能减弱或丧失。病鱼由于缺血、缺氧以及血液循环、呼吸、消化和排泄等机能不能正常进行,最终导致鱼体衰竭而死亡。这与鲤鱼(Cyprims carpis)、团头鲂(Megalobrama ambiycephala Yih)、欧洲鳗鲡(Anguilla anguilla)细菌性败血症发病过程相似[18-19]。
参考文献
[1] 丁瑞华.四川魚类志[M].成都:四川科学技术出版社,1994:370-371.
[2] 耿毅,汪开毓,吴麟,等.齐口裂腹鱼败血症的病原分离与鉴定[J].水利渔业,2004,24(4):71-73.
[3] 杜宗君,汪开毓,李志琼,等.齐口裂腹鱼疾病防治初报[J].中国水产,2003(1):82-83.
[4] 房海,陈翠珍,张晓君,等.中华绒螯蟹病原维氏气单胞菌的检验[J].中国人兽共患病学报,2008,24(1):45-49.
[5] 王旭,颜其贵,雷燕,等.中国大鲵腐皮病病原菌的分离与鉴定[J].中国人兽共患病学报,2010,26(10):944-948.
[6] 黎炯,叶星,卢迈新.罗非鱼维氏气单胞菌的分离鉴定和药敏试验[J].水生态学杂志,2011,32(3):132-136.
[7] 黄小丽.斑点叉尾鲴维氏气单胞菌病的诊断与防治[J].水产科技情报,2009(5):738-742.
[8] 沈萍,范秀容.微生物学实验[M].3版.北京:高等教育出版社, 1999:160-167.
[9] 黄小丽,吴春艳,邓永强,等.斑点叉尾鮰维氏气单胞菌病的病理组织学观察[J].中国兽医科学,2010,40(7):738-742.
[10] 何 智,任红梅,杨德英,等.嗜水气单胞菌源黄鳝出血病的组织病理学研究[J].淡水渔业,2010,40(4):56-61.
[12] 李明云,张呈念,苗 亮,等.香鱼嗜水气单胞菌染病后主要靶器官组织病理学观察[J].宁波大学学报,2011,25(3):1-4.
[13] 杜雄伟,常藕琴,王晓辉,等.嗜水气单胞菌对剑尾鱼的致病性及组织病理学研究[J].长江大学学报,2005,25(1):52-56.
[14] 吴同垒,单晓枫,孟庆峰,等.维氏气单胞菌研究进展[J].中国兽药杂志,2011,45(7):41-44.
[15] SAFER A M, TYTLER P, ELSYEDI N E. The structure of the head kidney in the mudskipper Periophthalmus koelreuleri(pallas) [J]. Journal of Morphology, 1982,174(1):121-131.
[16] 李霞.水产动物组织胚胎学[M].北京:中国农业出版社,2005:157-158.
[17] 罗朝晖,袁建军,黄周英,等.汞、铬离子对黄鳝头肾组织结构的影响[J].动物学杂志,2008,43(5):120-127.
[18] 汪开毓.鲤鱼细菌性败血症的病理学研究[J].四川农业大学学报,2004,22(3):257-262.
[19] 何利君,廖利坤,袁金凤,等.团头鲂细菌性败血症的病理学研究[J].西南农业大学学报,2006,28(3):483-485.
