赭曲霉毒素A无毒ELISA检测
2015-10-21裘雪梅朱立鑫刘敏等
裘雪梅 朱立鑫 刘敏等
摘要[目的]研究赭曲霉毒素A毒素的替代ELISA检测。[方法]采用噬菌体展示技术筛选赭曲霉毒素A模拟表位,得到赭曲霉毒素A(OTA)模拟表位序列为IR(V)PMV(L)XX (X为任意氨基酸),化学合成法体外合成OTA 模拟表位肽,通过化学交联法将OTA模拟表位肽与BSA连接,做成无毒抗原,建立无毒OTA 间接竞争ELISA检测方法,同样通过化学交联法将OTA多肽-BSA与HRP 相联,建立OTA无毒直接竞争ELISA检测方法。[结果]OTA多肽-BSA间接竞争ELISA检测50%抑制浓度(IC50)为5 ng/ml,OTA多肽-BSA-HRP一步直接竞争ELISA检测法IC50为2.5 ng/ml,二步直接竞争ELISA检测法IC50为2 ng/ml。[结论]OTA模拟表位多肽能用于代替OTA毒素作为检测抗原使用,并建立无毒ELISA检测方法。
关键词赭曲霉毒素A;模拟表位;ELISA检测
中图分类号S188文献标识码
A文章编号0517-6611(2015)31-035-03
Research of Ochratoxin A Nontoxic ELISA
QIU Xuemei, ZHU Lixin, LIU Min et al
(School of Life Science, Jiangxi Science & Technology Normal University, Nanchang, Jiangxi 330013)
Abstract [Objective] To research the ELISA detection based on Ochratoxin A(OTA)mimic epitope. [Method] Screening the OTA mimic epitope from random phage display peptide library, and chemical synthesis was used to get the OTA mimic epitope, then synthesize OTA poly peptideBSA and OTA poly peptideBSAHRP, establish the methods of indirect and indirect competive ELISA. [Result] The IC50 of OTA poly peptideBSA indirect competive ELISA is 5 ng/ml, the IC50 of OTA poly peptideBSAHRP one step direct competive ELISA is 2.5 ng/ml, the IC50 of OTA poly peptideBSAHRP two step direct competive ELISA is 2 ng/ml. [Conclusion] OTA poly peptide based on OTA mimic epitope can be used to replace OTA toxin, and can establish nontoxin ELISA.
Key words Ochratoxin A; Mimic epitope; ELISA detection
赭曲霉毒素A(Ochratoxin A,OTA)是曲霉属和青霉属的某些菌种产生的有毒次级代谢产物,易蓄积于组织中[1-2],属于烈性的肾脏和肝脏毒素[3-5]。OTA还具有强的致癌、致畸和致突变性[6-7]。产OTA毒素的菌株广泛存在于自然界中,在各种农作物、食品、饲料、人类及动物的组织和血液中均能检测到OTA的污染,对人类健康构成重大威胁[8-9]。
高效液相色谱法(HPLC)等理化分析检测方法可以精确地进行定性和定量分析[10-12],由于所需设备昂贵、操作复杂以及对样品纯度有较高的要求,导致检测成本高、周期长,无法满足大批量样本快速筛查的需要。酶联免疫吸附分析方法(ELISA)由于具有较高的灵敏度和特异性,对样品的纯度要求不高,且操作简单,特别适合大批量样本的检测,因而被广泛应用于OTA的快速检测[13]。
由于常规的ELISA分析方法是建立在以标记OTA或偶联OTA为竞争抗原基础上的有毒检测体系,为此,笔者在成功以噬菌体随机肽库展示技术筛选OTA的模拟表位的基础上[14-15],体外人工合成OTA模拟表位肽,以OTA模拟表位替代毒素标准品,建立无毒ELISA检测方法。
1材料与方法
1.1试剂与仪器
OTA单克隆抗体、兔二抗为江西科技师范大学食品安全检测实验室制备;赭曲霉毒素A(OTA)、匙眼贝血蓝蛋白(KLH)、牛血清白蛋白(bovine serum albumen BSA)、N[γ马来酰亚胺丁酰氧]琥珀酰亚胺酯(GMBS)、氮羟基琥珀酸(Nhydroxysuccinimide NHS)、ε氨基己酸、福氏完全佐剂、福氏不完全佐剂和羊抗小鼠酶标二抗、OTA标准品为Sigma产品,单克隆抗体分型试剂盒为圣克鲁斯生物技术(上海)有限公司产品,兔抗鼠IgG:HRP酶标二抗为经科宏达生物技术有限公司产品,3,3′,5,5′四甲基联苯胺(TMB)为上海生工产品,其余为国产分析纯。UV205紫外分光光度计,日本岛津;微量移液器,芬兰Labsystems公司;K185紫外透射反射仪、酶标仪,芬兰Labsystems公司。
1.2试验方法
1.2.1OTA模拟表位多肽的化学合成。根据OTA模拟表位多肽的氨基酸序列,采用化学合成法合成OTA模拟表位多肽。
1.2.2OTA 单克隆抗体的制备。OTA 单克隆抗体的制备采用细胞融合法,具体步骤为:第4次免疫间隔28 d后,尾静脉注射人工抗原0.05 mg/只,3 d后,取脾细胞在50% PEG融合剂作用下与对数期生长的SP2/O杂交瘤细胞融合。经HAT选择培養液培养7 d后,换HT培养基培养,取杂交瘤细胞培养上清进行阳性克隆筛选,以OTA 人工抗原为检测抗原,建立间接竞争ELISA方法,筛选分泌抗OTA单克隆抗体的杂交瘤细胞。阳性细胞经有限稀释法亚克隆 3次均为100%阳性后,建立细胞系并冻存。并将杂交瘤细胞接种于提前接种降植烷的BALB/c 小鼠腹腔,制备腹水,经辛酸-硫酸铵沉淀法纯化单抗。最后用单克隆抗体分型试剂盒进行分型鉴定。
1.2.3OTA多肽BSA的化学合成。
OTA多肽与BSA的连接采用多功能试剂GMBS进行。反应原理:将GMBS 与适量的BSA 在中性至碱性条件下使得GMBS的羰基与BSA分子侧链中的氨基发生反应,然后去除未反应的GMBS。
1.2.4OTA多肽BSA。利用“1.2.3”方法中合成的OTA多肽BSA,与HRP相联。
1.2.5OTA多肽BSA间接竞争ELISA检测方法的建立。
棋盘滴定确定最佳的包被抗原和抗体工作浓度:OTA多肽BSA为检测抗原,用PBS稀释至不同稀释度(1、2、4 μg/ml),4 ℃ 包被过夜,5%脱脂牛奶封闭后用PBST洗涤4次,加入PBS稀释的抗体(1∶1 600,1∶3 200,1∶6 400,1∶12 800,1∶25 600,1∶51 200,1∶102 400),取阴性血清作阴性对照,PBS作空白对照。每孔100 μl,37 ℃ 1 h后洗涤4次,加入兔抗鼠IgG:HRP酶标二抗(100 μl/孔);37 ℃作用1 h后,洗涤4次。3,3′,5,5′四甲基联苯胺(TMB)显色,2 mol/L H2SO4终止反应,测定450 nm波长吸光值(A值),根据A值选择最佳包被抗原的浓度,然后选择A值等于1.0~1.5抗体的稀释倍数作为工作浓度。
根据确定的最佳包被抗原和抗体工作浓度建立基于OTA模拟表位的无毒间接竞争ELISA的标准曲线:检测抗原(OTA多肽BSA)4 ℃ 包被过夜,35%脱脂牛奶封闭。加入50 μl溶于35%甲醇PBS的OTA(0,0.1,10,50,100,200,500,1000 ng/ml)和抗体50 μl,混匀。37 ℃ 1 h后,PBST洗涤4次,加入酶标二抗(100 μl/孔);37 ℃作用1 h后,洗涤4次。TMB显色,2 mol/L H2SO4终止反应,测A值,每个浓度测定4次,取平均值。计算各浓度的结合率,制作标准曲线。
1.2.6OTA多肽BSAHRP一步直接竞争ELISA检测法。
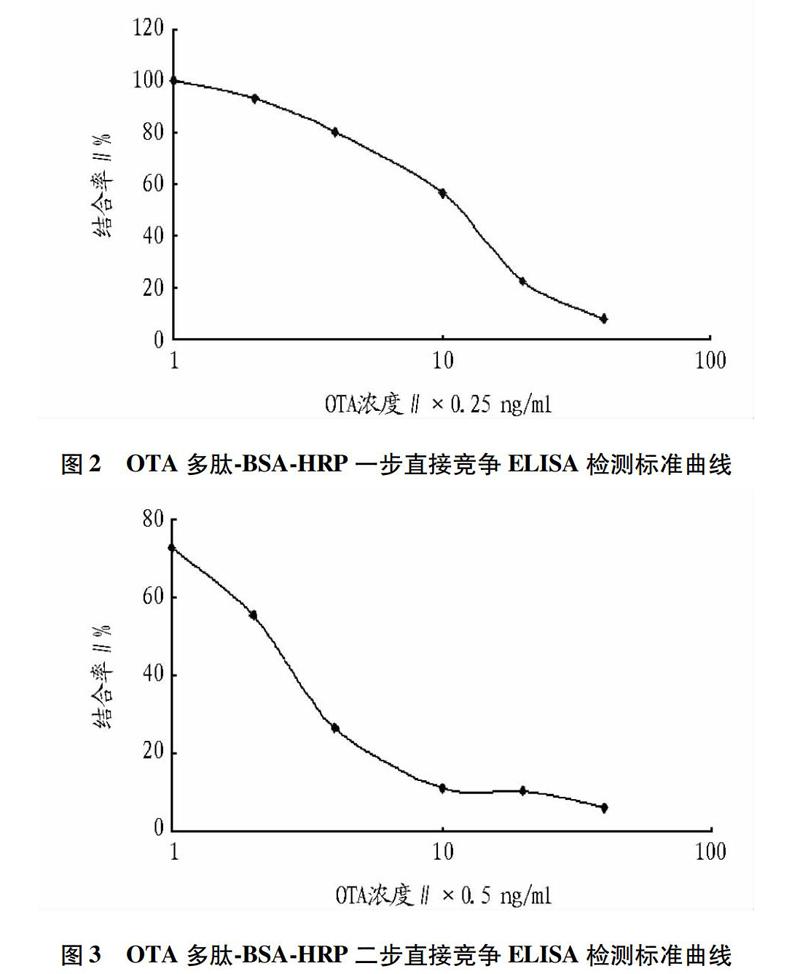
棋盘滴定确定最佳的包被抗原和抗体工作浓度:包被兔二抗20 μg/ml,4 ℃ 包被过夜,5%脱脂牛奶封闭后用PBST洗涤4次,加入PBS稀释的OTA多肽BSAHRP (1∶500,1∶1 000,1∶2 000,1∶4 000,1∶8 000,1∶16 000,1∶32 000)50ul,PBS稀释的OTA单克隆抗体(1∶1 000,1∶ 2 000,1∶4 000,1∶8 000,1∶16 000,1∶32 000,1∶64 000)50 μl,取阴性血清作阴性对照,PBS作空白对照,37 ℃ 0.5 h后洗涤4次,加入TMB显色10 min,2 mol/L H2SO4 50 μl终止反应,测定450 nm波长吸光值(A值),根据A值选择最佳包被抗原的浓度,然后选择A值等于1.0左右的抗体的稀释倍数作为工作浓度。
根据确定的最佳包被抗原和抗体工作浓度建立基于OTA模拟表位的一步法无毒直接竞争ELISA的标准曲线:包被兔二抗20 μg/ml,4 ℃ 包被过夜,5%脱脂牛奶封闭后用PBST洗涤4次,同时加入30 μl OTA 标准品(0,0.25,050,100,200,500,1000 ng/ml),30 μl OTA多肽BSAHRP,以及40 μl OTA 单克隆抗体,37 ℃ 0.5 h后洗涤4次,加入TMB显色10 min,2 mol/L H2SO4 50 μl终止反应,测定450 nm波长吸光值(A值),制作标准曲线。
1.2.7OTA多肽BSAHRP 二步直接竞争ELISA检测法。棋盘滴定确定最佳的包被抗原和抗体工作浓度,步骤参照“1.2.6”的方法。根据确定的最佳包被抗原和抗体工作浓度建立基于OTA模拟表位的二步法无毒直接竞争ELISA的标准曲线:包被兔二抗20 μg/ml,4 ℃ 包被过夜,5%脱脂牛奶封闭后用PBST洗涤4次,加入100 μl OTA 单克隆抗体,37 ℃ 0.5 h,PBST洗涤4次,加入50 μl OTA 标准品(0, 0.5,10,20,50,100,200 ng/ml),50 μl OTA多肽BSAHRP, 37 ℃ 0.5 h后PBST洗涤4次,加入TMB显色10 min,2 mol/L H2SO4 50 μl终止反应,测定450 nm波长吸光值(A值),制作标准曲线。
2结果与分析
2.1单克隆抗体的制备
经细胞融合,筛选到一株分泌抗OTA单克隆抗体的杂交瘤细胞株(8G4),经 3次亚克隆后,全部克隆为阳克隆。将上述细胞株连续培养及冻存后复苏,其分泌的抗体效价稳定不变。
2.2 OTA多肽BSA间接竞争ELISA检测标准曲线
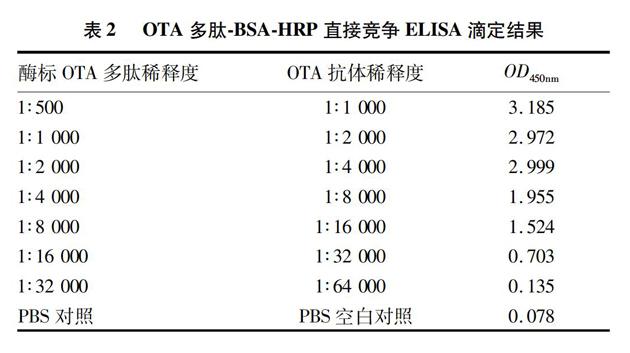
经棋盘滴定确定的最佳ELISA分析条件:包被抗原(OTA多肽BSA)浓度为2 μg/ml,抗体工作浓度为1∶102 400,酶标二抗工作浓度为1∶3 000,滴定结果见表1。OTA多肽BSA间接竞争ELISA检测标准曲线见图1,50%抑制浓度(IC50)为5 ng/ml。
2.3OTA多肽BSAHRP一步直接竞争ELISA检测标准曲线
经棋盘滴定确定的最佳ELISA分析条件:OTA抗体工作浓度为1∶16 000,OTA多肽BSAHRP工作浓度为1∶8 000,酶标二抗工作浓度为1∶3 000,结果见表2。OTA多肽BSAHRP一步直接竞争ELISA检测标准曲线见图2,50%抑制浓度(IC50)为2.5 ng/ml。
2.4OTA多肽BSAHRP二步直接競争ELISA检测标准曲线
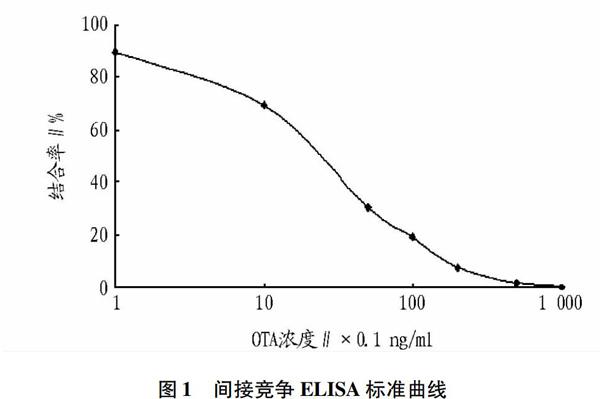
经棋盘滴定确定的最佳ELISA分析条件:OTA抗体工作浓度为1∶16 000,OTA多肽BSAHRP工作浓度为1∶8 000,酶标二抗工作浓度为1∶3 000。OTA多肽BSAHRP二步直接竞争ELISA检测标准曲线见图3,50%抑制浓度(IC50)为2 ng/ml。
3討论
通过研究OTA模拟表位多肽替代OTA毒素进行ELISA检测,获得体外合成OTA模拟表位多肽的ELISA检测的理论数据,与通过载体构建并表达OTA模拟表位多肽建立的OTA无毒ELISA检测法进行对比研究(通过分子生物学方法,应用PC89噬菌粒载体,将赭曲霉毒素A的模拟表位导入至M13噬菌体的主要衣壳蛋白pⅧ上,并引入了肠激酶切割位点,通过单克隆抗体结合及DNA测序验证,获得了在N末端高密度表达模拟表位的重组噬菌体;再以其为竞争抗原,建立了新的竞争酶联免疫吸附检测ELISA方法)[16-17],用以
研究基于OTA模拟表位的无毒ELISA检测方法的最佳方案,为安全、有效、快速检测食品及饲料中的OTA污染提供可靠依据,也为诸如黄曲霉毒素B1、黄曲霉毒素M1等真菌毒素的检测提供新的技术手段。
在进一步试验中,还将对每种方法进行评价,重点对OTA多肽BSAHRP一步法及二步法直接竞争ELISA
检测方法进行比对,就该试验而言,一步法时间短,IC50稍高,而两步法时间比一步法多0.5 h,但IC50比一步法低,同时这2种方法都具有灵敏、快速检测的特点。
43卷31期裘雪梅等赭曲霉毒素A无毒ELISA检测
参考文献
[1]
DOHNAL V,DVORAK V,MALIR,F et al.A comparison of ELISA and HPLC methods for determination of ochratoxin A in human blood serum in the Czech Republic[J].Food Chem Toxicol,2013,62:427-431.
[2] MEULENBERG E P.Immunochemical methods for ochratoxin A detection:A review[J].Toxins (Basel),2012,4(4):244-266.
[3] SOLFRIZZO M,GAMBACORTA L,LATTANZIO V M,et al.Simultaneous LC-MS/MS determination of aflatoxin M1,ochratoxin A,deoxynivalenol,de-epoxydeoxynivalenol,alpha and beta-zearalenols and fumonisin B1 in urine as a multi-biomarker method to assess exposure to mycotoxins[J].Anal Bioanal Chem,2011,401(9):2831-2841.
[4] WU J,TAN Y,WANG Y,et al.Occurrence of ochratoxin A in grain and manufactured food products in China detected by HPLC with fluorescence detection and confirmed by LC-ESI-MS/MS[J].Mycopathologia,2012,173(2/3):199-205.
[5] KAWAMURA O,SATO S,KAJLL H,et al. A sensitive enzyme-linked immunoassay of ochratoxin A based on monoclonal antibodies[J].Toxicon,1989 27:887-897.
[6] BALL W J,WANG Z,MALIK B,et al.Selection of peptidic mimics of digoxin from phage-displayed peptide libraries by anti-digoxin antibodies[J].J Mol Biol,2000,301:101-115.
[7] THIRUMALA K,MILLER J S,REDDY G,et al.Phage-displayed peptides that mimic aflatoxin B1 in serological reactivity[J].Journal of applied microbiology,2001,90:330-336.
[8] JAE H P,WON C P,YOO J K,et al.Development of an enzymelinked immunosorbent assayfor the organophosphorus insecticide cyanophos[J].Bull Korean Chem Soc,2002,23:605-610.
[9] HELMS B A,REULEN S W,NIJHUIS S,et al.High-affinity peptide-based collagen targeting using synthetic phage mimics:From phage display to dendrimer display[J].J Am Chem Soc,2009,26;131(33):683-685.
[10] YIP Y L,SMITH G,WARD R L.Comparison of phage pIII,pVIII and GST as carrier proteins for peptide immunisation in Balb/c mice[J].Immunol Let,2001,79(3):197-202.
[11] WEICHEL M,JAUSSI R,RHYNER C,et al.Display of E.coli alkaline phosphatase pIII or pVIII fusions on phagemid surfaces reveals monovalent decoration with active molecules[J].Open Biochem,2008;2:38-43.
[12] LIU R R,XU L,QIU X M,et al.An immunoassay for aflatoxin B1 using a recombinant phage as a non-toxic conjugate[J].Journal of food safety,2012,32(3):318-325.
[13] LIU R R,YU Z,HE Q H,et al.An immunoassay for ochratoxin A without the mycotoxin[J].Food Control,2007,18(7):872-877.
[14] HE Q H,XU Y H,HUANG Y H,et al.Phage-displayed peptides that mimic zearalenone and its application in immunoassay[J].Food chemistry,2011,126(3):1312-1315.
[15] LAI W H,FUNG D Y C,XU Y et al.Development of a colloidal gold strip for rapid detection of ochratoxin A with mimotope peptide[J].Food control,2009,20(9):791-795.
[16] 陳兴龙,徐玲,刘仁荣,等.丝状噬菌体pⅧ展示系统表达赭曲霉毒素A模拟表位应用研究[J].卫生研究,2012,44(5):814-818.
[17] 刘仁荣,徐玲,裘雪梅,等.基于赭曲霉毒素A模拟表位的无毒素ELISA方法[J].食品与机械,2010(6):47-50.
