慢性乙型肝炎患者抗病毒治疗过程中肝组织HBV cccDNA变化及与血清学指标的相关性
2015-10-21刘雪艳,商庆华,刘学恩等
·论 著·
慢性乙型肝炎患者抗病毒治疗过程中肝组织HBV cccDNA变化及与血清学指标的相关性
目的 观察慢性乙型肝炎(乙肝)患者在阿德福韦酯(ADV)抗病毒治疗过程中肝组织总的乙肝病毒核酸(HBV tDNA)、cccDNA含量变化及与血清 HBVDNA、HBsAg的相关性,探讨肝组织HBV tDNA和cccDNA含量改变在抗病毒治疗中的意义。方法 47例慢性乙肝患者口服ADV 10mg/d,每隔12周检测病毒学、血清学和生化学等指标。47例基线患者和24例治疗48周患者行肝组织活检及肝组织HBV tDNA和cccDNA检测。结果 47例慢性乙肝患者ADV治疗48周后,HBVDNA低于检查下限占36.2%(17/47);ALT和AST复常率分别为76.6%(36/47)和85.1%(40/47)。比较基线和48周均取肝活检的24例患者,48周时血清和肝组织中HBVDNA载量均较基线显著下降(P<0.01),血清HBVDNA下降值大于肝组织HBV tDNA和肝组织HBV cccDNA(分别为3.21lg拷贝/ml、1.02lg拷贝/细胞和0.76lg拷贝/细胞)。基线时,24例患者肝组织HBV tDNA、cccDNA与血清 HBVDNA和 HBsAg呈正相关(P<0.01);但治疗48周时,各指标间无相关性。结论 ADV治疗慢性乙肝患者可使其肝组织 HBV tDNA、cccDNA和血清 HBVDNA水平显著下降,但血清HBVDNA下降较肝组织 HBV tDNA、cccDNA更为显著。
慢性乙型肝炎;阿德福韦酯;乙型肝炎病毒共价闭合环状DNA(HBV cccDNA);荧光定量
资料和方法
一、研究对象
入组病例为2010至2012年解放军第八八医院就诊的慢性乙肝患者47例,男性33例,女性14例,年龄20~65岁,平均年龄(35.7±12.4)岁。其中HBeAgg阳性37例,HBeAgg阴性10例,治疗基线各项临床指标特点见表1。纳入和排除标准:入组病例均符合《慢性乙型肝炎防治指南(2010年版)》建议的治疗指征,所有患者在ADV规范治疗前半年内未接受过抗病毒治疗;排除合并失代偿性肝硬化、自身免疫性肝病、药物性肝病、代谢性肝病、酒精性肝炎及其他原因所致的肝损伤。所有患者给予ADV 10mg/d口服治疗,随访观察48周。每隔12周取血,检测HBV 血清学标志物、HBVDNA和肝功能等指标。基线和治疗48周时分别有47例和24例患者行肝穿刺活检。
二、血清学相关指标检测
采用科华试剂经酶联免疫法进行HBV血清学标志物定性检测;采用Abbott I2000(美国雅培公司)化学发光法定量检测血清HBsAg;采用Abbottm2000全自动核酸检测系统荧光定量PCR法检测血清HBVDNA(根据雅培试剂说明书:1IU/mL=3.41拷贝/mL);采用Abbott Aeroset全自动生化仪检测血清ALT、AST等。
三、肝组织相关指标检测
采用荧 光定量 PCR 法[8]检测肝 组 织 中 HBV cccDNA和tDNA。肝组织炎症活动度及纤维化程度分为0~4级(G)和0~4期 (S),病理学诊断结果由本院病理科出具报告。
四、耐药位点检测
据赵澄宇等[9]报道的巢式PCR方法扩增基线患者血清HBVRT区(若出现耐药位点,扩增相应基线肝组织 HBV cccDNA RT区),送至北京英潍捷基生物科技有限公司进行双向测序,采用ContigExpress、BioEdit5.0和DNAStar4.0以及http://www.hivgrade.de/cms/grade/hbv-tool.html中的生物信息学工具分析测序结果。
五、统计学处理
采用SPSS16.0软件进行统计分析。对非正态分布数据对数转化后进行统计学分析。计量资料的比较采用t检验;计数资料的比较采用卡方检验;肝组织炎症分级、纤维化程度的比较采用非参数检验,P<0.05为差异有统计学意义。

表1 47例慢性乙肝患者的临床特点
结果
一、ADV治疗48周时HBVDNA和HBeAg阴转率、ALT和AST复常率
47例慢性乙肝患者经ADV 治疗48周时,HBVDNA<103拷贝/mL者为36.2%(17/47),ALT复常率为76.6%(36/47),AST复常率为85.1%(40/47)。37例HBeAgg阳性患者HBeAgg阴转率为13.5%(5/37),HBeAg/抗-HBe血清转换率为0。
二、慢性乙肝患者肝组织和血清学指标在治疗48周时变化情况
基线时,47例慢性乙肝患者肝组织HBV tDNA中位数是374.20拷贝/细胞,均值为(2.31±0.83)lg拷贝/细胞;HBV cccDNA中位数是3.31拷贝/细胞,均值为(0.41±0.65)lg拷贝/细胞。血清HBsAg均值为(4.12±0.76)lgIU/mL;HBVDNA均值为(7.93±1.65)lg拷贝/mL。HBeAgg阳性慢性乙肝患者肝组织HBV tDNA和cccDNA中位数均高于HBeAg阴性患者(462.49比35.42拷贝/细胞,P=0.005;3.31比0.53拷贝/细胞,P=0.011)。治疗48周时,有24例患者行肝活检检查,其肝组织和血清学指标的变化情况见表2。24例患者血清和肝组织中病毒载量在48周时均较基线显著下降(P<0.01),血清HBVDNA下降值>肝组织HBV tDNA>肝组织HBV cccDNA(3.21lg拷贝/mL>1.02lg拷贝/细胞>0.76lg拷贝/细胞)。
三、基线时肝组织HBV tDNA和ccc DNA水平与血清HBVDNA、HBsAg的相关性
基线时,47例慢性乙肝患者肝组织HBV cccDNA与肝组织HBV tDNA呈显著正相关(r=0.655,P<0.001,见图1A)。肝组织HBV cccDNA与血清HBVDNA及HBsAg呈正相关(r=0.466,P=0.001;r=0.540,P<0.01,见图1B、1C)。肝组织HBV tDNA与血清HBVDNA及HBsAg呈正相关(r=0.528,P<0.01;r=0.495,P=0.003)。血清HBsAg与HBVDNA呈显著正相关(r=0.681,P<0.01)。在基线和48周时均取肝活检的24例患者,肝组织HBV cccDNA与肝组织HBV tDNA及血清HBsAg呈正相关(r=0.497,P=0.013;r=0.422,P=0.040),与血清HBVDNA无相关性(r=0.225,P=0.291)。
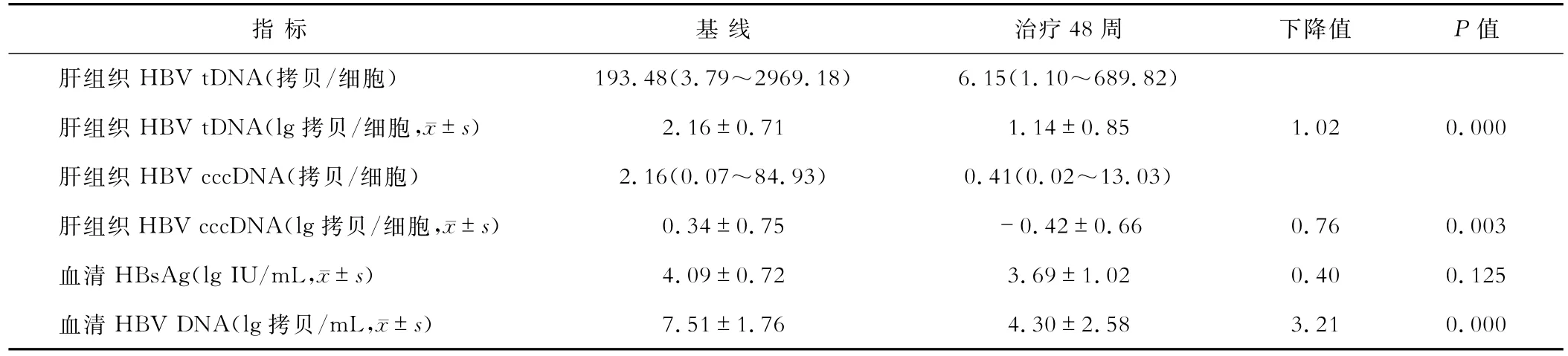
表2 24例慢性乙肝患者基线和治疗48周时肝组织和血清学指标变化
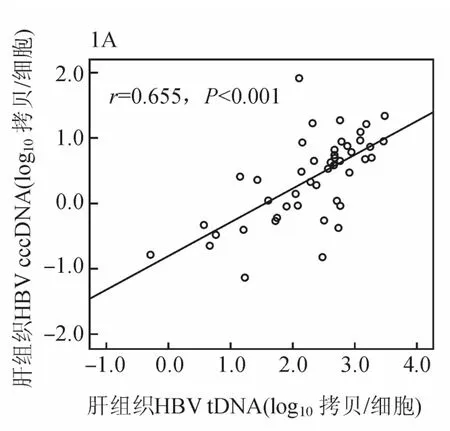
图1A 治疗基线时慢性乙肝患者肝组织HBV cccDNA与HBV tDNA的相关性分析(47例)
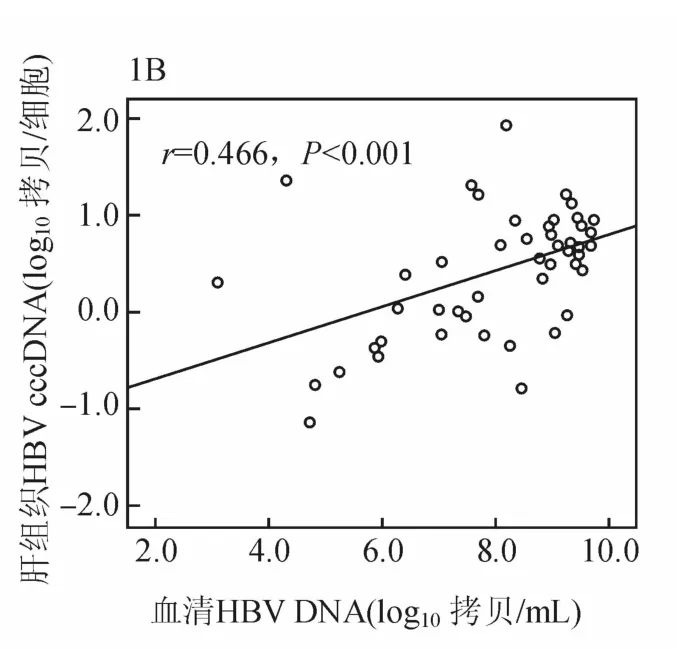
图1B 治疗基线慢性乙肝患者肝组织 HBV cccDNA与血清 HBVDNA的相关性分析(47例)
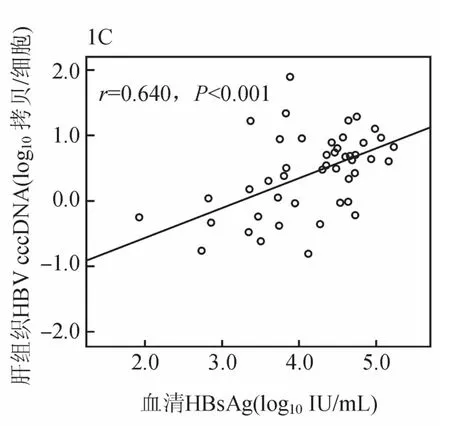
图1C 治疗基线时慢性乙肝患者肝组织 HBV cccDNA与血清HBsAg的相关性分析(47例)
四、ADV治疗48周肝组织HBV tDNA和cccDNA与血清HBVDNA、HBsAg的相关性
ADV治疗48周时,取肝活检的24例患者肝组织HBV cccDNA与HBV tDNA呈正相关(r=0.620,P<0.01,见图2A)。肝组织HBV cccDNA 与血清HBVDNA及HBsAg均无相关性(r=0.351,P=0.092;r=0.168,P=0.433)。肝组织HBV tDNA与血清HBVDNA及HBsAg均无相关性(r=0.353,P=0.090;r=0.299,P=0.156)。血清HBVDNA与HBsAg呈显著正相关(r=0.583,P<0.01,47例)。
五、ADV治疗48周时肝组织HBV tDNA和cccDNA下降值及与血清HBVDNA、HBsAg下降值的相关性
ADV治疗48周时,24例慢性乙肝患者肝组织HBV cccDNA下降值与HBV tDNA下降值无相关性(r=0.387,P=0.062)。肝组织HBV cccDNA下降值与血清HBVDNA及HBsAg下降值均无相关性(r=0.273,P=0.197;r=0.182,P=0.395)。肝组织HBV tDNA下降值与血清HBVDNA及HBsAg下降值均无相关性(r=0.286,P=0.175;r=-0.037,P=0.865)。24例患者血清HBVDNA下降值与HBsAg下降值未见相关性(r=0.063,P=0.770),但47例血清HBVDNA下降值与HBsAg下降值呈正相关(r=0.440,P=0.002),分析结果不一致可能与例数不同有关。
六、ADV治疗48周时肝组织学炎症及纤维化分级的变化
24例慢性乙肝患者ADV治疗48周时肝穿刺病理诊断,肝组织学炎症和纤维化程度较治疗前改善,炎症改善率为45.83%(11/24);纤维化改善率为29.17%(7/24)。经秩和检验(Mann-Whitney UTest),肝组织炎症程度(G)较治疗前显著改善(Z=-2.865,P=0.004),肝组织纤维化程度(S)改善不显著(Z=-0.255,P=0.799)。
七、基线耐药检测
47例慢性乙肝患者基线时检测耐药位点,2例患者血清HBVDNART区分别检出LAM相关耐药位点M204I和恩替卡韦(ETV)耐药位点L180M+M204V+S202G,相应肝组织HBVcccDNA中也检出相同耐药位点(M204I和L180M+M204V+S202G)。其中,基线LAM耐药患者ADV治疗12周时血清HBeAgg转阴,36周时HBVDNA降至检测下限(3lg拷贝/mL),之后HBVDNA载量维持在较低水平(<4lg拷贝/mL);基线ETV耐药患者ADV初始治疗病毒学应答良好,治疗12~48周时HBVDNA较基线下降>4lg拷贝/mL,60周出现病毒学突破,经核实,患者这段时间服药依从性欠佳,继续治疗,患者依从性良好,HBVDNA逐渐下降,治疗84周时<3lg拷贝/mL,之后维持在较低水平(<4lg拷贝/mL)。

图2A 治疗48周时慢性乙肝患者肝组织HBV cccDNA和tDNA的相关性分析(24例)
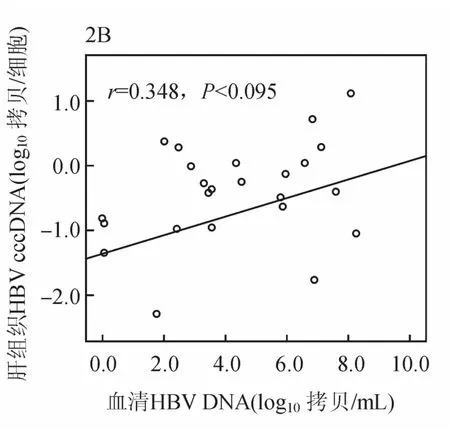
图2B 治疗48周时慢性乙肝患者肝组织HBV cccDNA与血清 HBVDNA的相关性分析(24例)
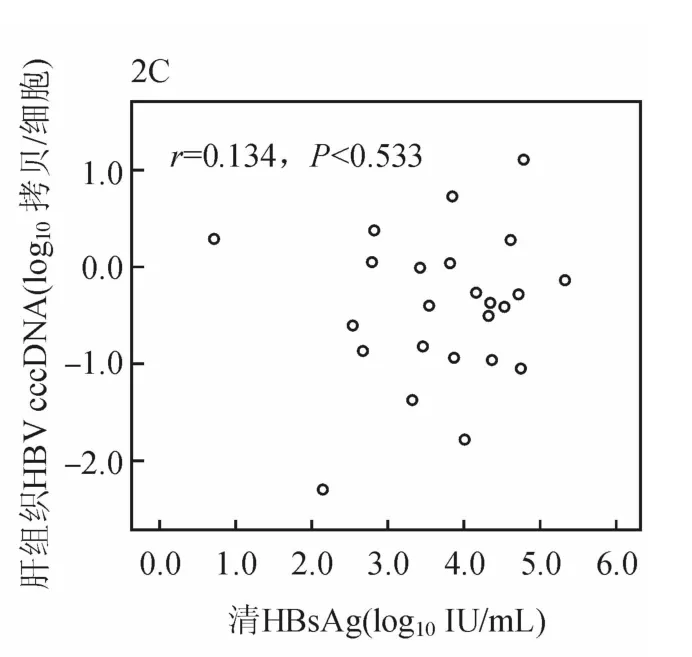
图2C 治疗48周时慢性乙肝患者肝组织 HBV cccDNA与血清HBsAg的相关性分析(24例)
讨论
抗病毒是治疗慢性乙肝的关键。与干扰素相比,ADV用药方便且不良反应相对较少;与LAM相比,ADV治疗耐药突变率较低;与ETV相比,ADV虽抗病毒力较低,但价格较便宜,因此,在我国基层医院对慢性乙肝患者进行抗病毒治疗时,ADV仍广泛应用。
ADV抗病毒疗效已得到大规模临床试验证实,可使患者获得病毒学、肝功能和组织学的改善,且耐药率较低。Marcellin等[10]研究显示,口服10mg/dADV治疗172例HBeAgg阳性慢性乙肝患者,48周后HBVDNA检测不到率为21%,ALT复常率为48%,HBeAg阴转率为24%,HBeAg血清学转换率为12%。茅益民等[11]开展的一项多中心、随机双盲临床试验表明,ADV治疗120例HBeAg阳性慢性乙肝患者有效且安全,治疗48周时,HBVDNA阴转率为34.2%,ALT复常率为75.3%,HBeAg阴转率和血清学转换率分别为6.42%和4.55%。本研究48周随访结果与以上文献报道相似。47例慢性乙肝患者ADV治疗48周后,HBVDNA阴转率为36.2%(17/47),ALT复常率为76.6%(36/47),AST复常率为85.1%(40/47),37例HBeAg阳性患者血清HBeAg阴转率为13.5%(5/37),但未观察到 HBeAgg血清学转换,可能与研究例数相对较少及治疗期限短有关。
在本研究中,ADV治疗48周后,血清HBVDNA已降到检测限以下的患者,肝组织内仍能检测到HBV cccDNA;治疗48周肝组织HBV cccDNA仅下降0.76lg拷贝/细胞,远低于血清 HBVDNA下降幅度(3.21lg拷贝/mL)。Werle-Lapostolle等[12]定量检测22例 ADV治疗的慢性乙肝患者肝组织HBV cccDNA,发现ADV治疗48周后,HBV cccDNA平均下降0.8og拷贝/细胞,但发生 HBsAg清除及HBeAgg阴转的患者肝组织仍检测到HBV ccc DNA。可见抗病毒治疗时,降低肝细胞内HBV ccc DNA水平是相当缓慢的过程,即使患者血清 HBeAgg转阴,HBVDNA降到检测限以下,肝组织内仍存在HBV cccDNA,停药后很可能会造成病毒反弹,导致抗病毒治疗失败等一系列问题。一些研究探讨将肝组织HBV ccc DNA水平动态监测作为判断抗病毒治疗疗效及停药的指标,Wursthorn等[13]检测26例HBsAg阳性慢性乙肝患者肝组织HBV cccDNA 含量,经ADV联合干扰素治疗48周后,5例血清HBVDNA降至检测限以下的患者,其肝组织仍检测到HBV cccDNA;5例发生HBsAg血清学转换的患者,仍有3例肝组织中检出HBV cccDNA;8例患者发生HBeAgg阴转,肝组织仍检出HBV cccDNA。Sung等[14]随访观察了47例拉米夫定单一或联合聚乙二醇干扰素治疗1年的HBeAgg阳性慢性乙肝患者,在治疗结束时及结束后52周测定血清HBVDNA及肝组织HBV cccDNA,29例在治疗结束时有病毒学应答,其中15例在治疗结束后52周仍有持续应答反应,但患者肝组织中均存在HBV cccDNA,持续应答患者肝组织内HBV cccDNA水平显著低于未取得持续应答患者。提示肝组织cccDNA定量检测能更好地预测持续病毒学应答。同时提示,对于HBV cccDNA水平未显著下降患者,延长治疗以避免停药复发,有利于取得抗病毒治疗的持久疗效。
在临床实践中,实施肝组织HBV cccDNA定量检测,需要患者进行肝穿刺活检,因此,HBV cccDNA定量检测不易作为常规检测项目。寻找与肝组织HBV cccDNA水平变化密切相关的血清学指标成为我们进一步探讨的目的。在本研究中,慢性乙肝患者治疗基线时肝组织HBV cccDNA 和tDNA 与血清HBVDNA、HBsAg显著相关,但ADV治疗48周后,肝组织HBV cccDNA和tDNA与血清HBVDNA及HBsAg均无相关性。Wursthorn 等[13]研究报道,26例慢性乙 患者基线时肝组织HBV ccc DNA与HBsAg显著相关(P=0.006),ADV联合干扰素治疗48周后,肝组织 HBV cccDNA与HBsAg无相关性(P=0.600),与我们的研究结果一致。本研究还统计分析了24例患者从治疗基线到48周时肝组织HBV cccDNA、tDNA和血清HBVDNA、HBsAg水平下降情况,相关性分析显示,肝组织HBV cccDNA下降值与血清HBVDNA及HBsAg下降值均无相关性(r=-0.258,P=0.223;r=0.199,P=0.352)。HBV cccDNA下降程度与HBsAg下降程度无相关性,与Wong等[15]报道的ADV治疗1年观察结果一致。Chan等[16]研究26例 HBeAgg阳性慢性乙肝患者抗病毒治疗基线和2年时肝内cccDNA和 HBsAg关系,治疗前肝内HBV cccDNA与血清HBsAg有明显相关性(r=0.54,P=0.004),治疗后肝内HBV cccDNA下降水平与 HBsAg下降水平明显相关(r=0.68,P<0.001),但在治疗2年时,HBV cccDNA和HBsAg水平的相关性差异无统计学意义(P>0.05);本研究结果与该报道差异之处可能与治疗疗程不同有关。以往研究例数均较少,有关HBV cccDNA与血清HBsAg相关性的研究需要扩大样本量,尤其是增加抗病毒治疗前后均取肝活检的病例数,因此,血清HBsAg定量检测是否可作为反映肝内cccDNA水平的指标,有待进一步研究证实。
综上所述,ADV抗病毒治疗可有效抑制HBV复制,改善肝功能及肝脏炎症活动程度,并逆转肝纤维化的形成,降低生化学、血清学和病毒学指标以及肝组织HBV tDNA、HBV cccDNA水平。在ADV抗病毒治疗中,生化学、血清学和病毒学指标结合肝组织炎症和纤维化程度变化以及肝组织HBVDNA、HBV cccDNA水平变化,能更加完善地评价抗病毒疗效,为选择合适的停药时机提供综合依据,从而使更多患者取得持续病毒学应答,减少治疗后复发。在抗病毒治疗中,有关肝组织HBV tDNA 和cccDNA水平变化与血清HBVDNA和HBsAg等指标的相关性以及血清学指标替代肝组织指标的可能性,需要扩大观察患者例数并延长治疗随访时间继续研究和探讨。
1 Lee WM.Hepatitis B virus infection.N Engl J Med,1997,337:1733-1745.
2 庄辉,李杰.慢性乙型肝炎防治指南(2010年版)解读:乙型肝炎流行病学及预防.中国病毒病杂志,2011,1:325-328.
3 Chang TT,Gish RG,Man RA,et al.A comparison of entecavir and lamivudine for HBeAg-positive chronic hepatitis B.N Engl J Med,2006,354:1001-1010.
4 Zeng M,Mao Y,Yao G,et al.A double-blind randomized trial of adefovir dipivoxil in Chinese subjects with HBeAg-positive chronic hepatitis B.Hepatology,2006,44:108-116.
5 Lampertico P,Vigano M,Manenti E,et al.Low resistance to adefovir combined with lamivudine:a 3-year-study of 145 lamivudine-resistant hepatitis B patients.Gastroenterology,2007,133:1445-1451.
6 Abdelhamed AM,Kelley CM,Miller TG,et al.Rebound of hepatitis B virus replication in Hep G2 cells after cessation of antiviral treatment.J Virol,2002,76:8148-8160.
7 Bourne EJ,Dienstag JL,Lopez VA,et al.Quantitative analysis of HBV cccDNA from clinical specimens:correlation with clinical and virological response during antiviral therapy,J Viral Hepat,2007,14:55-63.
8 王美容,邱宁,卢实春,等.肝组织HBV cccDNA荧光定量PCR检测方法的建立.中华流行病学杂志,2011,32:504-509.
9 赵澄宇,丁海,闫春辉,等.Rt H55可能是一个与C基因型 HBV rt M204I/V耐药突变相关联的新突变位点.中国病毒病杂志,2012,2:260-266.
10 Marcellin P,Chang TT,Lim SG,et al.Long-term efficacy and safety of adefovir dipivoxil for the treatment of hepatitis B e antigen-positive chronic hepatitis B.Hepatology,2008,48:750-758.
11 茅益民,曾民德,魏来,等.国产阿德福韦酯治疗HBeAgg阳性慢性乙型肝炎患者48周的多中心、随机、双盲、安慰剂平行对照临床研究.肝脏,2007,12:355-359.
12 Werle-Lapostolle B,Bowden S,Locarnini S,et al.Persistence of cccDNA during the natural history of chronic hepatitis B and decline during adefovir dipivoxil therapy.Gastroenterology,2004,126:1750-1758.
13 Wursthorn K,Lutgehetmann M,Dandri M,et al.Peginterferon alpha-2b plus adefovir induce strong cccDNA decline and HBsAg reduction in patients with chronic hepatitis B.Hepatology,2006,44:675-684.
14 Sung JJ,Wong ML,Bowden S,et al.Intrahepatic hepatitis B virus covalently closed circular DNA can be a predictor of sustained response to therapy.Gastroenterology,2005,128:1890-1897.
15 Wong DK,Seto WK,Fung J,et al.Reduction of hepatitis B surface antigen and covalently closed circular DNA by nucleos(t)ide analogues of different potency.Clin Gastroenterol Hepatol,2013,11:1004-1010.
16 Chan HL,Wong VW,Tse AM,et al.Serum hepatitis B surface antigen quantitation can reflect hepatitis B virus in the liver and predict treatment response.Clin Gastroenterol Hepatol,2007,5:1462-1468.
(本文编辑:钱燕)
PCR Relationship between the serum HBVDNA and the change of the intrahepatic HBV cccDNA levels in antiviral therapy for chronic hepatitis B
LIU Xue-yan,SHANG Qing-hua,LIU Xue-en,ZHUANG Hui.Fujian Cosunter Pharmaceutical Co.,Ltd.,Fuzhou 350003,China
Objective To investigate the correlations between the The serum HBVDNA and the intrahepatic HBV tDNA and cccDNA levels were decreased significantly after 48 weeks intrahepatic HBV tDNA,cccDNA and serum HBVDNA,HBsAg levels in patients with chronic hepatitis B treated with adefovir dipivoxil(ADV).The association between the antiviral response and the changed levels of the intrahepatic HBV tDNA and cccDNA was explored.Methods Forty seven patients with chronic hepatitis B were treated with ADV 10 mg/d.The virological,serological and biochemical parameters were measured every 12 weeks during treatment.Liver biopsies were performed in 47 patients at baseline and 24 patients at 48 weeks.The intrahepatic HBV tDNA and cccDNA levels were quantitated by real-time PCR.Results The sero-negative rate of HBVDNA was 36.2% (17/47),and normalization rates of ALT and AST levels were 76.6%(36/47)and 85.1% (40/47)in 47 patients treated with ADV for 48 weeks.The serum HBVDNA and the intrahepatic HBV tDNA and cccDNA levels were decreased significantly after 48 weeks therapy in 24 patients performed liver biopsies at baseline and 48 weeks.The decreased values of serum HBVDNA,the intrahepatic HBV tDNA and cccDNA were 3.21 log copies/mL,1.02 log copies/cell and 0.76 log copies/cell,respectively(P<0.01).At baseline,the intrahepatic HBV tDNA and cccDNA levels were positively correlated with serum HBVDNA and HBsAg.However,the correlations were not observed after 48 weeks treatment.Conclusion The intrahepatic HBV tDNA、cccDNA and serum HBVDNA levels were decreased significantly after 48 weeks ADV therapy.The correlations between the intrahepatic HBV tDNA,cccDNA and serum HBVDNA,HBsAg levels were observed at baseline but not at 48weeks,suggesting serum HBVDNA and HBsAg could not be the alternative for HBV tDNA and cccDNA.
Chronic hepatitis B;Adefovir dipivoxil;Hepatitis B virus covalently closed circular DNA;Real-time PCR
国家“十二五”传染病重大专项(2013ZX10002004,2012ZX10002003)
350003福州福建广生堂药业股份有限公司(刘雪艳);山东解放军第八八医院肝病中心(商庆华);北京大学医学部基础医学院病原生物学系和感染病中心(刘学恩,庄辉)
HBV感染是严重的全球性健康问题之一,目前全球约20亿人感染过HBV,其中约3.5亿为HBV慢性感染,每年约100万人死于乙型肝炎(乙肝)相关终末期肝病、肝硬化或肝癌[1]。我国是HBV感染高发区,2006年全国乙肝血清流行病学调查表明,HBsAg阳性携带者约7.18%[2],其中25%发展为慢性乙肝。符合治疗指征的慢性乙肝患者将接受核苷(酸)类似物和干扰素等抗病毒药物治疗,这些药物能够有效抑制病毒复制,降低外周血乙肝病毒载量[3],减少慢性乙肝患者终末期肝病、肝硬化和肝癌的发生。阿德福韦酯(ADV)是我国目前临床上常用的四种核苷类抗病毒药物之一,国内外大量研究显示ADV可显著改善慢性乙肝患者的生化学、病毒学、血清学、组织学指标,且长期用药耐药率较低[4]。同时,ADV对病毒野生株及拉米夫定(LAM)耐药株、前C区变异株等各种HBV毒株感染均有效[5]。
HBV复制过程中形成的共价闭合环状DNA(HBV cccDNA)是慢性乙肝患者抗病毒治疗时产生耐药和停药后反跳的重要原因[6]。Bourne等[7]报道肝组织中HBV cccDNA水平与抗病毒治疗的疗效和持续应答有关,提出肝组织中HBV ccc DNA定量检测对临床抗病毒疗效的监测和治疗方案的调整等具有重要意义。本研究采用实时荧光定量PCR(RTPCR)对ADV治疗前、后慢性乙肝患者肝组织HBV cccDNA进行定量检测,研究其与血清HBVDNA、HBsAg等在治疗随访中的变化和相互关系,旨在探讨肝组织HBV cccDNA含量的改变在抗病毒治疗中的指导意义以及血清学指标代替肝组织指标的可能性。
2015-06-15)
刘雪艳 商庆华 刘学恩 庄辉
