黑素皮质素2型受体相关研究进展
2015-10-20陈凯谢骏梁利国习丙文
陈凯 谢骏 梁利国 习丙文

摘要:黑素皮质素受体是一种G蛋白偶联受体,它在下丘脑一垂体一肾上腺皮质轴调控的应激应答中扮演着重要角色。MC2R本身由1条多肽链构成,具有7个跨膜的α螺旋,其相应配体促肾上腺皮质激素(ACTH)是唯一能激活MC2R的内源性物质,与此同时,MC2R对辅助蛋白(MRAP)具有严格的依赖性,只有MRAP存在的情况下,才能实现MC2R的功能表达,前人对其结构、功能和进化开展了大量研究。本研究就MC2R及其配体(ACTH)、辅助蛋白(MRAP)以及这一受体在鱼类应激方面的研究进行了简要概述,为渔业生产中的应激防控提供理论依据。
关键词:黑素皮质素受体一2(MC2R);促肾上腺皮质激素(ACTH);辅助蛋白(MRAP);应激调控
中图分类号:S942 文献标志码:A 文章编号:1002-1302(2015)05-0016-05
黑素皮质素2型受体(melanoeortin-2 receptor,MC2R)属于G蛋白偶联受体的一个亚家族,具有7个跨膜的α螺旋,由1条多肽链构成,包括3个胞内环、3个胞外环以及短的氨基末端和羧基末端,其中氨基末端区域是已知G蛋白偶联受体家族中最短的。通过对鸟类以及四足类等大量动物MC2R的氨基酸序列比对发现,第一胞内环、第二胞内环、第二跨膜区、第三跨膜区以及第七跨膜区表现出高度的保守性。这一保守性在关于MC2R的研究中被证实参与到配体结合位点的构成。
早期,Schwyzer等对包括人类在内的哺乳动物黑素皮质素2型受体及其配体促肾上腺皮质激素(adrenoeortieotropiehormone,ACTH)的结构与功能进行了大量研究。后来陆续出现非哺乳类动物MC2R相关研究,先后在鸟类、四足类动物(包括爬行类和两栖类)、硬骨鱼类以及软骨鱼类中发现了MC2R基因,上述研究成果为MC2R基因在进化方面的研究提供了丰富的研究材料。同时也有报道表明,MC2R在药理特性方面表现出对配体的高度选择性[即MC2R仅为ACTH激活,黑素细胞刺激素(melanoeyte-stinmlating hormone,MSH)类型的黑皮质素受体激动剂不能激活MC2R];MC2R在机体组织中的分布与功能表达存在限制性,并证实对黑素皮质素2型受体辅助蛋白(melanoeortin-2 receptor accessory protein,MRAP)存在依赖性。MC2R只有在MRAP存在时才能实现由内质网向细胞膜表面的迁移,而最终实现功能表达还需要1型辅助蛋白(melanoeortin-2 receptor accessory protein,MRAPl)的参与。
下丘脑一垂体一肾上腺在哺乳动物应激过程中的调控方面发挥着重要作用,动物在应激源刺激之后,下丘脑释放促肾上腺皮质激素释放激素作用于垂体前叶,使垂体前叶促肾上腺皮质激素细胞合成加工并释放促肾上腺皮质激素(ACTH),ACTH作用于肾上腺,并与MC2R结合启动相关信号通路,诱导皮质醇合成。目前,已在哺乳动物的相关研究中证实,MC2R被ACTH激活后诱发的cAMP积累对皮质醇的合成具有关键作用;而在硬骨鱼中,皮质醇的合成分泌是在头肾肾间组织中完成的。类似于哺乳动物中的下丘脑一垂体一肾上腺调控轴,在硬骨鱼类中由下丘脑、垂体以及肾间组织构成。早期研究中只是对头肾中MC2R基因进行了简单的检测,后来通过分子技术以及原位杂交的手段确定了MC2R的存在,最终通过体外试验的方法证实皮质醇同ACTH的关系,为下丘脑一垂体一肾上腺/肾间组织轴在鱼类中的存在提供了依据,为鱼类中的应激调控研究提供了理论结构基础。
本文综述了近年来对MC2R相关配体、辅助蛋白以及应激调控方面的研究进展,为实际生产中的应激防控提供理论依据。
1.MC2R的配体
迄今为止,在哺乳动物、鸟类、爬行动物、两栖动物以及鱼类代表物种中,关于MC2R的研究均显示其在配体选择性方面具有专一性,即MC2R不能被MSH类型的MCRS配体激活,仅能被ACTH激活。Schwyzer等在MCRS相关配体结构的研究中发现,能激活MCRS的配体均含有H6F7R8W9结构,以致于一度被认为,MSH类型的配体虽不能激活MC2R,但存在与MC2R结合的能力,即MSH类型的配体可能与ACTH之间存在着竞争抑制的关系。随着研究深入,结果证实,MSH类型的配体虽然同ACTH有同样的H6FR8W9结构,但仍然不能与MC2R结合,试验中也证实MSH类型配体的存在并不能抑制ACTH同MC2R结合。
最初被研究的MC2R配体是人类的ACTH,因其由39个氨基酸构成,所以被记作ACTH(1-39),早期研究中,通过对氨基酸序列的比对以及对ACTH(1-39)的人为改造(包括切除/丙氨酸替换等方式)以及自然突变体的研究发现,包括ACTH(1-39)在内的MCRS配体均具有H6F7R8W9结构。然而,由于MC2R表现出在配体选择性方面有异与其他MCRS的专一性,说明其在结构上应有相应的特殊性;与此同时,Schwyzer等也发现,当类似物ACTH(1-24)[为人工改造的ACTH(1-39)的类似物,具有同ACTH(1-39)完全相同生物活性]的R18、R17、K16残基被删除时,ACTH(1-39)类似物ACTH(1-16)显示出的相关生物活性的消失与降低以及类似物ACTH(11-24)对ACTH(1-39)的拮抗作用,都显示出碳端某种重要结构的存在。最终,ACTH的K15K16R17R18结构得以发现。2004年,Costa等进一步指出hACTH(1-24)中的P19残基也参与到这一结构序列的组成,于是这一结构被拓展为K15K16R17R18P19结构。
随后有研究进一步显示,MC2R虽然与其他MCRS有相同的结合H6F7R8W9结构的位点,但其在自然状态下是被隐藏了,因此ACTH与之相结合的过程并不是一步完成,于是双重结构模型被提出。在MC2R中与ACTH结合相对应的位点中只有H6F7R8W9结合位点暴露在外,在两者发生结合时,K15K16R18P19结构首先与MC2R上的对应位点相结合,继而改变MC2R的空间构象,致使H6F7R8W9结构的对应位点暴露,然后H6F7R8W9结构得以与MC2R相应位点结合,最终促发下游偶联蛋白。Schwyzer将ACTH(1—24)中的K15K16R17R18结构定义为定位结构序列,它能选择性的结合到ACTH受体上,但其本身不具备激活受体的能力。而H6F7R8W9结构被定义为信息结构序列,当其与ACTH受体结合时,相应的下游应答反应随即出现。因此,MC2R的激活需要H6F7R8W9和K15K16R17R18等2种结构同时存在;由于a一MSH只具备H6F7R8W9结构,缺少K“K“驴R”结构,使得仪一MSH不具备激活ACTH受体的能力,因而不能诱导肾上腺细胞产生糖皮质激素。
在双重结构模型中,一旦K15K16R17R18P19结合位点被相应结构结合,就会导致H6F7R8W9结构结合位点暴露,有研究提出,K15K17R17R18P19结合位点与相应结构结合之后,a一MSH能激活MC2R,因为a一MSH同样具有H6F7R8W9结构。而在Navolotskaya等的研究中发现,类似物ACTH(11-24)以及源自人类白细胞介素前体一1a(pro—interleukin一1a)虽然能结合受体上的K15K16R17R18P19位点;但其氮端可能干扰a-MSH的进入,从而不适合这一猜想的验证。因此,在验证性试验中使用了ACTH(15—24),它既保证K15K16R17R18P19结构与其结合位点的正常结合,又避免对H6F7R8W9结合位点的干扰。试验中将hMC2R/mMRAP转染CHO细胞以hACTH刺激作为阳性对照,使用组合a-MSH与ACTH(15—24)或者是组合ACTH(4—10)和ACTH(15—24)共同刺激作为试验组。结果发现,仅对照组受体被激活,试验中均未引起受体的激活。这显示K15K16R17R18P19结构和H6F7R8W9结构之间可能还存在一些关键的氨基酸残基。进一步研究显示,以丙氨酸替换基中的任何一个时,都会对人类MC2R的激活造成干扰,而对四足爬行动物的相关研究同样显示丙氨酸替换会引起不同程度的影响。其中,3种四足爬行动物的MC2R结构十分相似,因此出现的不同影响是由ACTH的精细三级结构变化造成的。那些同时具备K15K16R17R18P19结构以及H6F7R8W9结构而中间缺失了氨基酸残基的ACTH(1—21)以及ACTH(1—22)类似物之所以不能激活受体是由G10K11P12V13G14结构所拥有的精细调控功能丧失所造成的。最终MC2R的结构被划分为3个结构区域。
近年来,有关MC2R的研究中所涉及相关配体3个区域的细节方面的研究,常常采取丙氨酸替换的方式对单一或是几个氨基酸的重要性进行评价分析。对人类、两栖类以及爬行动物H6F7R8W9结构进行研究时发现,3个物种在W9残基被丙氨酸替换时均表现出生物活性的完全丧失。对于人类MC2R而言,丙氨酸替换之后造成的破坏程度紧居其后是F7和R8,造成影响最小的是r。爬行动物和两栖类对H6F7R8W9结构的要求更加严格,丙氨酸替换F7、R8、W9都会阻碍其与受体结合,在爬行动物中,甚至是H6发生替换也会阻碍其对相关受体激活。至于K15K16R17R18P19结构中,由丙氨酸替换时,人类MC2R相较于爬行类和两栖类的MC2R有更高的耐受能力。总体上看来,丙氨酸替换试验与早期依赖于ACTH类似物的研究结果很一致,结果支持早期提出的配体ACTH双重结构模型,即H6F7R8W9结构与K15K16R17R18P19结构是配体激活受体必需条件。
在ACTH丙氨酸替换试验中所表现出来的,高等动物明显存在高于较低等动物的耐受性,从进化的角度来看,这可能是进化过程中生物形成的保护机制,进而减少由于偶然突变带来的不利影响。而在海七鳃、白斑角鲨以及文昌鱼的研究中发现,ACTH在受体亲和力方面明显比MSH类型的配体更具优势。与此同时,在药理方面的研究中ACTH的效能也明显高于MSH类型的配体。由此原始受体对天然激动剂的相关表现来看,ACTH较MSH类型配体更原始。
2.MC2R辅助蛋白
在MC2R的研究中发现其分布与其他MCRS相比,存在明显的局限性,MC2R基因几乎只能在肾上腺皮质的细胞中才能实现功能表达,如INS-1β-cells。在人类有关MC2R的研究中,对脑、肝脏以及肾上腺3种组织(其中MC2R仅能在肾上腺中实现功能表达)中的cDNA进行RT-PCR操作,结果发现了1个仅在肾上腺中表达的基因,最终证实为MC2R辅助蛋白(MRAP)。在大量关于MC2R进行研究利用中国仓鼠卵巢(Chinese hamster ovary,CHO)细胞系对非哺乳动物MC2R进行研究,基本上都需要MRAPl的存在,才能实现MC2R的功能表达,仅米氏叶吻银鲛例外。
就目前研究结果可知,MRAP存在MRAPl(MRAPa和MRAPβ)和MRAP2(MRAP2a和MRAP2b)2个类型。MRAP为单链肽链,含有1个横跨膜区域,在内质网中,MRAP单体以同源二聚体存在。在这一聚体、二聚体中,2个多肽以反向平行的方式结合。在内质网中,2个MRAPl二聚体同1个MC2R二聚体形成1个复合物,最终以这种六亚基复合物的形式迁移到细胞膜上。MRAP在内质网中参与协助MC2R正确折叠,如果缺少MRAP的存在,MC2R不能进行折叠,随后将插入到内质网膜中,最终被内质网的监控机制所清除。虽然MRAPl与MRAlY2在辅助MC2R向细胞膜上迁移的效能是等价的,但是,只有MC2R同MRAPl相互结合之后的构象才能在细胞膜上同ACTH发生反应。
Simon等研究还发现,当MRAP2存在时,MRAPa和MRAPβ的表达量会增加;而当MRAPoz或MRApβ存在时,MRAlY2的表达量也会增加。将MRAPoz和MRAPβ进行生物活性比较,结果显示,MRAPoβ存在时MC2R的复合物对ACTH具有更高的效能,而这一结果源于MARP的碳端结构,试验结果证实,当以碳端切除之岳的MRAP类似物与MC2R进行共表达时,MC2R复合物对ACTH的亲和力显著降低。由此显示MRAP碳端结构与MC2R复合物对ACTH的亲和力密切有关。
以MRAPl基因进行系统进化分析,结果表明,四足爬行动物与硬骨鱼类的MRAPl基因在进化上呈现出不同趋势。Travis等在其研究中也证实了这一现象,试验通过将两栖类的MC2R基因分别与鼠、斑马鱼的MRAPl基因共表达于CHO细胞中,再以人源ACTH进行激活,结果显示,鼠MRAPl基因存在的1组中应答明显更为强烈;而在cAMP应答试验中,斑马鱼MRAPl存在时,虹鳟MC2R对于ACTH的应答明显强于鼠MRAPl存在时的表现。结果显示,MC2R与相应的辅助蛋白间存在协同进化。
通过对哺乳动物、鸟类、四足类动物(包括爬行类和两栖类)、鱼类以及早期脊椎动物(无颌类)等大量物种的MRAP基因序列进行比较分析,结果在早期脊椎动物(如海七鳃鳗)的研究中发现MRAP2存在,而MRAPl缺少,反映出MRAP2为早期MRAP家族的成员;研究结果还显示,MRAP在肉鳍鱼类、两栖类以及爬行类动物中缺失;而鸟类以及哺乳动物则同时存在MRAP中的2个类型。
3.MC2R
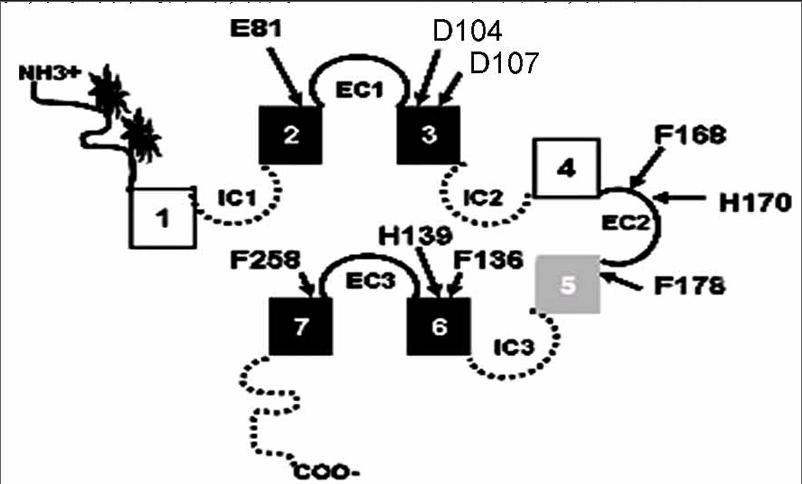
研究者对MC2R的结构进行了相应的研究,例如,Pogozheva等应用计算机模拟,结合点突变的方法对人类MC4R的H6FRsW9结构结合位点进行研究。基于模拟结果,H6FR8W9结构结合位点由TM2、TM3、TM6和TM7中的残基构成,这些残基在受体中形成一个亲水口袋,并暴露于细胞外的空间中。结果显示,G蛋白偶联受体的跨膜区域拥有1个筒状构型。在这一构型中,4个跨膜区域相互之间靠得很近。在人类MC2R的相关研究中同样得到了类似的H6F7R8W9结构结合位点,相关氨基酸残基(E81、D107、F136、H139)分别位于TM2、TM3和TM6。Chen等采用单一丙氨酸突变的方法对E81、F136、H139等氨基酸残基进行替换,结果发现每一个单一丙氨酸替换之后的MC2R突变体对hACTH刺激应答能力显著下降。并且发生在TM7中F258氨基酸残基的自然突变,同样引起受体刺激应答能力下降。系列研究结果显示,hMC2R中H6F7R8W9结构结合位点的构成残基位于TM2、TM3、TM6和TM7上。此外,1个发生在人类MC2R的EC2中的H17残基的自然突变对hACTH刺激应答能力下降。研究者对EC2以及TM5区域进行丙氨酸替换试验时发现,EC2以及TM5区域发生突变时,hACTH(1—24)不能激活受体,由于EC2和TM5相对远离构成H6F7结构的结合位点,因此,提出EC2以及TM5参与了KRlIRl8p19结构结合位点的构成。MC2R预测结构见图1。
Kovalitskaia等提出了MC2R与MRAP的模型,如图2所示,MRAP二聚体中的1个MRAP分子同MC2R的第三、第四跨膜区结合,从而对ER信号分子的捕捉进行修饰。同时,另1个MRAP分子与第四、第五跨膜区共同构建了KKRR结构的结合位点。当ACTH特异性结合到KKRR结构结合位点时,促使第四、第五跨膜区同第六、第七跨膜区的结合发生分离,进而形成HFRW结构的结合位点,最终激活下游信号。
4.MC2R与机体的应激调控
硬骨鱼中皮质醇是一种肾间组织分泌的主要的类固醇类,其在调节应激应答中扮演着重要角色,但其在应激应答过程中的释放受下丘脑一垂体一肾间组织轴调控。其中皮质醇的合成是由ACTH与位于肾间组织中的MC2R受体结合后所介导合成释放的。在虹鳟摄食含硒日粮的相关研究中发现,急性应激导致血清皮质醇浓度显著升高期间,血清ACTH(应激1 h后)含量也会显著升高,而MC2R mRNA的表达量也显著上调,在鲤鱼的相关研究中也有类似的结论。在关于MC2R基因的相关研究中发现,MC2R基因突变导致的MC2R失活,会阻断对ACTH刺激的应答反应,从而阻碍皮质醇合成。在早期垂体切除试验中观察到血清皮质醇浓度下降,当以ACTH进行处理时,则避免了血清皮质醇浓度下降。这反映出ACTH对皮质醇合成的影响。而在一些鱼类的毒理性试验中,则反映出MC2R本身对于皮质醇合成的影响;例如,以有机氯、β一萘黄酮或是镉离子处理肾间组织时,研究人员发现ACTH对皮质醇合成的刺激失效,而使用cAMP进行处理时,观察到皮质醇水平的升高。试验结果表明,MC2R及其配体在鱼类应激调控中的重要作用。
5.结论
MC2R之所以有别于其他MCRS,主要体现在2个方面:一是其对配体选择的专一性,就目前已有研究而言,绝大多数的研究结果都显示出MC2R只能被ACTH激活,这一现象的阐明得益于对ACTH中K15K16R17R18P19、H6F7RsW9、等3个结构区域的认识;二是由于MC2R对于辅助蛋白MRAP依赖性所表现,MC2R从内质网向细胞膜表面的迁移需要MRAP的辅助,并且几乎所有MC2R功能表达的实现都离不开MRAPl的存在。就MC2R的这2个特点而言,其起源尚不明确,MCRS仅出现于脊索动物的共识以及米氏叶吻银鲛在MC2R功能表达的特殊表现都显示出鱼类MC2R相关研究,今后还需进一步加强鱼类MC2R相关基础研究。
在生理机能的研究中,MC2R与其配体都是皮质醇合成过程中的关键,并且参与下丘脑一垂体一肾间组织轴的构建,大量研究结果显示,MC2R及其相关配体在鱼类应激方面紧密相关。但是,对于应激过程中基因表达量的变化是否引起蛋白水平上的量变,或是仅仅引起受体本身敏感度的变化还有待进一步研究。目前,鱼类在相关技术方面与高等动物还存在差距,相关研究手段在鱼类中的应用尚存在困难。因此,对鱼类等低等脊椎动物MC2R的研究不仅有助于了解鱼类在应激下皮质醇合成释放的基本机制,而且对整个渔业的健康发展也具有重要意义。
