响应面试验优化玉米淀粉挤出-酶解复合法糖化工艺
2015-10-18吕呈蔚樊红秀金凤石张艳荣
丛 崇,吕呈蔚,樊红秀,郭 中,金凤石,张艳荣*
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
响应面试验优化玉米淀粉挤出-酶解复合法糖化工艺
丛 崇,吕呈蔚,樊红秀,郭 中,金凤石,张艳荣*
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
以经过挤出-酶解复合法液化后的玉米淀粉为原料,利用葡萄糖淀粉酶为糖化酶,采用挤出-酶解复合法糖化玉米淀粉挤出酶解物。以葡萄糖(dextrose equivalent,DE)值为考察指标,在单因素试验的基础上,利用响应面法对糖化工艺参数进行优化,确定最佳挤出工艺。响应面分析结果表明,最优工艺为葡萄糖淀粉酶添加量140 U/g、原料质量分数70%、挤出温度85 ℃,由此工艺得到的淀粉糖DE值为42.12%。利用高效液相色谱法检测得出DE38产品葡萄糖含量26.17%、麦芽糖含量25.29%、麦芽三糖含量14.86%,DE42产品葡萄糖含量29.57%、麦芽糖含量33.40%、麦芽三糖含量17.23%。红外图谱显示挤出物中含有葡萄糖等低聚糖特征峰,扫面电镜图显示原料经挤出后表面生成多孔状结构,X-射线衍射图显示有新的晶型结构生成,Brabender黏度曲线表明挤出物中含有小分子可溶性糖,黏度降低。
挤出-酶解复合法;玉米淀粉;糖化
利用淀粉为原料生产的糖品统称为淀粉糖,产品种类繁多,生产历史悠久,利用淀粉为原料制成糖品,是对淀粉的更好利用。目前世界上市面出售多种已开发成型的玉米加工制品,种类繁多,不胜枚举,主要产品包括饲料、淀粉、淀粉糖、酒精、玉米油、淀粉塑料、玉米风味食品及其他深加工产品。玉米作为我国主要的粮食产物之一,具有原料充足、质量高、成本低、保健性好等诸多优点,是生产淀粉糖的优选原料。与传统的甘蔗和甜菜糖相比,淀粉糖可以通过不同的转化途径和工艺条件,从而改变产品中各种糖分的比例,获得理想甜度,满足食品加工的需要[1-2]。淀粉糖良好的应用性能使得该产业迅速发展,制备淀粉糖的原料质量越高越好,质量低劣的淀粉会给后续的精制带来困难[3-4]。工业上产量最大、应用最广的是中转化糖浆,其葡萄糖(dextrose equivalent,DE)值为30%~50%,其中DE38和DE42是较为常见的产品。传统方法制备淀粉糖浆采用喷射液化法,再用压力糖化罐进行糖化,但传统方法存在很多缺点,如设备占地面积大、生产成本高、水耗能耗过大、污染废物多等[5-6],因此研究新型节能型生产方法迫在眉睫。挤出技术很早就被应用在食品领域中,前人也将挤出法应用到淀粉糖的生产工艺中,肖志刚[7]采用单螺杆挤出技术处理玉米粉,研究了挤压口模具直径、挤出温度、物料水分含量和螺杆转速对挤出物的影响,并以挤出物为原料,采用酶法进行液化与糖化工艺制备淀粉糖浆,但其工艺特点为采用挤出法处理脱胚玉米,再经过传统酶糖化的方法,而未在挤出过程中完成糖化工艺。本研究将挤出复合酶解技术应用在淀粉糖生产中,旨在通过挤出复合酶解作用直接生产淀粉糖,其原理是使淀粉在挤出腔内的水分、热和机械剪切力等综合作用下,使淀粉呈现熔融状态[8-11],此时淀粉的晶体结构已被破坏,能够增大葡萄糖淀粉酶的作用效果,当淀粉从模具中被挤出,压力骤然下降为常压,物料中水分发生闪蒸,温度急剧下降,因此物料成为具有一定形状的、多孔结构的膨化淀粉糖产品[12]。挤出过程也达到了灭酶的效果,减少后续精制工序。本研究采用挤出-酶解复合法液化后的高含量玉米淀粉挤出酶解物为原料,与传统喷射液化工艺相比,减少了大量能耗、水耗和时间。进一步采用挤出-酶解复合法糖化玉米淀粉挤出酶解物,并采用响应面法优化工艺参数。该糖化生产工艺简单,减少了生产周期,降低糖化酶使用量,提高淀粉糖的品质。目前对于挤出-酶解复合法制备淀粉糖的工艺还罕有报道,因此本研究为淀粉糖生产技术提供新思考。
1 材料与方法
1.1材料与试剂
玉米淀粉 长春大成新资源集团有限公司;耐高温α-淀粉酶(酶活力3.2万 U/mL)、葡萄糖淀粉酶(酶活力136 328 U/g) 枣庄市杰诺生物酶有限公司;葡萄糖标准品、麦芽糖标准品、麦芽三糖标准品 德国Dr. Ehrenstorfer公司;酒石酸钾钠、乙酸锌、盐酸、氢氧化钠、硫酸铜、硫代硫酸钠、亚甲蓝、无水乙醇、醋酸、亚铁氰化钾、葡萄糖等(均为分析纯) 北京化工厂。
1.2仪器与设备
JC-60A型单螺杆挤出机 长春市盛达食品工业研究所;Q-250A3高速多功能粉碎机 上海冰都电器有限公司;BPG-9240A精密鼓风干燥箱 上海一恒科学仪器有限公司;DR-A1数字式阿贝折光仪 上海恒奇仪器仪表有限公司;DK-98-Ⅰ电子万用炉 北京市永光明医疗仪器厂;GB204分析天平 德国赛多利斯特仪器有限公司;1200型高效液相色谱仪 美国Agilent公司;IR Prestige傅里叶红外光谱仪、SSX-550型扫描电子显微镜日本岛津公司;D8-ADVANCE型广角X射线衍射仪 德国Bruker公司;黏度仪 德国Brabender公司。
1.3方法
1.3.1原料制备工艺流程[13]

1.3.2挤出-酶解复合法糖化玉米淀粉挤出酶解物工艺流程

1.3.3糖化单因素试验设计
挤出技术在淀粉糖生产中的应用是使物料在挤出腔内受到水分、温度、机械剪切力以及高压力差的综合作用达到糊化的过程,若在挤出过程中添加酶制剂,则降解程度会大大提高,在挤出过程中,温度会影响酶的催化作用,水分也是重要的参数之一,因此单因素试验以挤出物的DE值为考核指标,分别考察挤出温度、葡萄糖淀粉酶添加量和原料质量分数对试验的影响。
1.3.3.1对挤出温度的考察
以实验室自制液化后玉米淀粉挤出酶解物为原料,在原料质量分数70%、葡萄糖淀粉酶添加量140 U/g(干物质)的条件下,考察挤出温度分别为75、80、85、90、95 ℃时,挤出物的DE值。
1.3.3.2对葡萄糖淀粉酶添加量的考察
在原料质量分数70%、挤出温度85 ℃的条件下,考察葡萄糖淀粉酶添加量分别为100、120、140、160、180 U/g(干物质)时,挤出物的DE值。
1.3.3.3对原料质量分数的考察
在葡萄糖淀粉酶添加量140 U/g(干物质)、挤出温度85 ℃的条件下,考察玉米淀粉挤出酶解物含量,即原料质量分数分别为60%、65%、70%、75%、80%时,挤出物的DE值。
1.3.4挤出-酶解复合法糖化玉米淀粉Box-Behnken试验设计
在单因素试验的基础上,选取挤出温度(A)、葡萄糖淀粉酶添加量(B)、原料质量分数(C)为自变量,挤出物的DE值为响应值(Y),设计三因素三水平响应面试验,试验因素水平见表1。

表1 挤出-酶解复合法糖化Box-Behnken试验设计水平表Table 1 Independent variables and their coded levels used in Box-Behnken design for optimization of starch sacchrififi cation
1.3.5检测方法
1.3.5.1DE值的检测和出品率的测定
还原糖含量测定按照GB/T 5009.7—2008《食品中还原糖含量的测定》一般食品的处理方法执行;可溶性固形物含量的测定按照阿贝折光仪法执行[14];DE值的计算参考下式:

式中:X为挤出糖化物中还原糖的含量/g;Y为挤出糖化物中可溶性固形物的含量/g。
1.3.5.2红外光谱测定
称取适量挤出物置于50 ℃烘箱中烘干,收集样品备用,称取溴化钾粉200 mg置于105 ℃烘箱中至恒质量,称取1 mg样品与100 mg溴化钾粉,充分混合均匀,用玛瑙研钵研磨混合物后收集,将混合物在压力为7 MPa的条件下,压制成直径为13 mm的薄片,进行红外光谱测定,扫描波数范围为500~4 000 cm-1。
1.3.5.3高效液相色谱测定
高效液相色谱条件:Ultimate Diol二醇基柱(5 μm,100 Å,4.6 mm×250 mm);流动相:乙腈-水体积比85∶15;流速1.0 mL/min;进样量10 μL;柱温85 ℃;检测器温度35 ℃。
混合标准品溶液的配制与标准曲线的制作:准确称取葡萄糖标准品3.42 mg、麦芽糖标准品2.01 mg、麦芽三糖标准品4.31 mg于10 mL容量瓶中,用超纯水定容至刻度。配制成的混合标准溶液中含葡萄糖标准品0.342 mg/mL、麦芽糖标准品0.201 mg/mL、麦芽三糖标准品0.431 mg/mL,备用。准确吸取混标液5、10、15、20、25 μL的分5次进样,以混标液中单糖组分含量(μg)的对数值为横坐标(X),以相应峰面积的对数值为纵坐标(Y),制作标准曲线并计算线性回归方程。
挤出物样品的检测:称取待测样品10 mg于10 mL容量瓶中,用1∶1乙腈蒸馏水溶液溶解并定容至刻度,将溶液过0.22 μm滤膜,得到样品液。使用标准品与样品对照法直接进行定性,即将样品和已知标准物在同一色谱柱和相同条件下进行检测,根据出峰的时间定性,根据峰面积计算质量浓度[15-16]。
1.3.5.4微观结构的观察
样品预处理:将玉米淀粉、玉米淀粉挤出酶解物和挤出酶解糖化物均过200目筛,分别称取3 种样品1 g于100 mL烧杯中,并分别加入20 mL无水乙醇进行超声分散处理,超声功率为100 W,时间为1 min,用滴管吸取少量处理过的样品滴于电镜硅片上,待乙醇完全挥发,将承载硅片置于50 ℃烘箱烘干,烘干后,将电镜硅片放入镀金器中喷涂铂/钯合金,将喷金后的电镜硅片置于扫描电子显微镜下,拍摄样品微观结构[17]。
1.3.5.5X-射线衍射测试分析
将样品置于50 ℃烘箱烘干至恒质量,对干燥的样品进行超微粉碎处理,过200目筛。测试时称取0.5 g样品放入测试池中,用载玻片将样品表面压平,放入X-射线衍射仪中进行测定,采用连续扫描方式,广角衍射,特征射线CuKα,扫描速率为2 °/min,扫描区域为 5°~50°,步长为0.02,管压为40 kV,管流为40 mA。
1.3.5.6Brabender黏度计测定分析
准确称取10.00 g样品,加入蒸馏水配制成质量分数为10%的溶液100 g,置于Brabender黏度计的样品钵中。仪器从50 ℃开始升温,升温速率为10 ℃/min,温度达到100 ℃后保持温度3 min,然后开始冷却,降温速率为10 ℃/min,冷却至50 ℃后,继续保持温度2 min,之后得到样品的Brabender黏度曲线。
2 结果与分析
2.1单因素试验结果
2.1.1挤出温度对挤出物DE值的影响
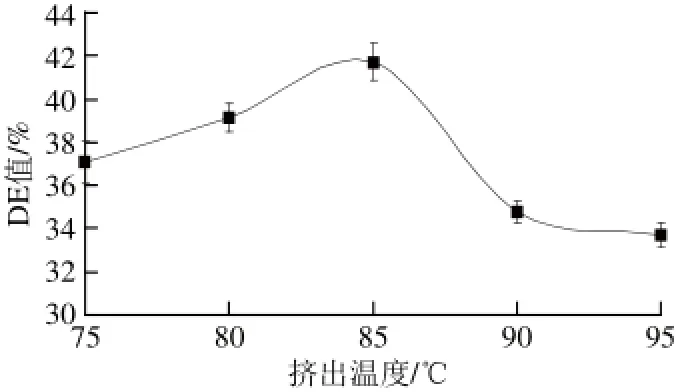
图1 挤出温度对DE值的影响Fig.1 Effect of extrusion temperature on DE value
在挤出过程中,物料吸收热量为酶解反应提供适当的温度。由图1可知,挤出温度小于85 ℃时,挤出物的DE值随温度的升高而增加,挤出温度大于85 ℃时,挤出物的DE值明显下降。因葡萄糖淀粉酶的最适反应温度为70~90 ℃,随着挤出腔内温度的升高物料随之升温,短时间内达到最适反应温度,并且在挤出头处高温高压的作用下达到灭酶的效果[18-19]。若挤出温度过高,虽可以提高玉米淀粉的糊化程度,增大糖化酶作用机会,但容易使蛋白酶失活,减少作用时间,酶解不彻底。因此,选取挤出温度85 ℃为宜。
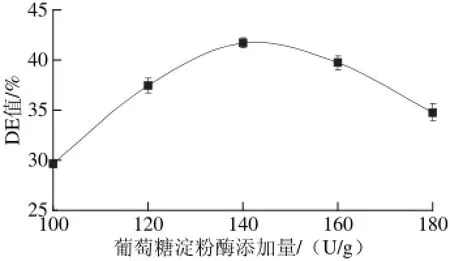
图2 葡萄糖淀粉酶添加量对DE值的影响Fig.2 Effect of glucoamylase amount on DE value
2.1.2葡萄糖淀粉酶添加量对挤出物DE值的影响玉米淀粉挤出酶解物在挤出过程中受到套筒外壁的高温以及套筒内壁反向螺旋、捏合块等剪切力的作用,玉米淀粉颗粒发生膨胀,晶体结构消失,体积膨大,有利于葡萄糖淀粉酶的作用[20]。由图2可知,随着葡萄糖淀粉酶用量的增加,挤出物的DE值上升较快。但当葡萄糖淀粉酶添加量达到140 U/g(干物质)后再增大酶的用量,DE值几乎不变,分析原因可能是在挤出过程中反应时间较短。因此,选择葡萄糖淀粉酶添加量140 U/g(干物质)左右为宜。
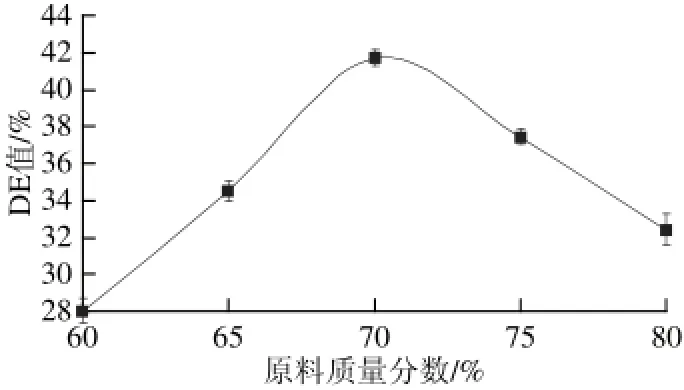
图3 原料质量分数对DE值的影响Fig.3 Effect of raw material concentration on DE value
2.1.3原料质量分数对挤出物DE值的影响原料质量分数对挤出物的DE值有一定的影响。由图3
可知,当原料质量分数较高时,虽然原料质量分数增大,但物料中水分含量较低,物料与套筒内壁摩擦力较大,不易形成熔融状态,酶在低水分环境中不能充分作用。当原料质量分数较低时,物料中水分含量较高,在高水分环境下有利于酶解反应的进行,但同时挤出腔内的高温高压环境在水分过高时易使蛋白酶失活,则不利于反应的进行。选择原料质量分数70%为宜。
2.2玉米淀粉挤出酶解物糖化工艺优化
2.2.1Box-Behnken响应面试验分析
对挤出-酶解复合法糖化玉米淀粉挤出酶解物工艺进行优化,通过单因素试验选择挤出温度、葡萄糖淀粉酶添加量、原料质量分数为自变量,DE值为响应值,根据Box-Behnken试验设计原理[21],得到挤出-酶解复合法糖化玉米淀粉挤出酶解物工艺的三因素三水平试验设计,试验方案及结果见表2。

表2 Box-Behnken试验设计及结果Table 2 Box-Behnken design with experimental results
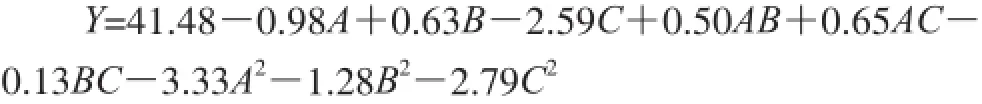
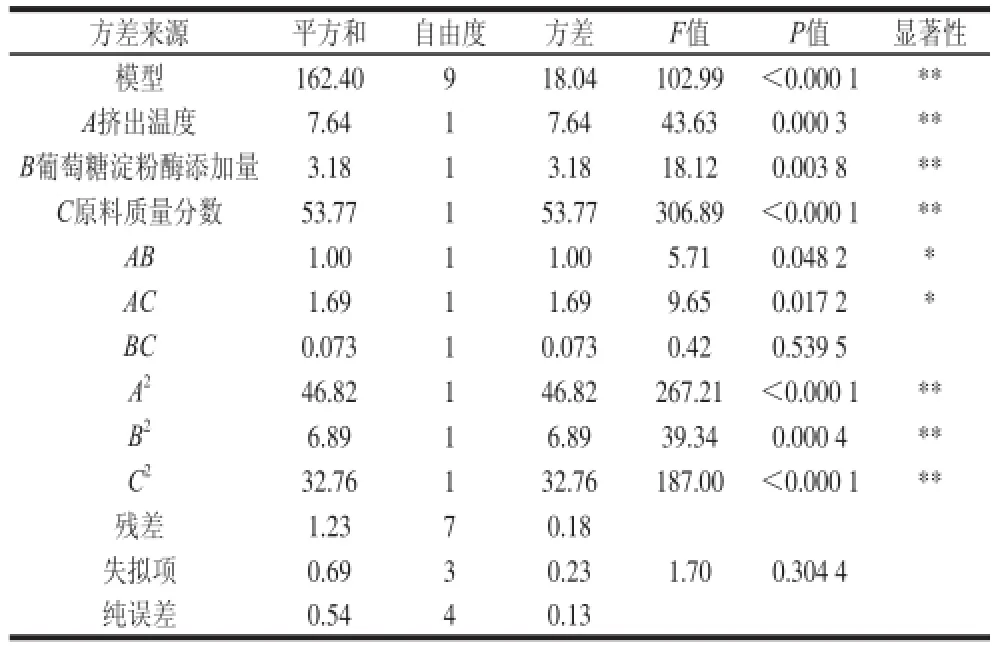
表3 方差分析Table 3 Analysis of variance for the responseY (DE valuuee)

表4 回归模型可信度分析Table 4 Reliability analysis of regression model
利用Design-Expert软件对响应面结果进行分析及多元回归拟合,得到挤出温度(A)、葡萄糖淀粉酶添加量(B)、原料质量分数(C)之间的三元二次回归方程为:由表3、4分析结果可知,模型总决定系数99.25%,调整决定系数=98.29%,该系数均较高,说明试验误差小。模型的可信度可通过变异系数得知,变异系数值与可信度呈反比,变异系数为1.10%,模型预测的值都能较接近真实值,故可对响应值的变化进行分析。
2.2.2各因素交互作用对挤出物DE值影响的响应面

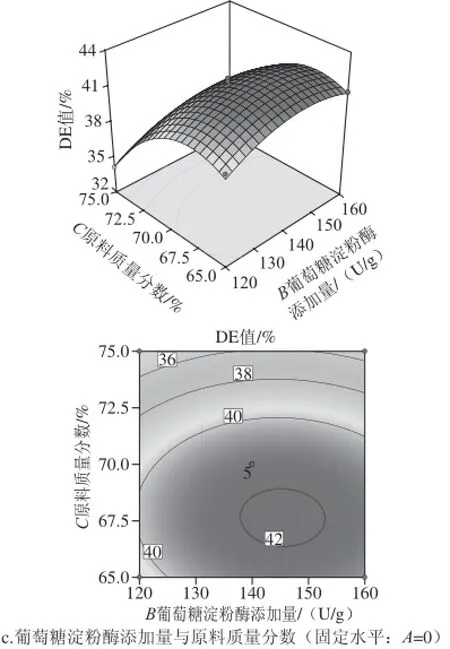
图4 各因素交互作用响应面和等高线图Fig.4 Response surface and contour plots showing the interactive effects of various factors on DE value
由图4可知,当葡萄糖淀粉酶添加量与原料质量分数在0水平时,改变挤出温度对挤出物的DE值有明显影响;在葡萄糖淀粉酶添加量与挤出温度在0水平时,改变原料质量分数对挤出物的DE值也有显著影响。原料质量分数和葡萄糖淀粉酶添加量的交互作用对挤出物DE值影响最小,由等高线图同样可以看出在保持葡萄糖淀粉酶添加量为0水平时,挤出物的DE值变化并不明显。挤出温度和原料质量分数的交互作用抛物面图曲线表现较陡,有利于找出试验的最佳工艺[22]。
2.2.3挤出-酶解复合糖化工艺的优化及验证
通过响应面软件对回归方程的计算分析,得到糖化最佳工艺为葡萄糖淀粉酶添加量144.75 U/g(干物质)、原料质量分数67.54%、挤出温度84.12 ℃,由此工艺得到的淀粉糖DE值为42.28%。为方便实际操作,验证实验采用葡萄糖淀粉酶添加量140 U/g、原料质量分数70%、挤出温度85 ℃,进行3 次平行实验,所得产品的DE值平均为42.12%,基本符合中转化糖浆的要求。
2.3红外光谱结果分析
由淀粉糖产品的红外图谱检测淀粉糖组分的结构和化学键,在500~4 000 cm-1范围内有特征吸收峰,中转化糖的主要组成成分是葡萄糖、麦芽糖和一些低聚糖。由图5可以看出,自制中转化糖DE38和DE42产品在3 200~3 400 cm-1处都出现了宽且强烈的吸收峰,是氢键连接的O—H振动吸收峰;在2 927 cm-1处的吸收峰表明样品中存在C—H基团,有烷烃类的化合物存在;在1 410~1 430 cm-1处出现的是弯曲的—CH2—的吸收峰。葡萄糖存在3 种构型。图谱显示在1 015~1 160 cm-1处也出现了较宽且强烈的吸收峰证明样品有伯醇官能团与C—O键,而在1 660~1 755 cm-1处没有吸收峰,说明样品中的葡萄糖非直线型的,可能是α-葡萄糖或β-葡萄糖,基本符合葡萄糖以及低聚合度葡聚糖的特征吸收[23]。

图5 中转化糖DE38(A)和DE42(B)红外光谱图Fig.5 Infrared spectra of saccharifi ed products with DE values of 38% and 42% (moderately inverted sugar syrup, DE38 and DE42)
2.4糖组分检测结果
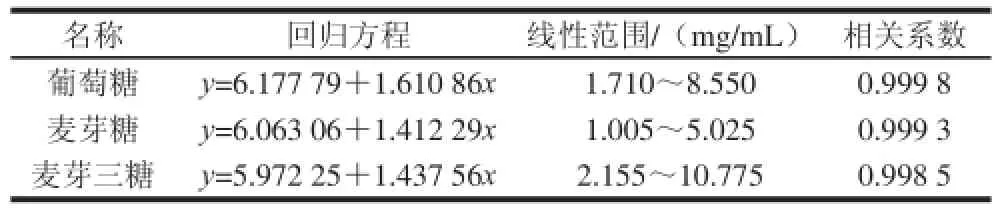
表5 回归方程、线性范围及相关系数Table 5 Regression equations with linear ranges and correlation coeffi cients for glucose, maltose and maltotriose
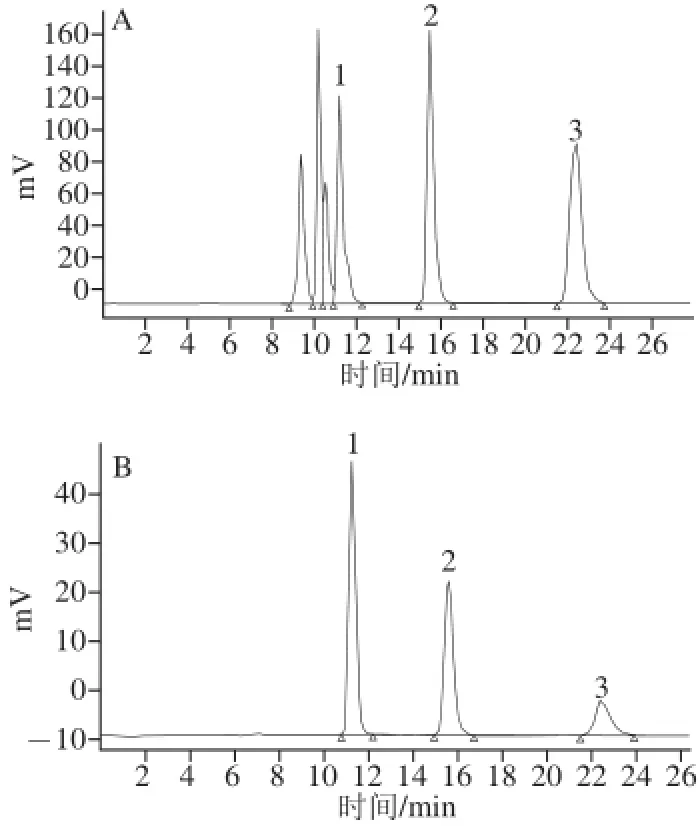
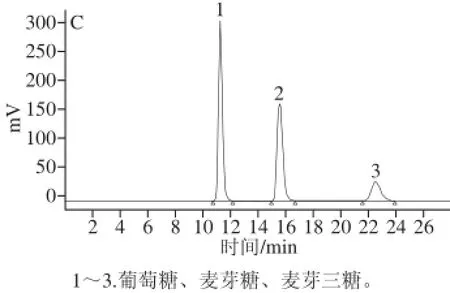
图6 标准品(A)、D38中转化糖(B)、D42中转化糖(C)高效液相色谱图Fig.6 Chromatograms of mixed standards (A), inverted sugar syrup DE38 (B) and inverted sugar syrup DE42 (C)
由图6可知,采用挤出-酶解复合法制得的中转化糖中含有葡萄糖、麦芽糖、少量麦芽三糖以及低聚糖。通过回归方程计算出DE38产品中葡萄糖含量为21.81%,麦芽糖含量为21.08%,麦芽三糖含量为12.39%;DE42产品中葡萄糖含量为24.64%,麦芽糖含量为27.84%,麦芽三糖含量为14.36%。与传统工艺相比,相同DE值的淀粉糖,利用挤出-酶解复合法制得的产品葡萄糖含量较高,原因可能是玉米淀粉在挤出过程中,淀粉颗粒膨化成蜂窝状或片状结构,淀粉链间氢键断裂,使得葡萄糖淀粉酶能更好的作用,生成小分子糊精、少量葡萄糖、麦芽糖和低聚糖等,相对增大了葡萄糖淀粉酶作用的底物质量浓度,更有利于糖化反应的进行。
2.5样品扫描电镜图分析

图7 玉米淀粉(a)、玉米淀粉挤出酶解物(b)、挤出糖化物(cc)的扫描电镜图Fig.7 SEM images of corn starch (a), extruded liquefi ed corn starch (b),extruded saccharifi ed corn starch (c)
由图7可知,玉米淀粉表面光滑,边缘平整,经过加耐高温α-淀粉酶一次挤出后的玉米淀粉的颗粒表面发生了微小变化,淀粉颗粒表面的天然结晶结构消失,颗粒表面呈现纹状,部分表面分布有直径较小的空洞,边缘处有不同程度的崩解,原因可能是在高温挤出过程中,玉米淀粉颗粒受到高温高压高剪切力及耐高温α-淀粉酶结合作用使其内部结构发生改变且出现孔洞,经过加葡萄糖淀粉酶二次挤出后糖化物,颗粒表面发生了显著变化,颗粒表面蓬松粗糙且多处出现深浅不一的刻蚀孔洞,原因可能是一次挤出后的玉米淀粉呈现孔洞状,增大了葡萄糖淀粉酶的作用,同时结合挤出过程中高温高压及剪切力的作用所致。
2.6样品X-射线衍射分析
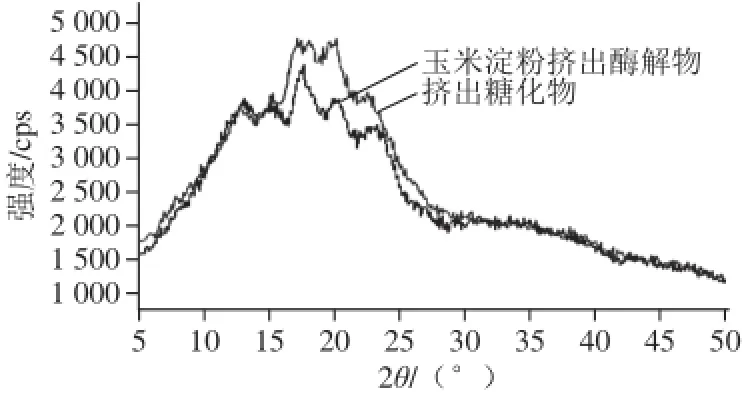
图8 玉米淀粉挤出酶解物、挤出糖化物X-射线衍射图谱Fig.8 XRD patterns of extruded liquefi ed corn starch and extruded saccharifi ed corn starch
淀粉多晶体系是由微晶、亚微晶和非晶中的一种或多种结构构成的,对酶作用由较强的抵抗力。X-射线衍射图峰的出现与微晶的大小有关,峰宽表示微晶越大,峰高则主要来自于非结晶领域。由图8可知,玉米淀粉挤出酶解物在2θ角为17.7°、20.1°和23.3°时具有强的吸收峰,经过加葡萄糖淀粉酶挤出后,晶型继续发生变化,在2θ角为15.3°和17.2°处出现了新的高强度特征衍射峰,可能是挤压过程中产生了具有较强衍射特征峰的新物质。
2.7Brabender黏度分析

图9 玉米淀粉挤出酶解物(a)和挤出糖化物(b)黏度曲线Fig.9 Viscosity curves of extruded liquefi ed corn starch and extruded saccharifi ed corn starch
淀粉不溶于冷水,但在水环境条件下,能可逆地吸收和失去水分发生轻微地溶胀,随着环境温度的升高,淀粉分子会发生剧烈振动,造成分子间氢键断裂,断裂的氢键与较多的水分子结合,水分子进入淀粉分子后,更长的淀粉短链便会分离,骤然增多的淀粉短链增加了淀粉溶液的无序性,结晶区域相对减少,溶液呈糊状。由图9可知,玉米淀粉挤出酶解物中含有未被分解的淀粉颗粒,在达到糊化温度后,未被分解的淀粉颗粒发生糊化作用[24],溶液的黏度上升,之后淀粉重结晶产生沉淀,从而溶液的黏度降低。通过图9a和图9b的对比,图9b中溶液黏度变化较小,分析原因可能是淀粉经过二次加酶挤出后,糖化程度较高,淀粉水解出的还原端较多。淀粉水解程度越高,其分子链越短,小分子可溶性糖含量越高,所以溶液的黏度较低[25]。
3 结 论
以玉米淀粉挤出酶解物为原料,采用挤出复合酶解法进行糖化,对挤出温度、葡萄糖淀粉酶添加量、原料质量分数对挤出物DE值的影响进行研究,采用单因素与响应面试验优化糖化工艺,结果表明:影响挤出物DE值的因素由强到弱为原料质量分数>挤出温度>葡萄糖淀粉酶添加量。最佳工艺参数为葡萄糖淀粉酶添加量140 U/g(干物质)、原料质量分数70%、挤出温度85 ℃,由此工艺得到的淀粉糖DE值为42.12%。基本符合中转化糖浆的DE值要求。
以玉米淀粉挤出酶解物为原料制备的DE38和DE42淀粉糖,通过高效液相色谱法测定淀粉糖产品中糖组分含量,DE38产品葡萄糖含量26.17%、麦芽糖含量25.29%、麦芽三糖含量14.86%,DE42产品葡萄糖含量29.57%、麦芽糖含量33.40%、麦芽三糖含量17.23%。其葡萄糖、麦芽糖含量高于传统糖化工艺。采用红外光谱分析表明挤出糖化物中含有葡萄糖等低聚糖特征峰;扫描电镜扫描图结果显示经过挤出酶解糖化后,产物表面生成多孔、褶皱状结构;X-射线衍射图谱显示有新的晶型结构生成;Brabender黏度曲线分析表明挤出糖化物中含有大量可溶性小分子糖,淀粉水解程度较高,黏度下降。
[1] 蒋世琼, 马丽. 淀粉糖新产品的开发与研究[J]. 食品工业科技, 2001,22(3): 83-85.
[2] 周治国, 徐树来, 刘利军. 玉米淀粉糖生产新工艺的研究[J]. 农机化研究, 2012(10): 169-171.
[3] 张艳荣, 王大为, 祝威. 高品质玉米膳食纤维生产工艺的研究[J]. 食品科学, 2004, 25(9): 213-217.
[4] 张力田, 高群玉. 淀粉糖[M]. 北京: 中国轻工业出版社, 2011: 68-76.[5] 尤新. 淀粉糖品生产与应用手册[M]. 北京: 中国轻工业出版社,2010: 45-109.
[6] 李敏. 半干法高效制备淀粉糖关键技术的研究[D]. 长春: 吉林农业大学, 2013.
[7] 肖志刚. 挤压膨化脱胚玉米生产淀粉糖浆的试验研究[D]. 哈尔滨:东北农业大学, 2002.
[8] 陈璥. 玉米淀粉工业手册[M]. 北京: 中国轻工业出版社, 2009: 6-10.[9] 王良东. 玉米淀粉酶法深加工制品[J]. 粮食与油脂, 2008, 5(3): 4-7.
[10] 张泽庆. 食品挤压技术[J]. 粮油加工, 2008, 33(2): 63-66.
[11] 刘丽. 挤压酶解技术制备碎米淀粉糖[D]. 哈尔滨: 东北农业大学, 2013.
[12] 王宝石, 庞海强, 修琳. 双螺杆挤压蒸煮对普通玉米粉糊化度的影响[J]. 食品与发酵科技, 2012, 48(2): 13-15.
[13] 张国权, 史一一, 魏益民, 等. 荞麦淀粉耐高温α-淀粉酶液化工艺条件研究[J]. 中国粮油学报, 2008, 23(3): 73-77.
[14] 周彦斌, 徐正康, 郭峰, 等. 大麦麦芽替代β-淀粉酶生产高麦芽糖的初步研究[J]. 现代食品科技, 2009, 25(7): 807-809.
[15] 徐忠, 张洪微, 韩玉洁. 离子交换树脂对高麦芽糖浆的分离纯化研究[J]. 化学与黏合, 2005, 27(5): 286-288.
[16] OUCHEMOUKH S, SCHWEITZER P, BEY M B, et al. HPLC sugar profiles of Algerian honeys[J]. Food Chemistry, 2010, 121(8):561-568.
[17] 王兆升, 董海洲. 玉米淀粉制备结晶葡萄糖中糖化影响因素的研究[J].农产品加工, 2006(2): 7-10.
[18] 陈福泉. 非晶颗粒态玉米淀粉半干法制备及激励[D]. 广州: 华南理工大学, 2010.
[19] MESA-STONESTREET N J D, ALAVI S, GWIRTZ J. Extrusion enzyme liquefaction as a method for producing sorghum protein concentrates[J]. Journal of Food Engineering, 2012, 108(12): 365-375.
[20] YOO J, ALAVI S, VADLANI P. Thermo-mechanical extrusion pretreatment for conversion of soybean hullsto fermentable sugars[J]. Bioresource Technology, 2011, 102(5): 7583-7590.
[21] FERREIRA S L C, BRUNS R E, FERREIRA H S, et al. Box-Behnken design: an alternative for the optimization of analytical methods[J]. Analytical Chimica Acta, 2007, 597(2): 179-186.
[22] GRAFELMAN D D, MEAGHE M. Liquefaction of starch by a singlescrew extruder and post-extrusion static-mixer reactor[J]. Journal of Food Engineering, 1995, 24(9): 529-542.
[23] TESTER R F, QI X, KARKALAS J. Hydrolysis of native starches with amylases[J]. Animal Feed Science and Technology, 2006,112(16): 39-56.
[24] 才源. 半干法玉米淀粉糖生产关键技术的研究[D]. 长春: 吉林农业大学, 2008.
[25] 张艳荣, 矫艳萍, 樊红秀. 挤出-酶解复合处理玉米粉糖化工艺研究[J]. 食品科学, 2013, 34(20): 49-54. doi: 10.7506/spkx1002-6630-201320010.
Response Surface Optimization of Saccharifi cation Process for Liquefi ed Corn Starch by Simultaneous Extrusion and Enzymatic Hydrolysis
CONG Chong, LÜ Chengyu, FAN Hongxiu, GUO Zhong, JIN Fengshi, ZHANG Yanrong*
(College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
The liquefi ed corn starch produced by simultaneous extrusion and enzymatic hydrolysis was further saccharifi ed by the same procedure except using glucoamylase instead of α-amylase. The optimization of saccharifi cation conditions for improved dextrose equivalent (DE) was investigated by the combined use of single factor experiments and response surface methodology. The results showed that when the saccharifi cation was carried out by adding 140 U of glucoamylase per g of dry matter, adjusting the concentration of the liquefi ed corn starch to 70% and performing extrusion at 85 ℃, the maximum DE value of 42.12% was obtained. The contents of glucose, maltose and maltotriose of the saccharifi ed product with a DE value of 38% were 26.17%, 25.29% and 14.86%, respectively, compared to 29.57%, 33.40%, and 17.23% for that with a DE value of 42%, respectively, as determined by high performance liquid chromatogram (HPLC). In the infrared spectrum of the extruded saccharifi ed starch the characteristic peaks of oligosaccharides such as glucose were observed. The scanning electron microscope images showed that the product formed a porous structure. The X-ray diffraction results showed that new crystalline forms were generated. The curves from rapid viscosity analysis indicated that the product had a low viscosity, which contained a large amount of small-molecule soluble sugar.
simultaneous extrusion and enzymatic hydrolysis; corn starch; saccharifi cation
TS24
A
1002-6630(2015)18-0033-08
10.7506/spkx1002-6630-201518006
2015-04-15
“十二五”国家科技支撑计划项目(2012BAD34B07) ;吉林省重大科技攻关项目(2012ZDGG007)
丛崇(1989—),女,硕士研究生,研究方向为粮食、油脂与植物蛋白工程。E-mail:xcpyfzx@163.com
张艳荣(1965—),女,教授,博士,研究方向为粮食、油脂与植物蛋白工程及食药用菌精深加工。
E-mail:xcpyfzx@163.com
