[11C]N-甲基乙酰唑胺PET/CT评价肝脏纤维化早期诊断的价值
2015-10-17韩婷婷赵周社郭启勇
杜 名,韩婷婷,张 新,曹 礼,赵周社,李 红,辛 军,郭启勇
(1.中国医科大学附属盛京医院放射科,辽宁 沈阳 110004;2.通用电气(中国)医疗系统集团,北京 100176)
[11C]N-甲基乙酰唑胺PET/CT评价肝脏纤维化早期诊断的价值
杜名1,韩婷婷1,张新1,曹礼1,赵周社2,李红2,辛军1,郭启勇1
(1.中国医科大学附属盛京医院放射科,辽宁 沈阳110004;2.通用电气(中国)医疗系统集团,北京100176)
目的:采用[11C]N-甲基乙酰唑胺作为PET/CT的显像剂,研究肝脏纤维化不同阶段肝组织摄取率,探讨[11C]N-甲基乙酰唑胺在评价肝脏纤维化早期诊断的价值。材料与方法:Wistar大鼠26只(雄性)、重量(29 240 g),对照组大鼠(N=8),硫代乙酰胺(TAA)成功建立肝纤维化模型大鼠(N=18),其中轻度肝纤维化(S1,N=10)及肝中重度纤维化(S2+S3,N=8)。以[11C]N-甲基乙酰唑胺为显像剂,先对大鼠进行PET/CT动态扫描,选择存活大鼠再以乙酰唑胺为抑制剂进行抑制实验。实验结束后大鼠处死、取材。每次扫描结束后进行数据重建,分别计算不同时间点(20 s、90 s、5min、10min、20min、30min和45min)肝脏标准摄取值(SUV),分析比较其与病理结果之间的联系及相关性。结果:对照组与实验组90 s、5min、10min SUV值具有显著性差异;实验组组内各时间点SUV值无显著性差异。实验组SUV值与病理免疫组化结果之间具有良好相关性。对照组抑制实验呈阳性结果,而实验组抑制实验呈阴性结果,且随肝纤维化程度加重,抑制效率减低。结论:[11C]N-甲基乙酰唑胺PET/CT肝脏显像能够用于检测早期纤维化时功能受损,进而评估肝纤维化的严重程度,对肝脏纤维化分期。
肝硬化;乙酰唑胺;正电子发射断层显像术
肝纤维化是肝内纤维结缔组织的异常增生与沉积,是各种慢性肝病向肝硬化发展的必经阶段,其发生与发展伴随肝内血管、肝组织细胞功能的变化。水通道蛋白(Aquaporin,AQP)分布于全身不同脏器,介导不同类型细胞膜上跨膜水分子转运[1-2]。学者研究发现AQP1在肝脏纤维化的过程中,通过提高内皮侵袭,促进肿瘤血管的生成[3]。肝脏组织中肝细胞上AQP随着肝脏纤维化程度不同,AQP表达也随之发生变化。目前,研究认为早期肝纤维化可以实现逆转。PET/CT将解剖图像与功能成像相融合,可从分子水平无创、定量测定人体内代谢变化,具有很高的敏感性。有报道乙酰唑胺能够与AQP1、AQP4特异性结合,本研究采用全自动化方法合成[11C]N-甲基乙酰唑胺后,对大鼠肝脏纤维化模型进行PET/CT成像,观察大鼠在不同阶段肝纤维化过程中对[11C]N-甲基乙酰唑胺的摄取,进而评价其在早期纤维化中的诊断价值。
1 资料与方法
1.1实验对象及模型建立
健康Wistar大鼠(中国医科大学附属盛京医院动物部),雄性26只,重量平均29 240 g。随机分为对照组(n=8)及实验组(n=18)。实验组建立肝纤维化模型:硫代乙酰胺(TAA)灭菌注射水配制成质量浓度40mg/mL的溶液,每周3次 (每周1、3、5)按300mg/kg予对照组大鼠腹腔注射,注射药物前称重记录,按照以下方法调整模型剂量:①较前次体质量下降5%以内者维持原用量;②较前次体质量下降5%~10%者用量减少100mg/kg;③较前次体质量下降10%以上暂停注射,待体质量停止下降,再调整用量,以避免死亡;④大鼠体质量连续增加5%以上用量增加40mg/kg。对照组正常饲养,不予处置。
1.2材料与方法
1.2.1主要材料
大鼠 AQP1抗体 (美国,Alpha Diagnostic公司),乙酰唑胺(美国,Sigma/Aldrich公司),TAA,本院使用GE公司MINItrace II和TracerLab FXc全自动化合成[11C]N-甲基乙酰唑胺。
1.2.2[11C]N-甲基乙酰唑胺合成方法
利用TRACERlab FXC pro合成仪平台,碱性条件下[11C]CH3I与乙酰唑胺在80℃条件反应。然后以磷酸缓冲液为淋洗液,通过高性能液体色谱(High performance liquid chromatography,HPLC)分离获得[11C]N-甲基乙酰唑胺。合成效率50%以上、放射化学纯度>98%。
1.2.3[11C]N-甲基乙酰唑胺PET/CT扫描
实验前动物禁食禁水12 h,实验对象10%水合氯醛麻醉,取大鼠仰卧位固定,建立鼠尾静脉通路,注射 [11C]N-甲基乙酰唑胺,放射性活度(0.4± 0.12)mCi/mL,体积(1.0±0.2)mL,采用GE Discovery Elite PET/CT的VIP扫描模型,层厚3.25mm,进行连续动态扫描45min。存活大鼠待体内11C衰减接近本底时,进行抑制试验,同时注射0.5mL(1g/L)乙酰唑胺及[11C]N-甲基乙酰唑胺,再进行扫描。图像融合采用GE AW4.5和Xeleris 3.0工作站提供的软件完成,同时获得横断、矢状和冠状面及三维PET 及CT以及两者的融合图像。扫描结束后采用Sharp IR+VUE Point HD图像重建技术对采集图像进行重建,采用OSEM迭代重建法。以上步骤由1名医师、3名技师协作完成。
1.2.4图像分析及数据处理
通过CT定位,在融合PET/CT图像上选择肝脏感兴趣(ROI),面积20mm2,自动生成大鼠肝脏的时间放射性曲线(图1)。分别获得抑制实验前后,在注射 [11C]N-甲基乙酰唑胺后20 s、90 s、5min、10min、20min、30min和45min肝脏组织的标准摄取值(SUV),再计算肝脏摄取值变化率,公式如下所示:

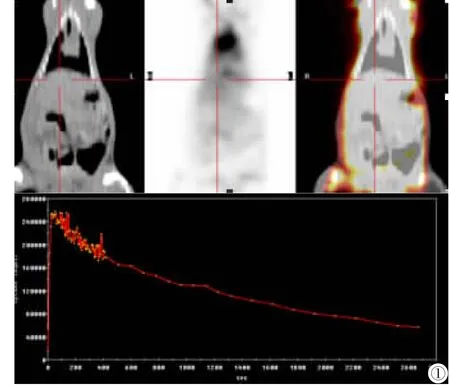
图1 ROI选取及大鼠肝脏时间放射曲线。Figure 1.Selection of ROI and the time radiation curve of rat liver.
1.3病理学分析
扫描结束后处死大鼠,进行心脏灌洗,肝中叶取材对应所取ROI,将所取标本分成两份,分别置于10%甲醛溶液中固14 d后分别行天狼星染色后于200倍光镜下观察及免疫组化AQP1染色定量分析。免疫组化具体方法如下:①切片的脱蜡;②抗原修复;③封闭内源性过氧化物;④封闭非特异性抗原;⑤染色;⑥脱水封片。染色结束后对切片进行平均光密度值计算,进行定量分析。肝纤维化分期标准采用Scheuer分类法:S0:无肝纤维化;S1:无汇管区扩大纤维化及局限窦周纤维化;S2:汇管区周围纤维化或纤维间隔形成小叶结构保留;S3:大量纤维间隔形成伴小叶结构紊乱无肝硬化;S4:早期肝硬化。实验组模型大鼠以病理结果进行分组。
1.4统计学分析
2 结果
2.1[11C]N-甲基乙酰唑胺PET/CT结果
2.1.1[11C]N-甲基乙酰唑胺在对照组大鼠动态分布以及乙酰唑胺的影响
[11C]N-甲基乙酰唑胺和[11C]N-甲基乙酰唑胺+乙酰唑胺抑制剂在对照组大鼠从尾静脉注射后各时间点体内分布(图2),肝脏摄取值见表1。实验组肝脏摄取值较对照组增高,且抑制剂使用前,90 s、5min 及10min,对照组与实验组SUV值均具有显著性差异。使用抑制剂后,虽然对照组与实验组抑制均成阳性,但无显著性差异。

图2 对照组大鼠各时间点抑制剂前后冠状面PET图像。Figure 2.PET images at each time point of the control group before and after use of inhibitors.
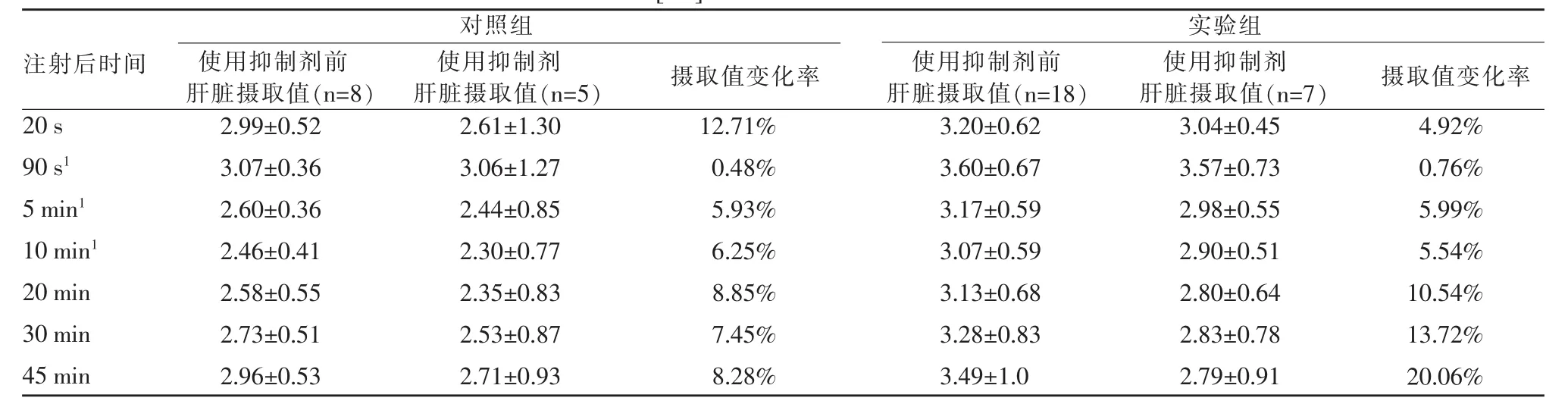
表1 对照组和实验组大鼠[11C]N-甲基乙酰唑胺PET/CT显像肝脏SUV结果
2.1.2[11C]N-甲基乙酰唑胺在实验组大鼠动态分布以及乙酰唑胺的影响
[11C]N-甲基乙酰唑胺90 s时在不同程度肝纤维化大鼠体内分布(图3);乙酰唑胺抑制剂注射前后肝脏摄取值表2。抑制剂使用前,实验组各程度纤维化大鼠SUV值见无显著性差异。使用抑制剂后,虽然抑制结果均为阳性,但无显著性差异,然而可以看出,随肝纤维化程度加重,肝脏摄取值逐渐增高,抑制率却随纤维化加重而减低。
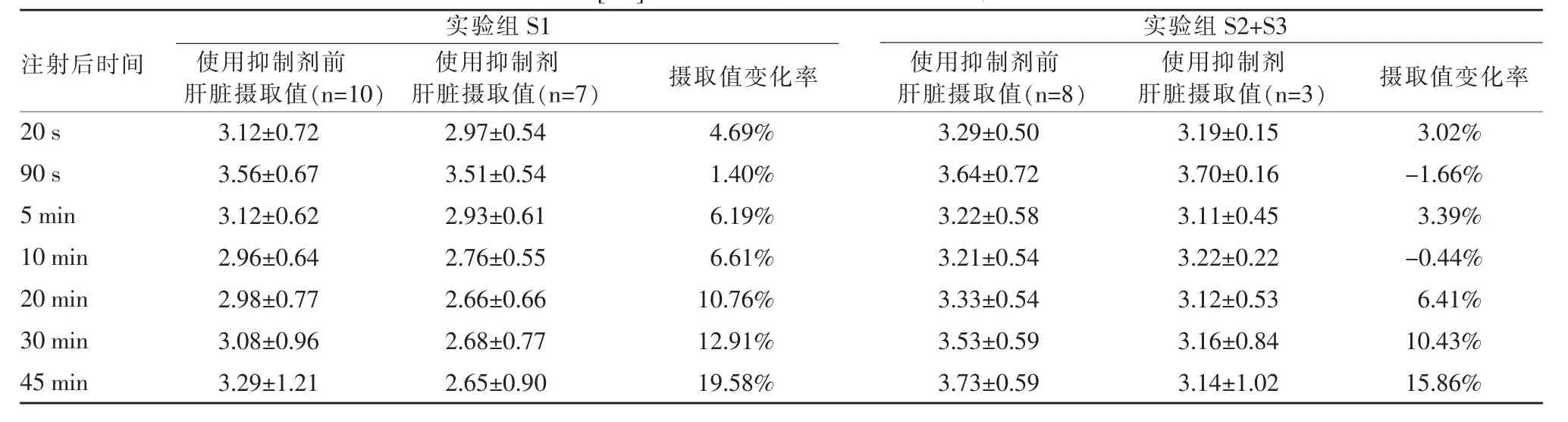
表2 实验组大鼠[11C]N-甲基乙酰唑胺PET/CT显像肝脏SUV结果

图3 不同阶段肝纤维化冠状面PET图像。Figure 3.PET images of different stages of liver fibrosis.
2.2病理学结果
肝脏纤维化S1、S2、S3期肝组织AQP1表达免疫组织如图4所示。
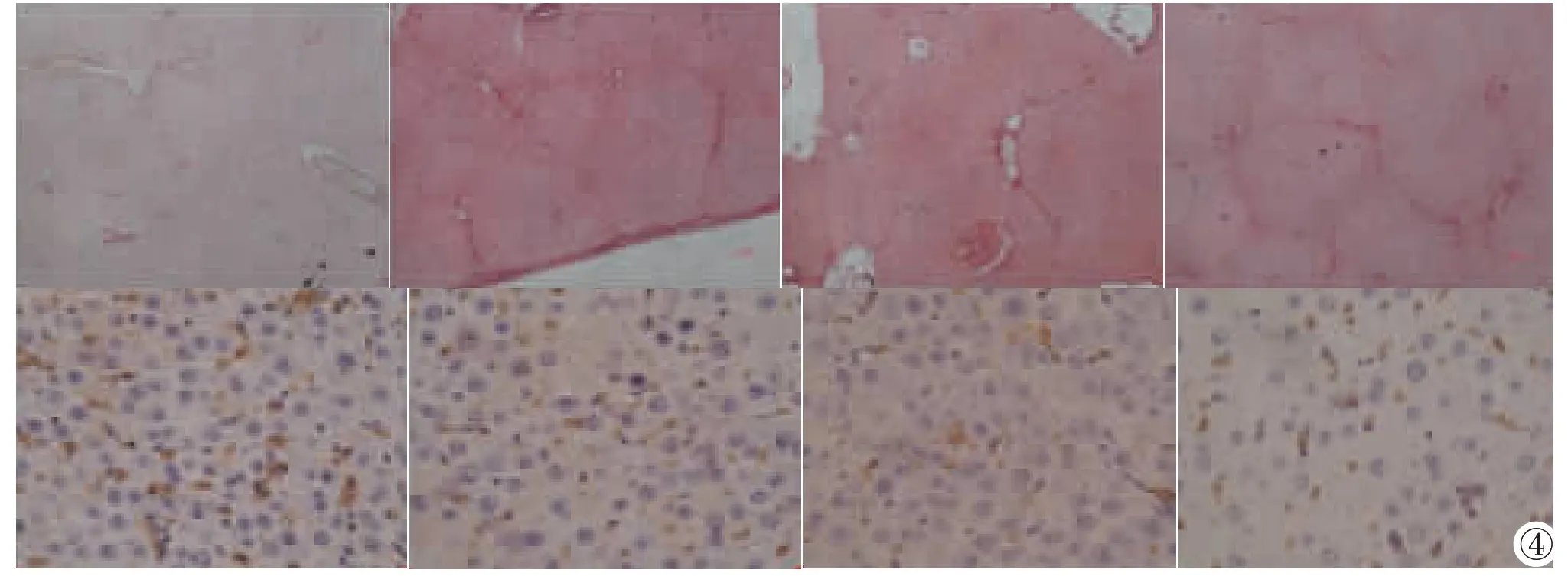
图4 各期病理与免疫组化结果。上列依次为S0~S3期大鼠天狼星染色结果。随纤维化分期进展,可见肝内胶原纤维和网状纤维数量从少到多,从稀疏到致密,分布从散在到广泛范围扩大,纤维化程度逐渐加重。下列依次为与天狼星染色对应的S0~S3期大鼠AQP1免疫组化结果。Figure 4. Pathologic and immunohistochemical results of different stages of liver fibrosis.The above section:Sirius dyeing results of S0~S3 rats.With the progress of liver fibrosis,the amount of collagen and reticular fiber in liver became increased,denser and wider.The following section:immunohistochemical results of AQP1 of S0~S3 rats.
2.3SUV值与免疫组化相关性分析
不同阶段肝纤维化大鼠用数字表示其严重程度,1:S0期,2:S1期,3:S2+S3期,使用Spearman相关性分析得出不同阶段肝纤维化与光密度值具有统计学差异,且呈正相关(P=0.023,R=0.672)(表3)。
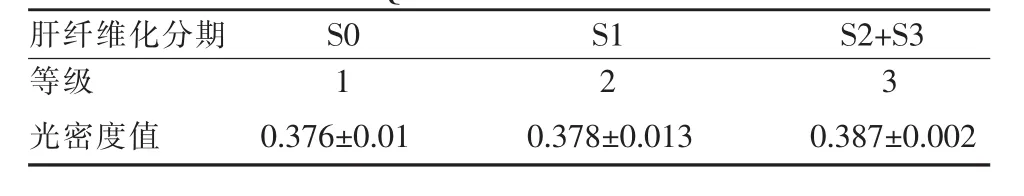
表3 大鼠肝脏纤维化模型肝脏SUV值与肝脏AQP1分子病理之间关系
3 讨论
3.1肝脏纤维化过程AQP表达改变
肝纤维化是多种原因引起的慢性肝损害所致的病理改变,表现为肝内细胞外间质成分过度异常地沉积,导致肝细胞功能受损、肝内血管的变化,正常肝 脏 内 含 有 AQP1、AQP3、AQP4、AQP7、AQP8、AQP9和AQP11[4],而AQP1主要分布在毛细血管上[5],Robert等通过研究证实,肝硬化中AQP1高表达,其原因可能是AQP增强了渗透水的渗透率,加速了成纤维细胞生长因子诱导的肝窦内皮细胞膜的皱缩,从而在肝硬化的过程中带动了侵入和病理性血管生成[2]。
3.2[11C]N-甲基乙酰唑胺PET/CT在肝脏纤维化诊断的价值
目前认为早期肝纤维化尚有逆转为正常的可能。PET提供详尽的功能与代谢等分子信息,对病变更加灵敏、准确、特异。11C-AQP[6]作为特异性受体,与AQP1结合,其表达的增高间接反映了AQP的改变。本研究中发现肝脏纤维化过程中,SUV值显著增加 (90 s:Z=-2.11,P=0.035;5 min:Z=-2.167,P= 0.03;10min:Z=-2.444,P=0.015),而不同分期肝纤维化之间SUV值尚无统计学意义。SUV值代表AQP1表达程度具有良好相关性,因此我们认为肝纤维化过程中,可以通过[11C]N-甲基乙酰唑胺PET/ CT显像早期发现。
关于AQP抑制剂乙酰唑胺的抑制效果意见不一。Wang等学者研究得出乙酰唑胺对AQP1、AQP3 及AQP4具有抑制作用[7]。李加慧等通过实验室研究验证乙酰唑胺抑制作用的同时,得到了最低有效剂量[8]。此后韩婷婷等在此基础上,通过NH3·H20 PET/CT成像也得到了同样的结论,并且证实水分子通过毛细血管与组织间隙并非依靠简单的自由扩散,而是通过AQP介导[9]。本实验中,使用乙酰唑胺后,对照组与实验组中大鼠肝脏SUV明显减低,抑制结果为阳性,且随肝脏纤维化程度的加重,乙酰唑胺抑制率逐渐减低,这可能是肝纤维化过程中不仅伴随着AQP数量的改变,其亲和力可能也发生着改变。对照组与实验组中肝脏摄取率为阳性,即乙酰唑胺可以有效抑制,而在实验组中,随肝脏摄取值增高,肝脏摄取率逐渐下降,其原因可能有如下几种情况:①毛细血管代偿能力。轻度肝纤维化时(S1),虽然毛细血管受损,但其还具有一定的代偿能力,但中度度肝纤维化(S2~S3)时,毛细血管代偿能力有限,肝脏结构发生明显改变,乙酰唑胺抑制率减低。②AQP自身亲和力的减低造成的。肝脏纤维化虽然伴随着AQP数量的增加,然而亲和力可能减低,使其与抑制剂乙酰唑胺结合力减低,导致相同剂量的乙酰唑胺抑制效率减低。③随着肝纤维化的发展,肝内的AQP的种类发生了改变。肝脏内不仅存在如上所述的AQP1、AQP3、AQP4,还有AQP8、AQP9、AQP11。乙酰唑胺对1、3、4具有抑制作用,然而对8、9、11的抑制作用尚无定论,因此,依据本实验结果我们推测,利用乙酰唑胺抑制试验可以鉴别不同分期肝脏纤维化严重程度。
本研究存在局限性:①实验数据存在一定的重叠性。②本实验主要研究肝脏内 AQP1、AQP3、AQP4,但实际肝脏内还存在其他种类 AQP,如AQP8、AQP9、AQP11等,受体显像及抑制试验存在一定的局限性。③本实验研究大鼠模型的数量有限,而且并未增加S4期模型,将在今后实验研究中进一步补充。④大鼠肝脏纤维化模型与人类肝纤维化发生与发展存在一些差别,因此该方法应用于临床还需要进一步验证。
综上所述,[11C]N-甲基乙酰唑胺PET/CT显像能够用于检测早期纤维化时功能受损,进而评估肝纤维化的严重程度。
[1]郭昊,李学军.细胞膜上的水通道-2003年诺贝尔化学奖工作介绍[J].生理科学进展,2007,38(3):283-289.
[2]Agre P.Aquaporin water channels[J].Biosci Rep,2004,24(3):127-163.
[3]Robert H,Meher V,Uday S,et al.Aquaporin-1 facilitates angiogenic invasion in the pathological neovasculature that accompanies cirrhosis[J].Hepatology,2010,52(1):238-248.
[4]Benga G.Water channel proteins(later called aquaporins)and relatives:past,present,and future[J].IUBMB Life,2009,61(2):112-133.
[5]郭启勇,辛军,张新,等.MRI水扩散加权成像分子机理研究进展[J].中国临床医学影像杂志,2013,24(7):496-500.
[6]曹礼,杜名,张新,等.[11C]标记水通道蛋白抑制显像剂全自动合成方法[J].中国临床医学影像杂志,2014,25(5):344-403.
[7]Wang F,Feng XC,Li YM,et al.Aquaporins as potential drug targets[J].Acta Pharmacologica Sinica,2006,27(4):395-401.
[8]李加慧,李秋菊,于兵,等.DWI-MRI多b值水通道蛋白分子成像机理和方法学研究[J].中国临床医学影像技术,2014,25(3):186.
[9]韩婷婷,杜名,张新,等.13N-NH3H2O PET/CT在大鼠肝纤维化模型成像定量研究[J].中国临床医学影像技术,2014,25(4):243-247.
Evaluation of[11C]N-methyl acetazolam ide PET/CT in early diagnosis of liver fibrosis
DU Ming1,HAN Ting-ting1,ZHANG Xin1,CAO Li1,ZHAO Zhou-she2,LI Hong2,XIN Jun1,GUO Qi-yong1
(1.Department of Radiology,Shengjing Hospital of China Medical University,Shenyang 110004,China;2.General Electric Company Healthcare(China),Beijing 100176,China)
Objective:The[11C]N-methyl acetazolamide([11C]N-MAC),as the imaging agent,was used to study the uptake rate of liver tissue in different stages of liver fibrosis by PET/CT,and then to investigate its value in evaluating early diagnosis of liver fibrosis.Method:Twenty-six Wistar rats(male,29 240 g weight)were included with 8 in the control group and 18 in the test group(mild liver fibrosis,S1,N=10 and severe liver fibrosis,S2+S3,N=8).Liver fibrosis was induced by thioacetamide(TAA).After PET/CT dynamic scanning with[11C]N-MAC,the mice which were alive in the second day,continued to receive inhibition test with acetazolamide.Data reconstruction was accomplished after scanning.The standard uptake value (SUV)of the liver at 5 s,20 s,90 s,5min,10min,20min,30min and 45min were calculated to analyze its correlation with pathological results.Results:The SUVs at different time points(90 s,5 min,10 min)of the control group and test group showed significant correlation.But there was no significant correlation between different stages of liver fibrosis.There was good correlation between the SUV values in the test group and the pathological results of immunohistochemistry.The results of inhibition tests were positive for the control group and negative for the test group.With the aggravation of hepatic fibrosis,the inhibiting efficiency decreased.Conclusion:The[11C]N-MAC PET/CT is a promising tool to detect the early tendency of liver fibrosis by the level of SUV values and then to distinguish the stages of liver fibrosis.
Liver cirrhosis;Acetazolamide;Positron-emission tomography
R657.3;R817.4
A
1008-1062(2015)03-0183-05
2014-07-28;
2014-09-16
杜名(1988-),男,辽宁丹东人,在读硕士研究生。
辛军,中国医科大学附属盛京医院放射科,110004。
国家自然科学基金(81471718、81271566);辽宁省自然科学基金(2014021088)。
