甲巯咪唑的电化学行为及其与DNA相互作用的研究
2015-10-16杜芳静罗贤文李晓霞
杜芳静, 罗贤文, 李晓霞*
(延安大学化学与化工学院,陕西延安 716000)
甲巯咪唑(Thimazole,TMZ)是临床上治疗人甲状腺机能亢进症的常用药物,但过量服用会引发肾炎、肝硬化、皮肤过敏和咽炎发烧等[1]。因此,建立简单、快速、灵敏测定TMZ的方法十分重要。目前测定TMZ的方法有可见分光光度法[2,3]、萃取浮选法[4]、高效液相色谱法[5,6]及电化学分析法[7 - 9]等。采用电化学分析法已分别研究了TMZ在聚四氨基钴酞菁膜修饰玻碳电极上、血红素修饰碳糊电极上及酞菁钴修饰碳糊电极上的电化学行为。碳纳米管因其良好的电化学性能被广泛用于药物、蛋白和DNA等的分析中。
生物体的正常生命活动及突变、癌变等异常生命活动均与DNA密切相关。药物分子与DNA通过各种模式的相互作用方式,影响到基因的调控和表达,因此,研究药物分子与DNA的相互作用具有实际意义[10]。本文研究了TMZ在多壁碳纳米管修饰玻碳电极(MWNTs/GCE)上的电化学行为,建立了测定TMZ的电化学分析新方法。采用线性扫描伏安法(LSV)和紫外光谱法研究了TMZ与DNA之间的相互作用,计算了两者的结合比及结合常数。所建立的方法简单、快速、灵敏,可望用于实际药物的分析检测。
1 实验部分
1.1 仪器与试剂
CHI660E电化学工作站(上海辰华仪器公司),三电极系统:工作电极为多壁碳纳米管/玻碳电极(MWNT/GCE)或玻碳电极(GCE),参比电极为饱和甘汞电极(SCE),对电极为铂丝。紫外-可见分光光度计(日本,岛津公司)。
多壁碳纳米管(MWNTs,纯度>95%,深圳纳米港)。甲巯咪唑(TMZ)标准储备溶液:准确称取TMZ标准品(中国药品生物制品检定所)0.0571 g,溶于水,定容于100 mL棕色容量瓶中,浓度为5.0 mmol/L,于阴冷处避光保存。鲱鱼精DNA(hsDNA,上海伯奥),其纯度计算参考文献方法[10]。
1.2 实验方法
GCE的预处理和MWNTs的酸化处理分别参考文献方法[11]。称取3 mg处理好的MWNTs,加入3 mL N,N-二甲基甲酰胺(DMF)中,超声分散2 h形成悬浊液。吸取5 μL 1 mg/mL悬浮液滴涂在处理好的GCE上,晾干即得MWNTs/GCE。
先将MWNTs/GCE在pH=7.0的磷酸盐缓冲液(PBS)中进行循环伏安(CV)扫描(0~0.6 V),直至曲线稳定为止。然后置于不同浓度的TMZ溶液中,记录0~0.6 V范围的CV曲线和LSV曲线。在研究TMZ与DNA的相互作用时, 固定TMZ的浓度为50 μmol/L,加入不同浓度的DNA进行分析。最后固定DNA的浓度为10 μmol/L,加入不同浓度的TMZ,进行结合比、结合常数测定。紫外光谱的测定参照文献方法[12]。
2 结果与讨论
2.1 TMZ在MWNT/GCE上的电化学行为及其分析测定
2.1.1TMZ的电化学行为图1为GCE和MWNTs/GCE在PBS(pH=7.0)和TMZ溶液中的循环伏安图。由图中曲线a和d可以看出,在电位0~0.6 V范围,GCE和MWNTs/GCE在PBS中未发现任何峰。GCE分别在300 μmol/L(曲线b)和500 μmol/L(曲线c)TMZ溶液中扫描时,在0.31 V处有一不可逆氧化峰,且随TMZ浓度的增大峰电流变大。 MWNTs/GCE分别在300 μmol/L(曲线e)和500 μmol/L(曲线f)TMZ溶液中扫描时,在0.29 V处有一不可逆氧化峰。比较曲线e、f和b、c发现,TMZ在MWNT/GCE上的氧化峰较裸GCE上负移100 mV,氧化峰电流增大约4倍。分别将MWNTs/GCE和GCE进行循环伏安和电化学阻抗表征,结果表明,MWNTs/GCE在[Fe(CN)6]3-/4-溶液中的电位差△E和电化学阻抗Ret值,较GCE明显降低,表明修饰电极能提高电子的传递。根据Randles-Sevcik方程,测定出MWNTs/GCE有效面积是GCE的2.1倍,说明修饰MWNTs明显增加了电极的有效面积,使得电极的导电性增强,TMZ在修饰电极上更易被催化氧化。
2.1.2多壁碳纳米管滴涂量的选择MWNTs/GCE上MWNTs的滴涂量影响待测物质的电化学响应。实验考察了MWNTs的滴涂量在2~10 μL之间对电化学信号的影响。研究发现,当滴涂量为8 μL时,TMZ的氧化峰电流达到最大。继续增大滴涂量,TMZ峰电流略有减小。因此,实验中选择8 μL为最佳滴涂量。
2.1.3底液及pH的选择研究了TMZ在B-R缓冲溶液、PBS、NaOH溶液等不同底液中的电化学行为。结果发现TMZ在PBS中峰形最好。因此,本实验选择PBS为底液。考察TMZ在pH=5.8~8.0的PBS中的LSV图(图2),发现TMZ的峰电位随pH的增大而逐渐负移,峰电流随pH的变化,分别在pH为6.0 和7.0 时出现了两个峰电流极大值,可能此条件下TMZ开始大量以Rs-形式存在,更易发生氧化,因而峰电流突然增大,这一结果与文献报道[8]一致。实验选择pH=7.0的PBS为底液。同时发现TMZ的峰电位随着pH的增大负移,说明有质子参与TMZ的氧化反应。TMZ的峰电位E与pH呈良好的线性关系,线性方程为:Epa=-33.38pH+555.31,r=0.9951,斜率为33.38 mV/pH。将测定斜率值33.38 mV/pH 与理论斜率59.2 mV/pH相比较可知,TMZ的氧化反应是等电子对应等质子的反应[12]。
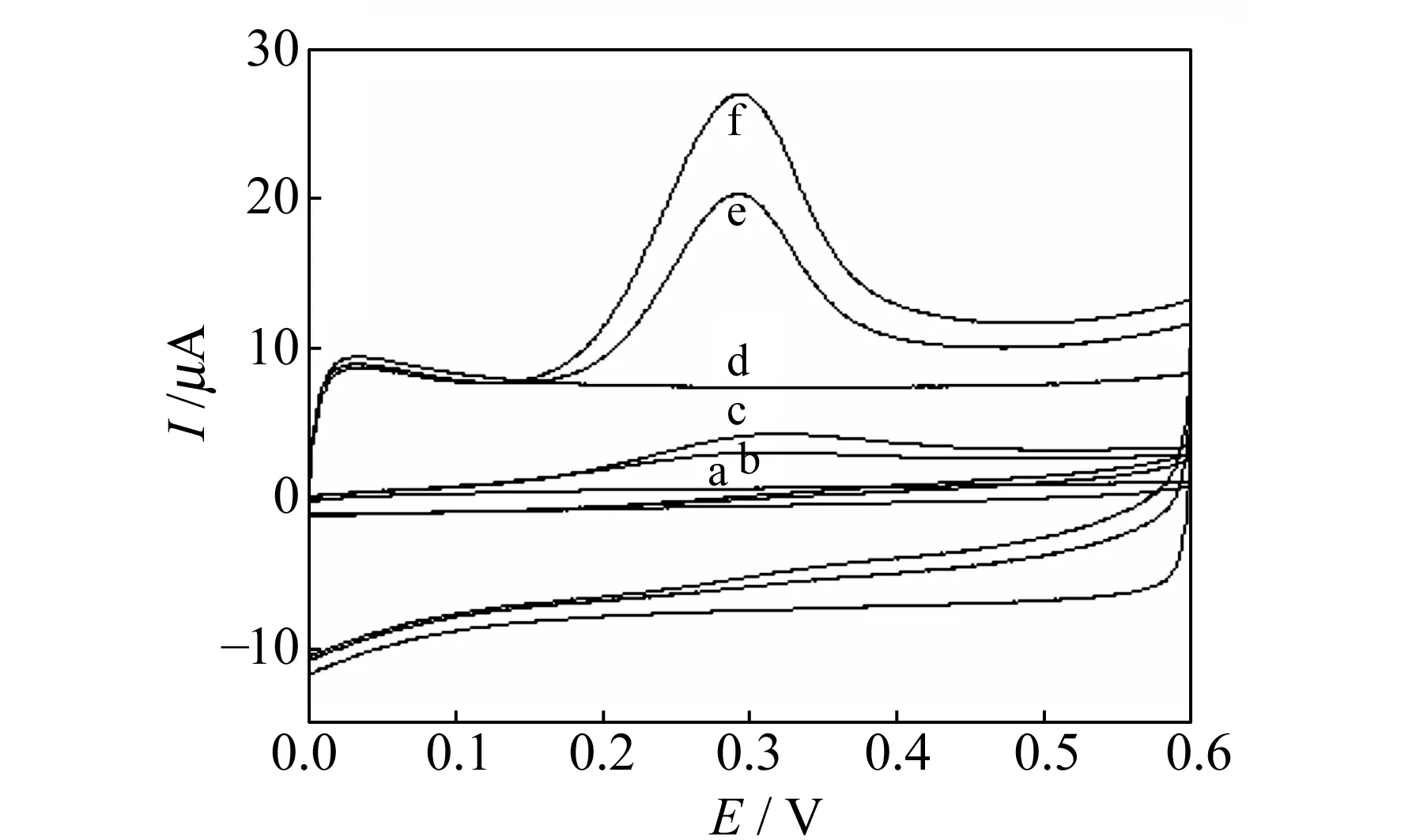
图1 甲巯咪唑在裸GCE(a、b、c)和MWNTs/GCE(d、e、f)上的循环伏安图Fig.1 Cyclic voltammograms of TMZ on bare GCE(a,b,c) and MWNT/GCE (d,e,f) in pH=7.0 PBSa,d:cTMZ =0;b,e:cTMZ=300 μmol/L;c,f:cTMZ=500 μmol/L;scan rate:100 mV/s.
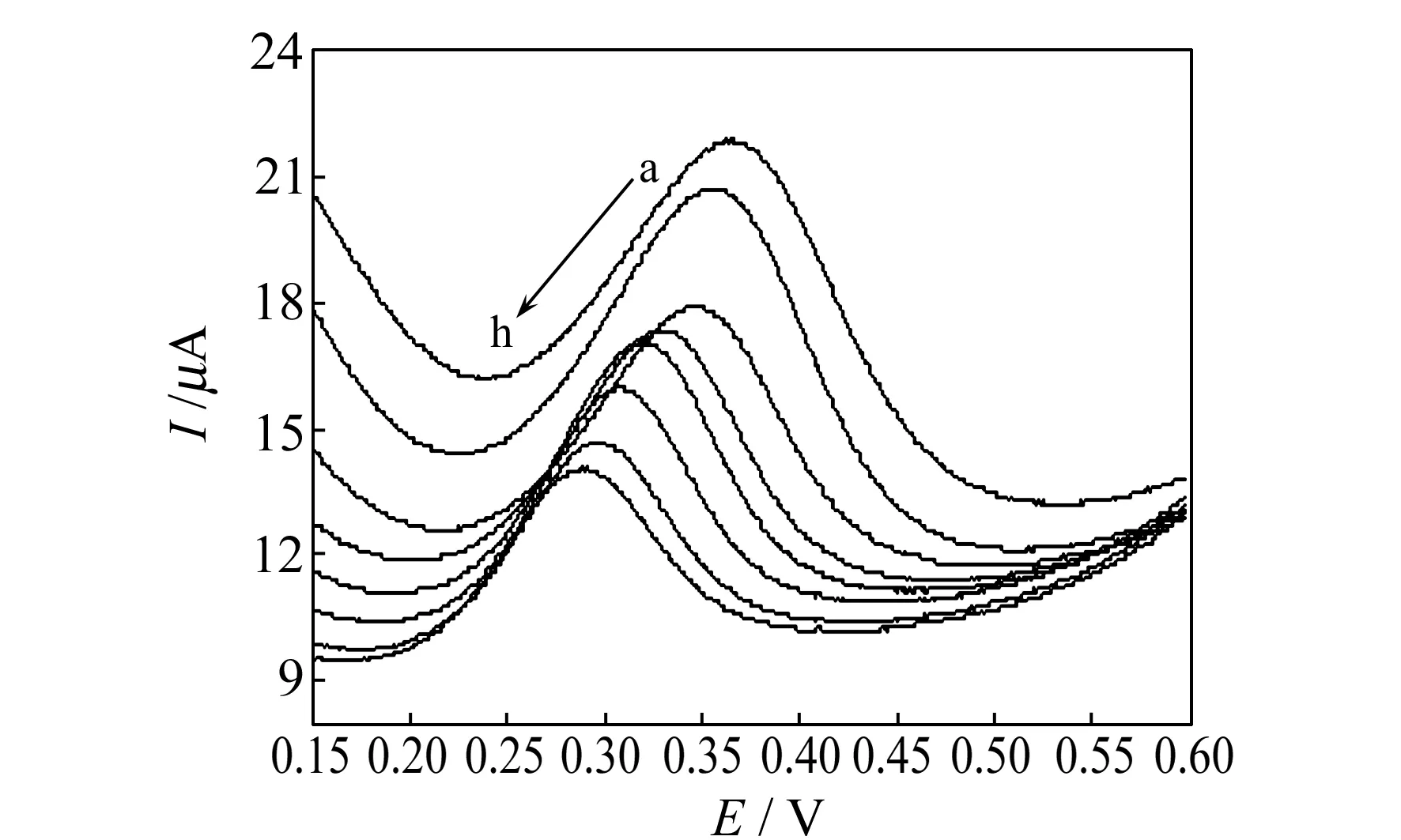
图2 不同pH值下TMZ的线性扫描伏安图Fig.2 Linear sweep voltammograms of 100 μmol/L TMZ obtained in different pH buffer solutiona-h:pH:5.8,6.0,6.2,6.6,7.0,7.4,7.8,8.0.

图3 不同扫速下TMZ在MWNTs/GCE上的循环伏安图;内插图为峰电流(a)和峰电位与扫速的关系曲线Fig.3 Cyclic voltammograms of 300 μmol/L TMZ obtained in PBS (pH=7.0) at different scan rates from 50~400 mV/s at the MWNTs/GCE;Insert:the linear relationship with scam rate of peak currents(a) and peak potential(b)
2.1.4扫速的影响考察了扫描速度对TMZ峰电流及峰电位的影响。从图3可以看出,峰电流和峰电位均随扫速的增加而增大。扫速v在50~400 mV/s范围,TMZ的峰电位Ep与lnv1/2呈线性关系,线性方程为:Ep(V)=0.126+0.0138lnv1/2,r=0.9954。TMZ的峰电流Ipa与v1/2呈良好的线性关系,其线性方程为:Ipa(μA)=2.57v1/2-11.05,r=0.9992,表明TMZ在MWNT/GCE上的电化学氧化过程是受扩散控制的电极反应过程,计算出修饰电极在TMZ溶液中的扩散系数为9.12×10-8cm2/s。根据电化学动力学原理[13],以lgIpa对lgc作关系曲线,线性方程为:lgIpa=1.027lgc-0.6587(r=0.9950)。斜率为1.027,接近1,表明TMZ在MWNT/GCE上的氧化反应为准一级反应。实验中选择扫速为100 mV/s。
2.1.5工作曲线和检出限在优化实验条件下,利用MWNTs/GCE对TMZ进行测定。图4为不同浓度的TMZ在MWNTs/GCE上的LSV图。TMZ的氧化电流Ipa与其浓度c在3.0~100 μmol/L范围内呈良好的线性关系,线性方程为:Ipa(μA) =-0.1019+0.2501c(mol/L),r=0.9988,检出限(S/N=3)为1.0 μmol/L。同一支修饰电极对30 μmol/L的TMZ平行测定11次,相对标准偏差为3.3%,表明该修饰电极具有良好的重现性。
2.2 TMZ与hsDNA相互作用的研究
基于TMZ的电化学行为,研究了TMZ与DNA的相互作用。图5为MWNT/GCE在TMZ溶液及加入了不同浓度DNA溶液中的LSV图。结果发现,在0.1~0.6 V范围内TMZ有一不可逆氧化峰,加入DNA后未见新峰,但是TMZ的峰电流明显降低,峰电位略有正移(Ep=0.335 mV→Ep=0.336 mV,△E=1 mV)。在50~200 mV/s扫速范围内,研究扫速与峰电流的关系。发现存在DNA时,峰电流与扫速的平方根成正比,表明该电极过程也受扩散控制。 根据扫速与TMZ-DNA峰电流的关系:Ipa(μA)=0.22v1/2-0.69(v,mV/s),计算出MWNTs/GCE在TMZ-DNA溶液中的扩散系数为2.67×10-8cm2/s。与TMZ溶液相比(9.12×10-8cm2/s),TMZ-DNA溶液中的扩散系数减小,表明TMZ与DNA发生了嵌插作用,形成了TMZ-DNA复合物,由于复合物的相对分子质量较大,引起扩散系数减小,峰电流降低[14]。
测定了DNA、TMZ及TMZ-DNA体系在200~400 nm波长范围的紫外吸收光谱(图6),260 nm 处有DNA的吸收峰(曲线a),TMZ的吸收峰波长为251 nm(曲线b)。加入DNA 后TMZ的波长略有红移(λ=252 nm)且吸光度值增加,为红移增色效应。根据Long理论,增色效应、红移现象是该物质与DNA发生了嵌插作用。说明TMZ嵌插入到DNA双链之间,引起碱基之间的疏水作用力和范德华力发生改变,影响了DNA构象与结构的稳定,从而引起紫外光谱红移增色[15]。此结论与本实验电化学研究结果一致。
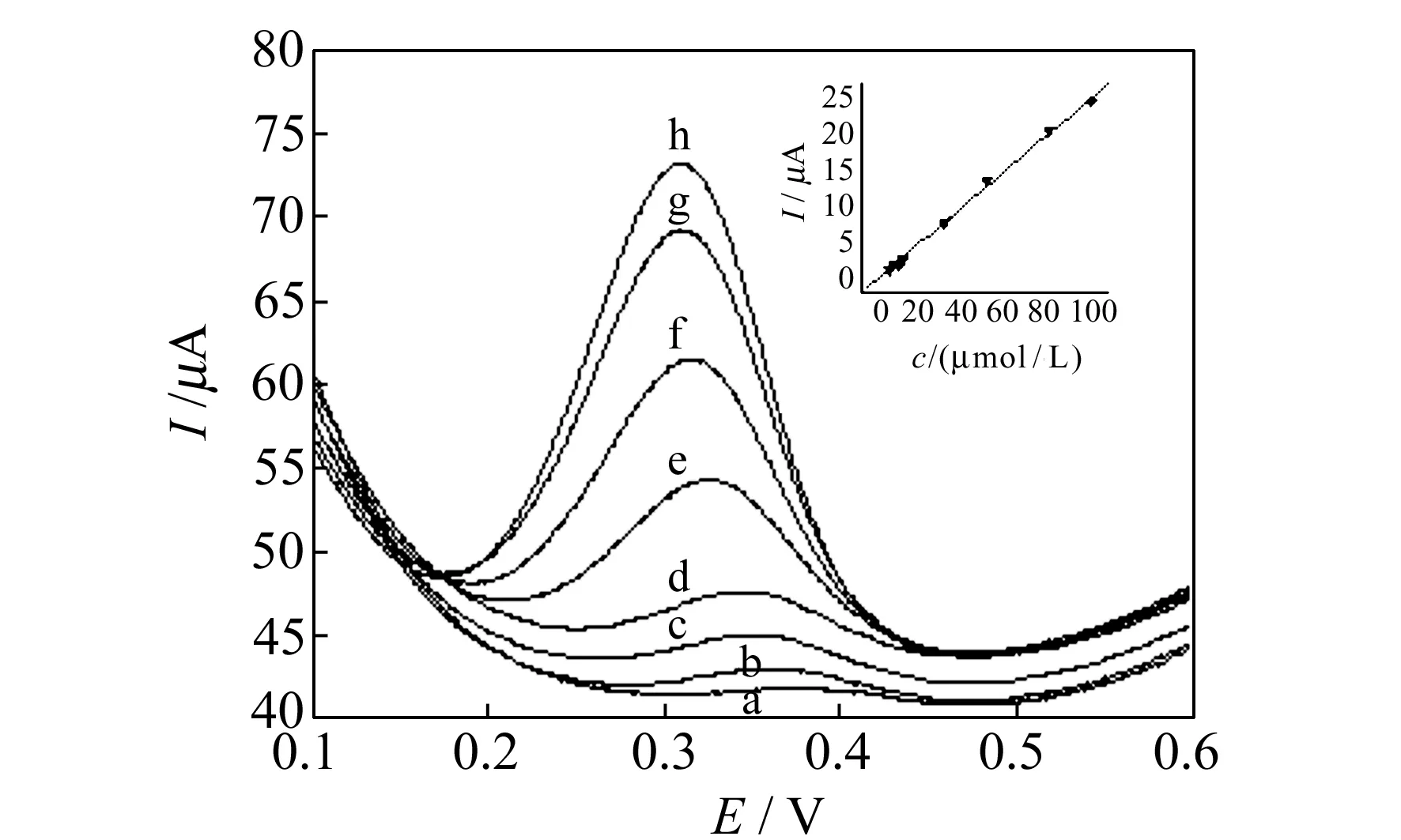
图4 TMZ在MWNT/GCE上的线性扫描伏安图Fig.4 Linear sweep voltammograms of TMZ at MWNT/GCE in PBScTMZ:a.3 μmol/L;b.5 μmol/L;c.8 μmol/L;d.10 μmol/L;e.30 μmol/L;f.50 μmol/L;g.80 μmol/L;h.100 μmol/L.Inser:the resulting calibration curve.

图5 TMZ与DNA作用的线性扫描伏图Fig.5 Linear sweep voltammograms of interaction between TMZ and herring sperm DNAcTMZ=50.0 μmol/L;a.cDNA=0;b.cDNA=5.0 μmol/L;c.cDNA=10.0 μmol/L.
实验中利用LSV法考察并计算了TMZ与hsDNA的结合数m和结合常数b[16,17]。固定DNA浓度为10 mmol/L,改变TMZ浓度得到峰电流的变化曲线,图7中曲线a,b分别为加入DNA前后的峰电流Ip与TMZ浓度的关系曲线;曲线c为a和b的峰电流差值△Ip与TMZ浓度的关系曲线。假定TMZ与DNA只形成一种简单的缔合物DNA-mTMZ,则反应式为:

经推导可得到:
lg[△Ip/(△Ipmax-△Ip)] =lgβ+mlgcTMZ
式中,△Ipmax为加入DNA前后TMZ峰电流差值(△Ip)的最大值(△Ipmax=2.52 mA)。
若TMZ和DNA只形成单一缔合物,则lg[△Ip/(△Ipmax-△Ip)]~lgcTMZ的关系曲线应为一直线。如图7,线性方程为:lg[△Ip/(△Ipmax-△Ip)]=6.997+1.54lgcTMZ(c,mol/L),r=0.9968;由曲线斜率求得结合数m≈2,由截距求得b=9.93×106L/mol,表明DNA与TMZ形成1∶2型缔合物。

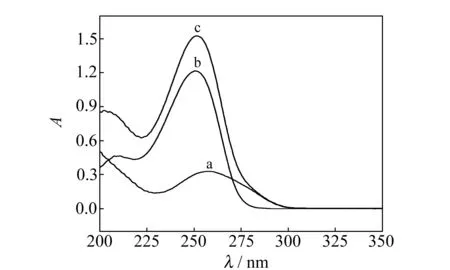
图6 紫外吸收光谱 Fig.6 UV absorption spectra PBS(pH=7.0);a.cDNA=50.0 μmol/L;b.cTMZ=50.0 μmol/L; c.cTMZ=50.0 μmol/L.cDNA=50.0 μmol/L.
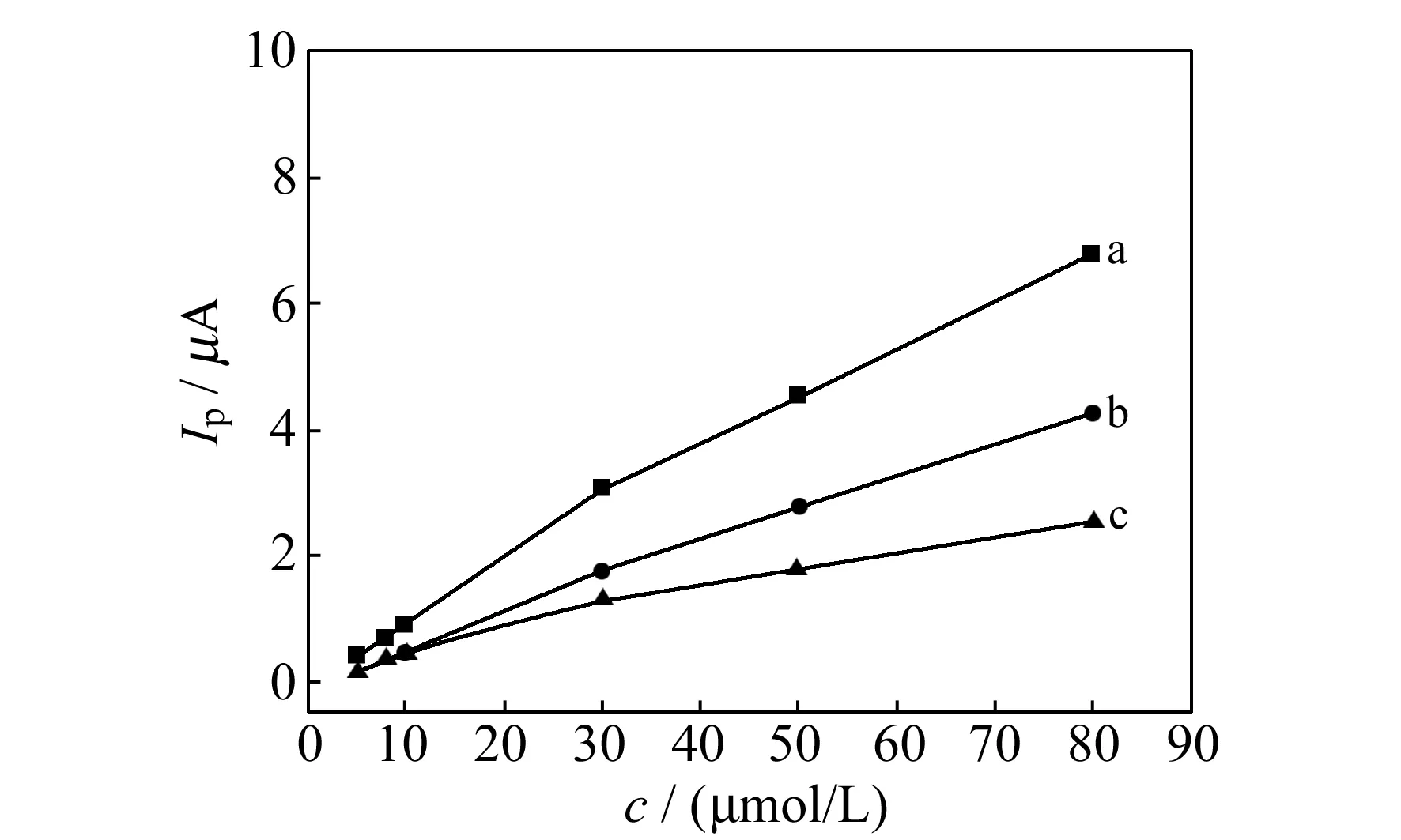
图7 DNA加入前(a)与加入后(b)Ip与cTMZ及△Ip与cTMZ(c)的关系曲线图Fig.7 The relationship of Ip with cTMZ before (a) and after (b) the addition of DNA and of △Ip with cTMZ(c)
3 结论
本文基于多壁碳纳米管修饰玻碳电极研究了TMZ的电化学行为,并建立了快速灵敏测定TMZ的电化学分析新方法,对TMZ与DNA的相互作用进行了探索。与裸玻碳电极相比,多壁碳纳米管修饰电极上TMZ的峰电流显著提高。hsDNA与TMZ发生嵌插作用,结合形成1∶2型的嵌合物,其结合常数β为9.93×106L/mol。
