抗褐化剂对荻外植体褐化和愈伤组织生长的影响
2015-10-14彭思佳丁力刘清波陈智勇肖亮易自力蒋建雄
彭思佳 丁力 刘清波 陈智勇 肖亮 易自力 蒋建雄
摘要:以荻(Miscanthus sacchariflorus)幼穗和诱导出的愈伤组织为材料探讨抗褐化剂聚乙烯吡咯烷酮(PVP)、抗坏血酸(Vc)、柠檬酸(CA)对外植体和愈伤组织抗褐化作用,以及愈伤诱导率及愈伤生长速度的影响。结果表明,3种抗褐化剂都能抑制外植体和愈伤组织褐化,并提高愈伤组织诱导率。添加0.2 g/L PVP时荻外植体的褐变程度最低,0.2 g/L CA时愈伤组织诱导率最高,为91.1%,向愈伤组织继代培养基中添加0.2 g/L的Vc愈伤组织重量增加倍数最高,为21.38倍,且愈伤组织褐化率低为25.8%。
关键词:荻;抗褐化剂;褐化;愈伤生长
中图分类号:Q 946文献标识码:A文章编号:10095500(2015)05000706
收稿日期:20150423; 修回日期:20150510
基金项目:国家863计划项目(2012AA10180104)资助
作者简介:彭思佳(1990),女,土家族,湖南保靖人,在读硕士研究生。
Email:psj0945@163.com
蒋建雄为通訊作者。
荻(Miscanthus sacchariflorus)系禾本科黍亚科芒属多年生的C4植物,具有生长速度快、生物质产量高、纤维品质好、适应性广等优良特点[1]。荻主要分布于我国长江以北的广大地区,野生资源数量及遗传多样性丰富。在北方干旱、半干旱地区,利用荻干物质发展生物质能源产业具有广阔的前景[2,3]。芒属植物为高度自交不亲和植物,有性繁殖后代个体间变异较大,因此,生产上荻的种苗繁殖主要采用扦插、分蔸等无性繁殖方式[4,5],但是,这些无性繁殖方法的繁殖系数有限,育种缓慢[6],满足不了产业发展的需求,而植物组织培养技术不仅种苗繁殖系数大、可实现规模化生产,并且也是进一步开展多倍体诱导和转基因领域研究的基础。
荻的外植体在离体培养过程中极易褐化,会影响愈伤组织的诱导和生长,严重时导致死亡。在植物组织培养中的褐化现象主要由酶促褐变引起[7],目前已知过氧化物酶(POD)和多酚氧化酶(PPO)在酶促褐化过程中起主要作用,当组织中多酚氧化酶被激活,酚类物质将被氧化形成褐色的醌类物质[8,9]。在植物组织培养过程中通过采取措施,例如添加抗氧化剂、对外植体材料进行前处理和及时更换新鲜培养基等可以防止或减缓褐化现象,其中添加适宜的抗褐化剂既能抑制褐化也有利于愈伤组织生长[10]。试验以荻幼穗和愈伤组织为试验材料,研究不同抗褐化剂对荻愈伤组织诱导及继代的影响,旨在筛选能提高愈伤组织诱导率和生长率的最佳抗褐化剂,以期建立高效的无性繁殖体系,为今后开展多倍体诱导、转基因和体细胞诱变等遗传改良和种质创新研究奠定基础。
1材料和方法
1.1试验材料
试验材料采自河北井陉的野生二倍体荻,现种植于湖南农业大学芒属植物资源圃,于秋季采荻孕穗期新鲜幼穗作为外植体。
1.2方法
1.2.1外植体的准备晴天上午10∶00取颖花原基形成期和花粉母细胞形成期(旗叶抽出长度2~3 cm时)大小一致的幼穗于4℃冰箱避光冷藏。24 h后取出幼穗,剥去叶鞘和外层苞叶,保留旗叶。在无菌环境下用浓度为75%的酒精擦拭幼穗表面,再用0.1%(w/v)升汞灭菌15 min,最后用无菌水清洗4~5次[11-13]。
1.2.2培养基愈伤组织诱导培养基MS+2 mg/L 2,4D+0.5 mg/L 6BA+30 g/L蔗糖+7 g/L琼脂粉。愈伤组织继代培养基MS+2 mg/L 2,4D+0.1 mg/L 6BA+30 g/L蔗糖+7 g/L琼脂粉,pH 5.8。在2种培养基中,分别添加过滤灭菌的3种抗褐化剂聚乙烯吡咯烷酮、抗坏血酸和柠檬酸(表1)。
表1试验处理添加抗褐化剂类型及浓度
Table 1The types and concentrations of antioxidants
处理抗褐化剂类型浓度/g·L-1CK-01PVP0.22PVP0.63PVP1.04Vc0.15Vc0.26Vc0.47CA0.18CA0.29CA0.41.2.3愈伤组织诱导无菌环境剥离幼穗,将其切割成0.5 cm长短,并接入添加不同浓度的PVP,Vc或CA的愈伤诱导培养基中,使外植体尽量平铺整个培养皿。每个处理重复3次,在25℃下暗培养。每隔5 d观察记录1次外植体褐化和愈伤诱导状况,30 d统计愈伤组织诱导率。
1.2.4愈伤组织继代培养将幼穗诱导出的愈伤组织在愈伤继代培养基中按表1添加不浓度的PVP,Vc或CA,每个处理各接入10块大小相对均匀的愈伤组织,并称重,重复3次。每隔7 d称重1次并观察统计愈伤组织的褐化情况,培养35 d。
1.3统计分析
褐化程度采用目视法,褐化等级划分为三级:
+ 外植体轻度褐化,周围培养基色泽浅;
++ 外植体中度褐化,周围培养基颜色加深;
+++ 外植体褐化严重,周围培养基颜色深。
愈伤大小等级划分为三级:
A 等级为愈伤组织直径>0.5 cm;
B 等级为愈伤组织直径>0.2 cm;
C 等级为愈伤组织直径<0.2 cm。
诱导率= (愈伤个数/外植体数)×100%
褐化率=(褐化数/接种数)×100%
愈伤增长量=W1-W0
愈伤组织增长倍数=(W1-W0)/W0×100%
记接入继代培养基时愈伤组织重量为W0,后期称量重量为W1。
采用Excel 2007软件和DPS 7.05软件对数据进行统计分析。
2结果与分析
2.1愈伤组织生长曲线
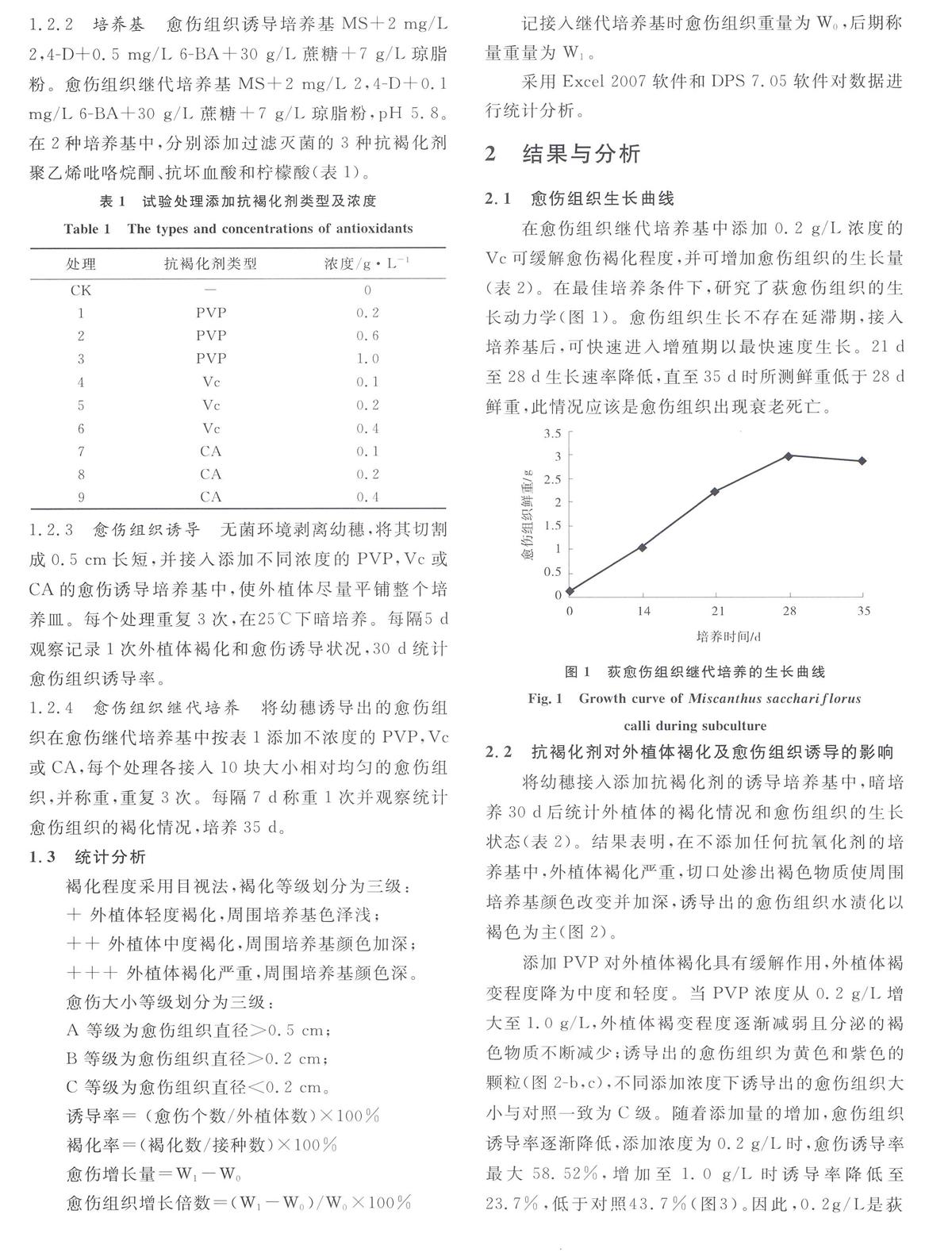
在愈伤组织继代培养基中添加0.2 g/L浓度的Vc可缓解愈伤褐化程度,并可增加愈伤组织的生长量(表2)。在最佳培养条件下,研究了荻愈伤组织的生长动力学(图1)。愈伤组织生长不存在延滞期,接入培养基后,可快速进入增殖期以最快速度生长。21 d至28 d生长速率降低,直至35 d时所测鲜重低于28 d鲜重,此情况应该是愈伤组织出现衰老死亡。
图1荻愈伤组织继代培养的生长曲线
Fig.1Growth curve of Miscanthus sacchariflorus
calli during subculture2.2抗褐化剂对外植体褐化及愈伤组织诱导的影响
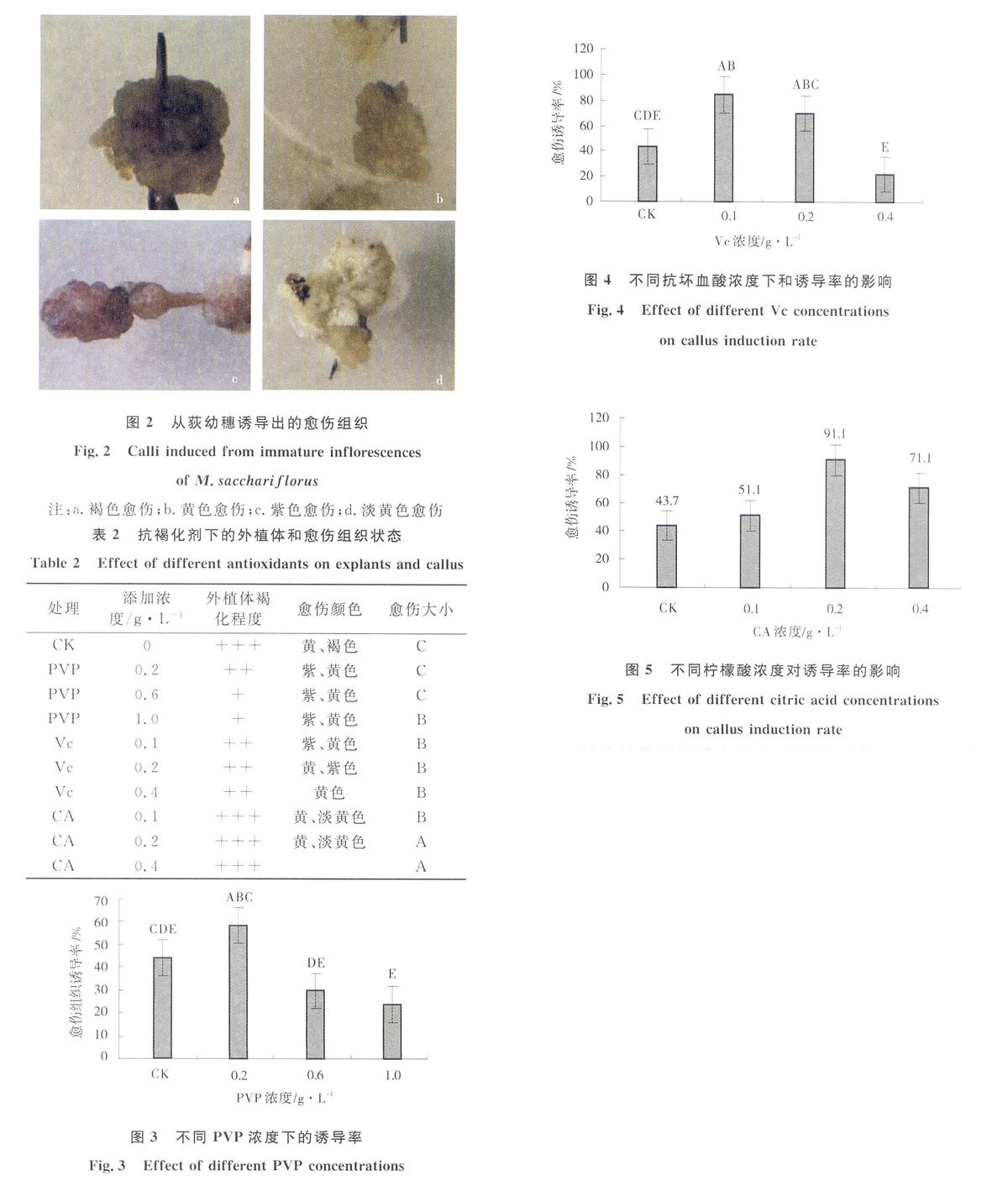
将幼穗接入添加抗褐化剂的诱导培养基中,暗培养30 d后统计外植体的褐化情况和愈伤组织的生长状态(表2)。结果表明,在不添加任何抗氧化剂的培养基中,外植体褐化严重,切口处渗出褐色物质使周围培养基颜色改变并加深,诱导出的愈伤组织水渍化以褐色为主(图2)。
添加PVP对外植体褐化具有缓解作用,外植体褐变程度降为中度和轻度。当PVP浓度从0.2 g/L增大至1.0 g/L,外植体褐变程度逐渐减弱且分泌的褐色物质不断减少;诱导出的愈伤组织为黄色和紫色的颗粒(图2b,c),不同添加浓度下诱导出的愈伤组织大小与对照一致为C级。随着添加量的增加,愈伤组织诱导率逐渐降低,添加浓度为0.2 g/L时,愈伤诱导率最大58.52%,增加至1.0 g/L时诱导率降低至23.7%,低于对照43.7%(图3)。因此,0.2 g/L是荻图2从荻幼穗诱导出的愈伤组织
Fig.2Calli induced from immature inflorescences
of M.sacchariflorus
注:a.褐色愈伤;b.黄色愈伤;c.紫色愈伤;d.淡黄色愈伤表2抗褐化剂下的外植体和愈伤组织状态
Table 2Effect of different antioxidants on explants and callus
处理添加浓
度/g·L-1外植体褐
化程度愈伤颜色愈伤大小CK0+++黄、褐色CPVP0.2++紫、黄色CPVP0.6+紫、黄色CPVP1.0+紫、黄色BVc0.1++紫、黄色BVc0.2++黄、紫色BVc0.4++黄色BCA0.1+++黄、淡黄色BCA0.2+++黄、淡黄色ACA0.4+++A图3不同PVP浓度下的诱导率
Fig.3Effect of different PVP concentrations
on callus induction rate愈伤组织诱导阶段的最适PVP浓度。
在添加不同浓度Vc的处理中,外植体褐化程度都达中度,褐化程度低于对照,即Vc能增强外植体的抗褐化能力;在所有添加浓度下诱导出的愈伤组织大小均为B级黄色和紫色颗粒,且大于对照C级(表2)。愈伤组织诱导率随着添加浓度从0.1到0.4 g/L增加不断下降。浓度为0.1 g/L时愈伤组织诱导率最大84.44%,愈伤诱导率提高程度达极显著(P<0.01,图4)。
图4不同抗坏血酸浓度下和诱导率的影响
Fig.4Effect of different Vc concentrations
on callus induction rate添加不同浓度的CA,外植体褐化程度均为严重,但褐化情况轻于对照。在添加浓度为0.2和0.4 g/L时愈伤组织的大小均为大颗粒A级,0.1 g/L时为B级大于对照C级。愈伤组织颜色以黄色和淡黄色为主(图2b,c),浓度增大至0.4 g/L时有褐色愈伤组织(图2a)出现。随着CA添加浓度的增大愈伤组织诱导率先增大后减小。在0.2 g/L时愈伤组织诱导率最大91.11%,达极显著提高(P<0.01),而在0.1 g/L时最小为51.11%大于对照43.7%。
图5不同柠檬酸浓度对诱导率的影响
Fig.5Effect of different citric acid concentrations
on callus induction rate试验结果可以看出添加不同抗褐化剂,荻外植体褐化程度强弱依次是CA >Vc> PVP;而获得的愈伤组织颗粒大小是CA>Vc>PVP,愈伤组织最大诱导率大小为CA>Vc>PVP。
2.3抗褐化剂对愈伤组织生长量和褐化的影响
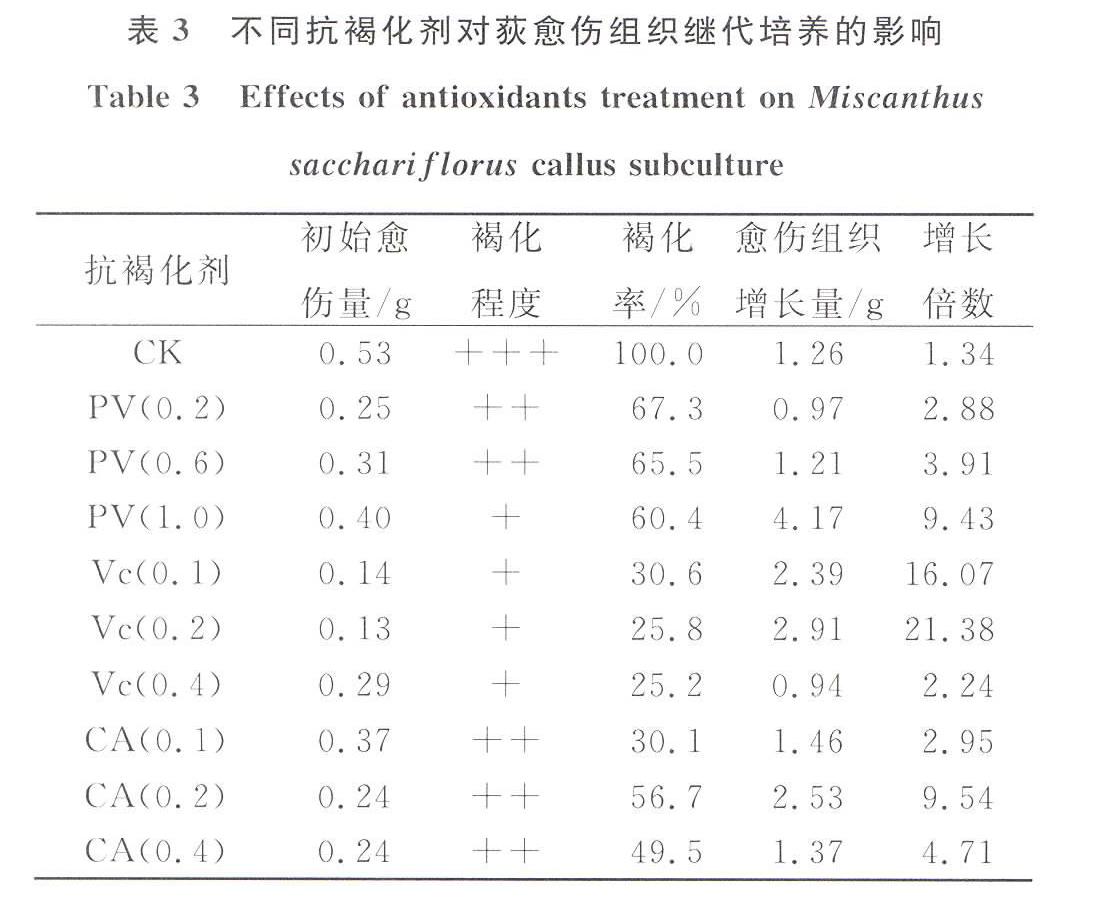
在愈伤组织继代过程中向培养基中添加不同浓度的PVP,35后称量愈伤组织重量,随着添加浓度的增大,愈伤组织生长率不断增大,PVP浓度为1.0 g/L时获得的愈伤增长倍数最大 , 最大倍数是9.43倍,愈伤褐化程度随着PVP浓度的增加而减弱(表3)。
向培养基中添加不同浓度Vc,结果表明(表3)随着添加浓度不断增大,愈伤组织的重量增加倍数先增大后减小,最大增加21.38倍,而最小增加3.24倍。褐化率整體下降,褐化率随着浓度的增加逐渐减小,最小褐化率25.2 %。因此,试验设计浓度中0.2 g/L是Vc最适添加浓度,此浓度下愈伤组织的褐化程度下降为轻度,褐化率为25.8%。
由表3可知CA对愈伤组织继代的影响随着添加量增大愈伤组织重量增加倍数为先增大后减小,0.2 g/L时愈伤组织最重量增加倍数是9.54倍。愈伤组织褐化率的变化是随着CA添加量增大褐化率先增大后减小。
表3不同抗褐化剂对荻愈伤组织继代培养的影响
Table 3Effects of antioxidants treatment on Miscanthus
sacchariflorus callus subculture
抗褐化剂初始愈
伤量/g褐化
程度褐化
率/%愈伤组织
增长量/g增长
倍数CK0.53+++100.01.261.34PV(0.2)0.25++67.30.972.88PV(0.6)0.31++65.51.213.91PV(1.0)0.40+60.44.179.43Vc(0.1)0.14+30.62.3916.07Vc(0.2)0.13+25.82.9121.38Vc(0.4)0.29+25.20.942.24CA(0.1)0.37++30.11.462.95CA(0.2)0.24++56.72.539.54CA(0.4)0.24++49.51.374.713讨论
褐化现象在芒属植物组织培养过程中普遍存在。周朴华等[14]在南荻的无性系建立研究中报道继代和分化过程中愈伤组织存在褐化死亡现象;周玥玥[15]研究五节芒时报道愈伤组织存在褐化情况;周娜[16]在建立芒转基因体系研究中同样报道芒愈伤组织存在褐化现象,并采取及时转新鲜培养基的措施来缓解褐化;夏亚男等[10]研究了抗褐化剂对南荻外植体和愈伤诱导率的影响,指出PVP对外植体的抗褐化效果最好,柠檬酸能显著提高愈伤组织诱导率但抗褐化效果不佳。本试验研究了向培养基中添加PVP,抗坏血酸和柠檬酸对荻外植体褐化和荻愈伤组织生长的作用。
PVP是酚类物质的专一性吸附剂,常用来吸附酚类物质和保护细胞器。有研究认为它可以吸附酚类物质,从而阻止酚类物质被氧化为醌类物质,使外植体褐化程度降低[17]。吴转娣等[18]研究了愈伤组织诱导阶段添加低浓度PVP能有效提高愈伤组织诱导率,本次试验也表明在愈伤组织诱导阶段低浓度PVP可以减轻荻外植体的褐化程度和提高愈伤组织诱导率,但高浓度PVP会降低愈伤诱导率,可能原因是PVP在吸附酚类物质的同时对培养基中其他激素类物质也有吸附[19],而在愈伤组织继代培养阶段高浓度PVP却能同时降低愈伤组织褐化程度和增加了愈伤组织生长量,有益于愈伤组织生长,此现象表明褐化在一定程度上会抑制愈伤组织的生长,同时也说明在继代过程中愈伤组织对激素类物质的依赖小于诱导过程。
CA具有酸性,将它添加到培养基中能够通过抑制多酚氧化酶的活性来抑制褐化,但是其对外植体具有一定的损害作用[17]。本研究显示在愈伤组织诱导阶段它对荻外植体的抗褐化作用不明显,却能够显著提高愈伤组织诱导率,与PVP和Vc比较它是提高愈伤组织诱导率的最佳添加剂;在愈伤组织继代阶段,CA虽对愈伤组织具有抗褐化和增加愈伤组织生长量的作用,但与其他2种抗褐化剂比较效果并非最佳。因此,与另外2种抗褐化剂比较CA仅在愈伤组织诱导阶段为提高愈伤组织诱导率的最佳抗褐化剂。
Vc具有还原性,不仅能够在植物受伤时清除产生的自由基,还可以通过将多酚氧化酶中的Cu2+还原成Cu+从而减少酚类物质的氧化达到减轻褐化的作用,因此在愈伤组织诱导过程中添加Vc能提高愈伤组织的诱导率[20,21],此外还具有促进愈伤组织生长的作用[22]。试验中,与其他2種抗褐化剂比较,Vc对荻愈伤组织诱导和愈伤组织生长的作用并不一致,在3种抗褐化剂中,添加Vc的最大愈伤组织诱导率居中,高于PVP,而低于CA,但在继代过程中,添加Vc的愈伤组织生长速度明显比添加另外两种抗褐化剂的快,可能原因是较高浓度Vc能够消除继代培养基中更多的有害物质且Vc对愈伤组织的毒害作用小。因此,在愈伤继代过程中向培养基中添加Vc能获得更大量的愈伤组织。
在愈伤组织诱导阶段添加PVP荻外植体褐变程度最低,说明PVP对荻外植体的抗褐化作用最好,添加CA极显著提高了愈伤组织诱导率,最大诱导率高于添加其他2种抗褐化剂的最大诱导率,因此,添加CA是最佳选择;在愈伤组织继代阶段添加VC获得的愈伤组织量最大是对照的21.38倍,以及褐化率低为25.8%,所以是继代过程最佳褐化抑制剂,每一种抗褐化剂都在不同阶段分别表现出优势,因此,在以后进一步研究中,可以考虑将多种不同抗褐化剂配合起来使用,以达到最佳的降低愈伤组织褐化和促进愈伤组织生长的效果。
综合分析添加不同浓度PVP、柠檬酸和Vc对荻外植体的抗褐化作用及愈伤组织诱导的影响,向愈伤组织诱导培养基中添加0.2 g/L的柠檬酸是荻愈伤组织诱导阶段的最佳选择。在荻愈伤组织继代过程中,培养基中添加0.2 g/L的抗坏血酸对愈伤组织抗褐化和促进愈伤组织生长的效果最佳。荻愈伤组织接入继代培养基后不存在延滞期而是直接进入增殖期,28 d后停止增长,因此,继代培养3~4周更换培养基有利于愈伤生长。
参考文献:
[1]易自力.芒属能源植物资源的开发与利用[J].湖南农业大学学报(自然科学版),2012,38(5):455-463.
[2]范希峰,左海涛,侯新村,等.芒和荻作为草本能源植物的潜力分析[J].中国农学通报,2010,26(14):381-387.
[3]高瑞芳,张建国.能源草研究进展[J].草原与草坪,2013,33(1):89-96.
[4]兰生葵,易弋,唐献平,等.芒属植物的开发利用及发展对策[J].可再生能源,2010,28(2):129-132.
[5]文浩,艾辛,蒋建雄,等.采用分子标记鉴定荻与南荻杂交种的真实性[J].草原与草坪,2013,33(4):9-11.
[6]杜雪玲,张振霞,刘萍,等.2,4D和6BA对多年生黑麦草愈伤组织诱导影响的研究[J].草原与草坪,2005,3(14):49-51.
[7]Asmus B,Hamme H.Enzymatic browning of vegetables.Calibration and analysis of variance by multiway methods[J].Chemmometrics Intelligent Laboratory Systems,1996,34(3):85-89.
[8]He Y,Guo X,Lu R,et al.Changes in morphology and biochemical indices in browning callus derived from Jatropha curcas hypocotyls[J].Plant Cell,Tissue and Organ Culture,2009,98:11-17.
[9]许传俊,李玲.蝴蝶兰外植体褐变发生与总酚含量,PPO,POD和PAL的关系[J].园艺学报,2006,33(4):671-674.
[10]夏亚男,蒋建雄,易自力,等.三种抗褐化剂对南荻外植体褐变及愈伤诱导率的影响[J].北方园艺,2014,17:93-96.
[11]徐春波,米福贵,王勇,等.影响冰草成熟胚组织培养再生体系频率的因素[J].草业学报,2009,18(1):81-85.
[12]王友生,王瑛,李阳春.三叶草愈伤组织诱导及分化的研究[J].草业学报,2009,18(2):212-215.
[13]李晶,孫吉雄,梁慧敏.日本矮生沿阶草愈伤组织的诱导及其分化[J].草业科学,2009,26(4):150-153.
[14]周朴华,何立珍.荻幼穗愈伤组织诱导及无性系的建立[J].湖南农学院学报,1992,18(3):569-573.
[15]周玥玥.五节芒再生体系的建立与多倍体的诱导研究[D].长沙:湖南农业大学,2012.
[16]周娜.芒(Miscanthus sinensis)的农杆菌遗传转化技术体系的构建研究[D].长沙:湖南农业大学,2013.
[17]Babbar S,Gupta S.Induction of androgenesis and callus formation in vitro cultured anthers of a myrtaceous fruit tree (Psidium guajava L.)[J].Journal of Plant Research,1986,99:75-83.
[18]吴转娣,赵俊,刘家勇,等.蔗胚性愈伤组织的诱导和抗褐化研究[J].中国糖料,2013,3(10):10-12
[19]Teixeria J B,Sondahl M R,Kirby E G.Somatic embryogenesis from immature inflorescences of oil palm[J].Plant Cell Reporters,1994,13:247-250.
[20]Joy R W,Patel K R,Thorpe T A.Ascorbic acid enhancement of organogenesis in tobacco callus[J].Plant Cell,Tissue and Organ Culture,1988,13:219-228.
[21]吕宗友,苏衍青,赵国琦,等.不同的防褐化措施对苏丹草愈伤诱导及抗褐化的有效研究[J].草业学报,2011,20(3):174-181.
[22]邱晓芳,朱笃,张志斌,等.杜仲愈伤组织继代培养及抑制褐化的研究[J].食品科学,2007,8(28):307-309.