磁小体介导制备转基因猪模型
2015-10-14陈克研陈振文董婉维郑志红
陈克研, 陈振文, 董婉维, 郑志红
(1. 中国医科大学实验动物部, 沈阳 110032; 2. 首都医科大学基础医学院实验动物学系, 北京 100069)
磁小体介导制备转基因猪模型
陈克研1, 陈振文2, 董婉维1, 郑志红1
(1. 中国医科大学实验动物部, 沈阳110032; 2. 首都医科大学基础医学院实验动物学系, 北京100069)
目的以磁小体(BMP)和聚乙烯亚胺(PEI)为载体,通过睾丸注射精子介导法建立转基因猪模型。方法将实验室保存的脂蛋白磷脂酶A2(Lp-PLA2)绿色荧光蛋白(GFP)质粒与BMP和PEI混匀,制备BMP-PEI- PLA2-GFP混合物,采用睾丸多点注射法接种巴马小型猪, 于接种后第2周、4周、6周至第20周采集精液,分别用RT-PCR和免疫荧光鉴定外源基因的表达情况; 取阳性精液,对母猪实施人工授精; PCR及RT-PCR对所产仔猪进行鉴定。结果精液中GFP基因于接种后第4周首现并持续至第16周; 荧光显微镜检查可观察到GFP蛋白主要表达于精子顶体后区及精子尾颈部; 经人工授精所产21头仔猪中,9头猪用PCR可检测GFP片段,用RT-PCR检测PLA2表达,该9头猪的表达量明显高于其它猪,总阳性率达42.86%。结论BMP和PEI结合可作为良好的携带外源基因的非病毒性载体,用该载体通过精子介导法可以达到迅速制备转基因猪的目的,其成本低、方法简单、便捷。
猪; 转基因; 磁小体(BMP); 聚乙烯亚胺(PEI); 精子介导的基因转移
随着生命科学研究和生物医药产业的迅猛发展, 人们对实验动物模型的要求越来越高, 对转基因动物的使用也逐渐增多, 转基因动物已成为医学科技工作者认识疑难和重要疾病发生机制、深入研究疾病的诊断和药物开发不可或缺的实验手段和材料[1]。目前, 常用的转基因动物制作方法有原核显微注射法、逆转录病毒侵染法、精子介导法、胚胎干细胞法,体细胞核移植法等[2]。高效的转基因载体是基因释放系统的核心,在转基因动物制作过程中至关重要,而一些载体具有细胞毒性,且很多载体对转基因质粒的携带能力有限,载体的缺陷制约了转基因的稳定性。
非病毒性载体是转基因动物制备方法的探索方向, 具有低免疫原性和易制备等特性。多聚乙烯亚胺(polyethylenimine, PEI)是近年来研究最为广泛的阳离子多聚物非病毒基因载体[3], 是一种很好的基因递送系统, 可减少PEI/DNA复合物在吞噬泡内富集并进而被降解的作用, 因而可以提高转染效率。磁小体(bacteria magnetic particles, BMP)是趋磁细菌细胞内合成的磁性纳米颗粒, 具有超强吸附DNA的能力, 可用于基因的转移、检测及靶向基因治疗[4]。研究表明, 将PEI与BMP结合后, 通过外加磁场进行靶向基因导入, 可有效提高转染效率和基因表达水平。本研究拟利用BMP的趋磁性和较强的吸附DNA能力, 结合PEI 转染效率高且不易降解等特点, 制备绿色荧光蛋白(GFP)标记的BMP-PEI-GFP复合物; 建立精子介导睾丸注射法接种巴马小型猪, 而后每隔1周采集精液进行检测, 观察其转染时间、转染效率及转染位置; 进一步用阳性精子对发情母猪实施人工授精进行体内实验; 对所产仔猪是否有外源基因表达进行鉴定,从而建立以磁小体为介质制作转基因猪的新方法。
1 材料与方法
1.1实验动物
巴马小型猪10头, 其中8月龄公猪6头, 10月龄母猪4头,购自北京实创世纪小型猪养殖基地[SCXK(京)2013-0008],在北京实创世纪小型猪养殖基地的普通级设施实验[SYXK(京)2013-0029]。
1.2质粒的提取与鉴定
经人工改造过的脂蛋白磷脂酶A2(Lp-PLA2)-GFP载体,由首都医科大学实验动物学系惠赠; 将其接种LB培养基扩大培养,用Axygen质粒大量提取试剂盒提取菌液质粒; 以延伸因子1α(EFlα)启动子F3做上游引物,Lp-PLA R1做下游引物,对上述提取的质粒DNA进行PCR鉴定; 此外,将该质粒转染293T细胞做进一步鉴定。
1.3BMP-PEI-PLA2-GFP复合物的制备
取1 μg PEI与1 μg GFP充分混匀, 再取0.5 μg BMP在超声振动仪中短暂混匀10~20 s; 迅速放置冰上,防止管内液体蒸发,如此反复几次直至BMP充分分散混匀后,加入预混的PEI-GFP溶液,并再次在超声振动仪中短暂混匀,加入PBS缓冲液稀释,4℃保存备用。
1.4睾丸注射法接种转基因复合物
取6头生长良好、采精容易、达到性成熟的雄性巴马小型猪,固定于解剖台上,耳缘静脉穿刺,静脉注射异丙酚(3.0 mg/kg)行诱导麻醉,待猪睫毛反射消失、肌张力下降,进行气管插管而后按5.0 mg/kg静脉泵注异丙酚维持麻醉; 睾丸整体依次用碘酊和体积分数75%酒精消毒(图1A),选取2~4个注射点(尽量选取成平行走向的曲细精管并确定注射点), 将1 mL BMP-PEI-LpPLA2-GFP转基因复合物注入(图1B、C), 对侧做同样处理; 将磁铁紧贴注射有质粒的睾丸外壁放置10 min(图1D)
1.5术后公猪精液检测
1.5.1基因组PCR检测每周以手握法采集巴马小型猪精液,将精液收集于集精杯中,并置于30~35 ℃保温水浴桶中; 用精子洗涤液离心洗涤2次每次5 min, 尽量除去含DNAase的精浆; 用基因组提取试剂盒提取精液中的DNA,根据GFP基因序列设计引物,配制PCR反应体系,进行PCR扩增上游引物(F): 5'-TGACCCTGAAGTTCATCT GCACCA-3', 下游引物(R): 5'-TTGATGCCGTTC TGC TTGTCG-3'。
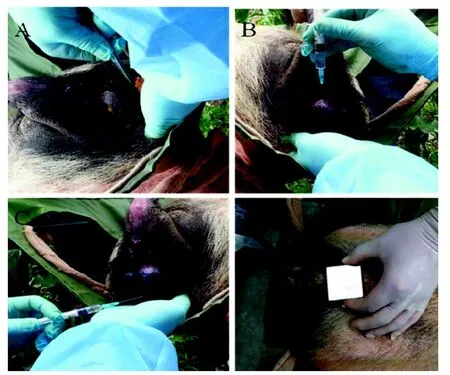
图1 睾丸注射Figure 1 Intratestis injection
1.5.2精子的荧光显微镜检查 取充分混匀的精子10 μL滴于干净的载玻片,盖上盖玻片; 于荧光显微镜下观察并计数同一视野中在激发荧光和长明光下观察到的精子,计算二者比率,同时记录出现绿色荧光的时间及强弱。
1.6人工授精
将保存的精液移至15~20 ℃的操作间,将集精杯迅速置于30~35 ℃的温水中,并立即评定精液品质,评定包括数量、气味、颜色、精子形态、密度、活力六项指标;将收集的精液做一定稀释后对处于发情期的3头母猪进行输精。在配种后不同时间段,分别用外部检查法、阴道检查法、孕酮检查法及子宫颈粘液检测法对人工授精后的母猪进行检测,观察其是否授精成功。
1.7初生仔猪鉴定
分别取所产仔猪耳部组织,倒入少量液氮迅速研磨,PBS制成乳悬液,基因组提取试剂盒提取DNA,选用GFP基因引物序列进行PCR扩增;另根据GenBank上猪的Lp-PLA和GAPDH基因序列分别设计一对引物, 引物序列见表1; 用SYBR Green荧光定量PCR试剂盒配制反应体系,用荧光定量PCR仪进行扩增; 反应程序为94 ℃预变性5 min,以下按94 ℃变性50 s,52 ℃退火50 s,72℃延伸1 min共进行30个循环,最后72 ℃延伸10 min。

表1 引物序列Table 1 Primer sequences
2 结果
2.1质粒鉴定
2.1.1PCR鉴定用RT-PCR对质粒DNA和空载体鉴定,大量提取的质粒可以检测到1 025 bp的目的条带(图2)。
2.1.2免疫荧光检测质粒转染293T细胞, 该质粒可以转染细胞, 并在免疫荧光显微镜下呈绿色(图3)。
2.2术后公猪精液检测
2.2.1精液DNA检测 注射后第2周起对精液DNA进行PCR扩增,观察是否有外源基因的导入以及导入的时间。GFP基因于接种后第4周首现并持续至第16周(图4)。

图2 质粒PCR检测Figure 2 PCR detection on the plasmid
2.2.2精液荧光显微镜检测荧光镜检可观察到表达GFP蛋白的精子,GFP蛋白主要表达于精子顶体后区及精子尾颈部(图5)。
2.3仔猪鉴定
2.3.1仔猪PCR鉴定分别提取21头仔猪DNA,进行PCR扩增,结果如图6所示,21头仔猪中4、6、7、10、12、13、14、17、20号猪均可检测到GFP表达,总阳性率达42.86%。
2.3.2仔猪Real-time PCR检测 转基因猪样品及内参GAPDH基因均扩增良好,其溶解曲线未见杂峰,通过电脑中输出的Ct值判定结果,根据公式△Ct=CtPLA2-CtGADPH计算转基因猪与对照之比的相对表达量, 结果如图7所示, 4、6、7、10、12、13、14、17、20号猪Lp-PLA的表达量均明显升高。
3 讨论
我国具有独特而又丰富的小型猪资源,它们在原产地均为长期近亲交配形成的封闭群体,具有体型小发育慢、性成熟早,遗传稳定,耐粗饲等特点,与国外的多品种杂交小型猪相比,具有明显的优势。以特有小型猪资源为基础,进行封闭繁育,不仅保存了珍贵的品种资源,而且使品种遗传及表型特征更加稳定,更加符合生命科学研究的要求,达到了保种与选育的双重目的[5,6]。

图3 质粒免疫荧光检测Figure 3 Immunofluorescence detection on plasmid

图4 不同时期猪精液DNA检测Figure 4 Pig sperm DNA detection at different periods

图5 精液免疫荧光检测Figure 5 Immunofluorescence detection on semen

1: 阳性对照; 2: 阴性对照; 3~23: 仔猪DNA图6 转基因猪PCR鉴定结果1: Positive control; 2: negative control; 3-23: piglet DNAFigure 6 PCR identification to transgenic pig
睾丸内注射转基因法[7]是将外源DNA直接注射到雄性动物睾丸内, 转染各个发生阶段的生精细胞,转染精子经体内成熟后采用自然交配或人工授精获得转基因动物。睾丸多点注射法由Yamazaki等[8]率先使用,并获得了转基因小鼠。Yin等[9]通过该法使外源基因在精子中稳定的高表达。本研究以巴马小型猪为对象, 成功建立了睾丸注射方法,其术后精液质量未受影响, GFP基因于第4周首现并持续至第16周, 与猪精液生长周期一致。进一步通过免疫荧光检测精子DNA双链完整性,结果GFP基因显色明显,精子DNA完整性好,为后期人工授精做准备。由此可见, 本方法具有较好的发展前景。

1号: 阳性对照; 2号: 阴性对照; 3~23号: 仔猪图7 转基因猪RT-PCR鉴定No.1: positive control; No.2: negative control; No.3-23: piglet DNAFigure 7 RT-PCR identification on transgenic pigs
BMP是趋磁细菌细胞内合成的纳米磁性颗粒,在固定化酶载体、制备磁性细胞、免疫检测、基因转移、DNA和RNA的分离和标记等几方面已进行了较多研究[10-12],但在转基因方面的应用较少。现有研究表明[13],将PEI与BMP颗粒结合后,通过外加磁场进行靶向基因导入,可有效提高转染效率和基因表达水平。当把与BMP-PEI连接的目的基因导入BHK-21细胞或小鼠肌肉组织,不仅使蛋白成功表达,而且转基因过程中靶细胞的死亡率始终保持在较低的水平,从而大大提高了转基因的成功率。在外加磁场作用下,transMAGPEI的转染效率比普通载体高几百倍,体内实验也证实[14]其转染效率明显提高。唐秋莎等[15]将质粒DNA与PEI修饰的锰锌铁氧体磁性纳米粒子结合形成复合物后,进行琼脂糖凝胶电泳,结果显示,PEI修饰后的锰锌铁氧体磁性纳米粒能与DNA有效结合。Soeren等[16]将含有荧光素酶基因的PCMVluc质粒与包被PEI的超顺磁性纳米颗粒形成复合物,转染猪的呼吸道上皮细胞,发现磁性纳米颗粒的转化效率分别比PEI和脂质体Lipofectamine介导的转染效率高400倍和2 500倍,并且磁颗粒与转染细胞孵育很短时间就得到了转基因的表达,孵育5 min时就有明显的表达,孵育15 min时转化效率达到最高。在国内,首都医科大学实验动物中心在合成BMPs-PEI-HMGR-shRNA-1568的基础上, 通过睾丸注射法导入小鼠睾丸, 获得了高效率的转基因阳性小鼠, 并证实细菌磁小体是一种良好的携带外源基因的纳米材料, 经睾丸注射可快速高效地生产基因修饰动物。因此, 把PEI等基因导入载体与磁性纳米颗粒结合而形成的新型基因导入载体具有极大的应用前景。
本研究利用BMP的趋磁性和较强的吸附DNA能力,结合PEI 转染效率高且不易降解等特点,制备BMP-PEI-GFP复合物; 通过睾丸注射法接种巴马小型猪,对所产21头仔猪,进行PCR鉴定,结果GFP表达的总阳性率达42.86%,提示由磁小体介导的转基因猪成功构建。可见,BMP和PEI结合可作为良好的携带外源基因的非病毒性载体,用该载体通过精子介导法可以达到迅速制备转基因猪的目的,其成本低、方法简单、便捷。
[1]Benam KH, Dauth S, Hassel B,et al.Engineered in vitro disease models[J] .Annu Rev Pathol, 2015, 10:195-262.
[2]Kvon EZ. Using transgenic reporter assays to functionally characterize enhancers in animals[J]. Genomics, 2015, 7543 (15):30012-30014.
[3]Merkel OM, Urbanics R, Bedocs P, et al. In vitro and in vivo complement activation and related anaphylactic effects associated with polyethylenimine and polyethylenimine-graft-poly block copolymers[J].Biomaterials, 2011, 32(21): 4936-4942.
[4]Colombo M, Carregal S, Casula MF, et al. Biological applications of magnetic nanoparticles[J]. Chem Soc Rev, 2012, 41 (11):4306-4334.
[5]吴艳花, 杜小燕, 陈振文, 等. 封闭群实验用小型猪遗传标准的建立[J]. 实验动物科学, 2010, 27(6):34-37.
[6]袁进, 顾为望. 小型猪作为人类疾病动物模型在生物医学研究中的应用[J]. 动物医学进展, 2011, 32(2):108-111.
[7] 戴建军, 李翔, 吴彩凤, 等. 小鼠睾丸注射不同转染试剂和注射方法对外源基因表达的影响[J].生物工程学报, 2014,30(10):1522-1530.
[8]Yamazaki Y, Fujimoto H, Ando H. In vivo gene transfer to mouse spermatogenic cells by deoxyribonucleic acid injection into seminiferous tubules and subsequent electroporation[J]. Biol Reprod, 1998, 59(6):1439-1444.
[9]阴彦辉,孙敏,陈庭锋, 等. 睾丸注射法制备携带山羊HFABP基因的转基因小鼠[J]. 遗传, 2012, 34(6):727-35.
[10] Li T, Gendelman HE, Zhang G, et al. Magnetic resonance imaging of folic acid-coated magnetite nanoparticles reflects tissue biodistribution of long-acting antiretroviral therapy [J]. Int J Nanomedicine, 2015, 10(6):3779-3790.
[11] Takamura T, Ko PJ, Sharma J, et al. Magnetic-particle-sensing based diagnostic protocols and applications[J]. Sensors (Basel)2015,15(6):12983-12998.
[12] Panagiotopoulos N, Duschka RL, Ahlborg M, et al. Magneti particle imaging: current developments and future direction [J]. Int J Nanomedicine, 2015, 10(4):3097-3114.
[13] Watcharin W, Schmithals C, Pleli T, et al. Detection o hepatocellular carcinoma in transgenic mice by Gd-DTPA and rhodamine 123-conjugated human serum albumin nanoparticles in T1 magnetic resonance imaging[J]. J Contro Release, 2015, 199:63-71.
[14] Puhl MD, Mintzopoulos D, Jensen JE, et al. In vivo magneti resonance studies reveal neuroanatomical and neurochemica abnormalities in the serine racemase knockout mouse mode of schizophrenia[J]. Neurobiol Dis, 2014, 73C:269-274.
[15] 唐秋莎, 张东生, 顾宁, 等. 新型纳米基因载体(PEI/Mn (0.5)Zn_(0.5)Fe_2O_4) 的制备、表征及体外实验[J]. 功能材料, 2007, 38(8):268-272.
[16] Sonawane ND, Szoka FC Jr, Verkman AS. Chloride accumu lation and swelling in endosomes enhances DNA transferb polyamine-DNA polyplexes[J]. J Biol Chem, 2003, 278(45)44826-44831.
Producing Transgenic Pig by Bacteria Magnetic Particles
CHEN Ke-yan1, CHEN Zhen-wen2, DONG Wan-wei1, ZHENG Zhi-hong1
(1. Laboratory Animal Center, China Medical University, Shenyang 110032, China; 2. Department of Laboratory Animal Science, Capital University of Medical Sciences, Beijing 100069, China)
ObjectiveTo establish sperm-mediatedtransgenic pigs models by intratestis injection with bacteria magnetic particles (BMP) and polyethylenimine (PEI) as a vector. MethodThe Lp-PLA2-GFP plasmid were mixed with BMP-PEI to BMP-PEI- PLA2-GFP, which were delivered into Bama Mini-pigs by intratestis injection. The sperm were collected in 2 weeks, 4 weeks, 6 weeks to 20 weeks after inoculation, and the GFP gene weredetected by RT-PCR and immunofluorescence. The positive sperms will be transferred through artificial insemination to sows to establish transgenic pigs. The piglets were detected by RT-PCR to GFP gene and Real-time PCR to Lp-PLA2 gene. ResultsThe GFP gene was first appearance in semen in 4 weeks after inoculation, and sustained through 16 weeks. The GFP protein mainly expressed in the sperm acrosome, sperm tail and neck area were observed by fluorescence microscopy. Through artificial insemination, 21 piglets were born, 9 of which were found with GFP segments, and the expression of PLA2 was obviously higher than that of other pigs, with a total positive rate of 42.86%. ConclusionThe BMP combined with PEI can serve as a good non viral vector carrying exogenous gene, and sperm-mediated method with the vector can achieve the purpose of rapid preparation of transgenic pigs, its cost is low, the method is simple and convenient.
Pig; Transgenic; Bacteria magnetic particles (BMP); Polyethylenimine (PEI);Sperm-mediated gene transfer
10.3969/j.issn.1674-5817.2015.04.005
Q95-33
A
1674-5817(2015)04-0288-06
2015-05-31
国家自然青年科学基金项目(31201758),中国博士后基金(2012M521919)
陈克研(1983-), 男, 博士, 讲师, 主要从事实验动物学研究。E-mail: chenkeyan888@163.com
