液相阻断ELISA法与正向间接血凝(IHA)法检测猪瘟抗体结果比较
2015-10-13刘胜宇胡元元
刘胜宇,汪 峰,胡元元
(江苏省徐州市动物疫病预防控制中心,江苏 徐州 221000)
液相阻断ELISA法与正向间接血凝(IHA)法检测猪瘟抗体结果比较
刘胜宇,汪峰,胡元元
(江苏省徐州市动物疫病预防控制中心,江苏 徐州 221000)
在我国,猪瘟抗体的检测过程中最为普遍采用的方法主要有正向间接血凝法(IHA)和液相阻断ELISA两种方法。这两种方法由于具有各自的优点而在农业生产、疫病控制和边境检验等环节中被广泛应用。本实验分别采用正向间接血凝法(IHA)和液相阻断ELISA方法对相同样品进行猪瘟抗体检测,对两种方法的符合度和差异性进行了统计。结果显示两种方法检测结果存在一定差异。在实际生产中,应根据具体情况选择合适的检测方法。
IHA;ELISA;抗体检测
由于猪瘟病毒(CSFV)具有的很强的致病力且感染猪群死亡率高,已经给养殖业造成了巨大的损失,世界各国都十分重视对该病的研究。在血清学诊断方面相继建立了多种方法进行猪瘟的诊断。其中主要有以抗原-抗体反应为基础的酶联免疫吸附试验(ELISA)、荧光抗体血清中和技术(FASN test)等方法。其中目前国际贸易中主要采用酶联免疫吸附试验(ELISA)包括阻断法和间接法。目前在我国,对猪瘟抗体的检测除采用ELISA方法外,在生产实践中,正向间接血凝(IHA)法是一种被广泛采用的方法。相对于ELISA方法,正向间接血凝(IHA)法具有成本低、试验简便容易操作、不需要专门的仪器等优点,所以正向间接血凝(IHA)法是很多中小型养殖场进行猪瘟抗体的检测的首选方法。本试验采用两种不同方法对相同的血清样本进行了猪瘟抗体的检测,并对结果进行了统计学的比较。
1 材料与方法
1.1原料与试剂
猪瘟病毒抗体检测试剂盒(阻断ELISA)购自北京爱德士元亨生物科技有限公司(美国IDEXX公司生产,试剂盒批号43200.Q651)。猪瘟正向间接血凝诊断抗原及稀释液、猪瘟阳性血清、阴性血清均由中国农业科学院兰州兽医研究所生产,批号为100605、100603和100712
检测样本选自江苏某养殖场的二元杂交猪。
1.2试验仪器
ST-360型酶标仪,上海科华实验系统有限公司;HWS-250型恒温恒湿培养箱,上海森信实验仪器有限公司;GENIUS 6K-M型台式离心机,长沙市鑫奥仪器仪表有限公司;WZ-2A型微量振荡器,北京海淀电子医疗器械仪器厂。
1.3试验方法
1.3.1阻断ELISA法检测猪瘟抗体
1.3.1.1操作步骤试剂盒在使用前,分别将各组分摇匀,18~25℃下放置30min以上以恢复试剂温度。
(1)在反应板上各空分别加入50μL样品稀释液。
(2)分别加入50μL的阳性对照和阴性对照,对照要做双份。
(3)将被检样品分别加入其余的检测孔,50μL/孔,为防止交叉污染,不同样本应更换滴头。
(4)将反应板用振荡器振荡,以混匀溶液。
(5)封条封闭微量反应板,20℃温箱中孵育2h。
(6)以300μL/孔的量,用洗液清洗微量反应板,每孔3次,清洗后在吸水纸上扣板,甩去多余液体。
(7)以100μL/孔的量在各孔中加入抗CSFV酶标抗体,封条封闭微量反应板,20℃温箱中孵育30min。(加样前要确保板空未完全干涸,CSFV酶标抗体需即取即用)
(8)重复步骤6的清洗步骤。
(9)以100μL/孔的量在各孔中加入底物溶液,在20℃避光的温箱孵育10min。(以加完第一孔后开始计时)
(10)以100μL/孔的量在各孔中加入100μL的硫酸终止液终止反应,终止反应的顺序要与加入底物的加样顺序保持一致。
(11)在酶标仪上检测各孔在450nm处的吸光度值。
1.3.1.2计算方法和判定标准阴性对照平均值=(阴性对照1OD450值+阴性对照2OD450值)/2
阳性对照平均值=(阳性对照1OD450值+阳性对照2OD450值)/2
样本阻断率=(阴性对照平均OD450值-样品OD450值)/阴性对照平均OD450值×100%
只有当阳性对照的阻断率大于50%且阴性对照的平均OD450值大于0.50,实验方成立,否则应重新检测。若样本的阻断率小于或等于30%,判为阴性(无抗CSFV抗体);如果被检样本的阻断率在30%~40%之间,该样本可判为可疑;若样本的阻断率大于或等于40%,判为阳性(存在CSFV抗体)。
1.3.2用IHA法检测猪瘟抗体
1.3.2.1操作步骤
(1)在血凝板上加入稀释液,50μL/孔。
(2)在第1排第1孔,加入1号待检血清50μL,并将枪头插入孔底,混匀,然后从该孔吸取50μL混匀后的液体,移入第2孔内,再混匀后吸取50μL混合液移入第3孔,……按照此规律一直倍比稀释至第9孔混匀,然后吸出50μL弃去。此时该待检血清的稀释度(稀释倍数)依次为1: 2、1:4、1:8、1:16、1:32、1:64、1:128、1:256、1:512(分别对应第一排1~9孔)。
取2号待检血清加入第2排;取3号待检血清加入第3排……均按上述方法进行稀释。
(3)其他待检测血清及阴、阳性对照血清均按照上述方法进行稀释。
(4)留好稀释液对照孔
(5)被检血清孔、阴性、阳性对照孔和稀释液对照孔,分别加入25μL血凝抗原(使用前血凝抗原要充恢复室温并充分摇匀,保证瓶底要无血球沉淀)。
(6)将血凝板置于微量振荡器上振荡1~2min,用白纸衬在血凝板下方观察各孔红血球是否和混匀,确保没有血球沉淀。盖上玻板,室温过夜,次日判定结果。
1.3.2.2判定方法将玻璃板移开,用白纸衬在血凝板下方观察稀释液对照孔和1:16阴性对照孔。血球均应全部沉于孔底形成边缘整齐的小圆点(无凝集),或仅出现血球大部分沉于孔底,边缘稍有少量血球悬浮(“+”凝集)。
阳性对照血清1~8孔(1:2~1:256)应仅有少量血球沉于孔底,大部分血球悬浮于孔内(“++-++++”凝集)为合格。如以上对照不成立,则实验方无效,应重新进行检测。当对照孔合格时,再观察检测孔,待检血清以呈现“++”凝集的最大稀释倍数为该份血清的抗体效价。当稀释倍数大于或等于1: 16时判为猪瘟抗体阳性。
2 结果与分析
2.1采用两种不同方法分别检测同一批样品中猪瘟抗体水平
分别采用两种方法对同一批,共计350份血清进行检测。采用液相阻断ELISA法检测出阳性样品206份,总阳性率为58.9%;采用正向间接血凝法(IHA)检测出阳性样品267份,总阳性率为76.3%。

表1 两种不同方法分别检测同一批样品的检测结果
2.2两种方法检测同一批样品,检测结果的符合度及相关性
分别采用液相阻断ELISA法和正向间接血凝法(IHA)检测同一批共计350份样品的猪瘟抗体水平,结果如表2、表3所示,两者总体符合率为68.3%。采用卡方检验,对两种方法的相关性进行检验如表4,发现两种方法检测结果存在差异。(x2=32.4,p<0.01)
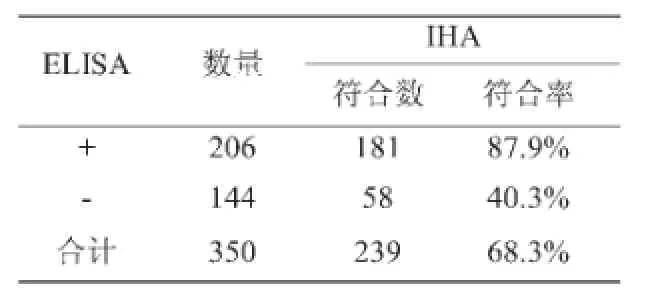
表2 正向间接血凝法(IHA)与液相阻断ELISA法检测结果的符合情况

表3 液相阻断ELISA法与正向间接血凝法(IHA)检测结果的符合情况
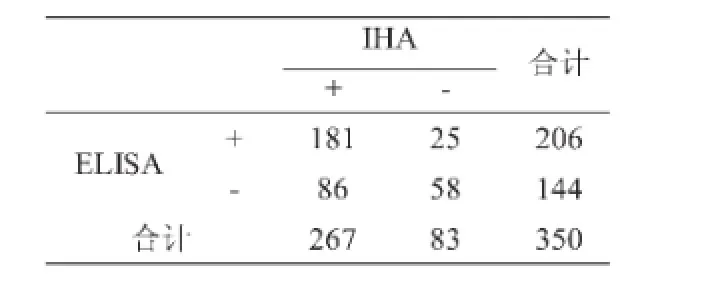
表4 两种不同方法分别检测同一批样品的检测结果相关性
3 讨论
试验结果显示,两种方法检测结果存在一定的差异。经液相阻断ELISA法检测呈阳性的样品,再采用正向间接血凝的方法检测其结果多为阳性。(两者符合率为87.9%);而经正向间接血凝的方法检测呈阳性的样品,再采用液相阻断ELISA法检测,两者符合率不高(其结果符合率仅为67.7%)。两种方法检测猪瘟抗体总符合率为68.3%,经卡方检验,两种方法存在差异。造成其结果差异的因素很多,在进行正向间接血凝法检测时,采用人工稀释和读数的过程会产生较大的误差,IHA诊断试剂中,红细胞来源、致敏技术、血清中杂质、其他病原微生物污染等因素也会引起反应的失败或产生非特异性反应。另外,猪瘟正向间接血凝方法检测的是血清中的全病毒抗体,由于牛病毒性腹泻病毒(BVDV)与猪瘟病毒拥有相同的糖蛋白抗原,所以存在血清学的交叉反应。而液相阻断ELISA方法仅测E2蛋白产生的抗体。有资料显示液相阻断ELISA法检测到的抗体与中和抗体具有高度的正相关性,在一定的抗体区间内可以用阻断率的高低来估测猪群的保护性抗体水平,并与牛病毒性腹泻病毒(BVDV)没有交叉反应。相对而言,正向间接血凝法不具备上述优势。但正向间接血凝法具有试剂价格低廉、操作方法简便、不需要专门仪器等优点,更适用于中小型猪场了解掌握猪瘟免疫情况。两种方法各自具有不同的特点和优势,所以在生产实践中,要结合实际情况来选择适合的检测方法。
从略)
10.3969/J.ISSN.1671-6027.2015.07.020
刘胜宇(1982~),辽宁省辽阳市人,硕士,兽医师,主要从事动物传染病的预防和控制工作
